NLRP3炎性小体在脂多糖诱导的高糖心肌细胞缺氧复氧损伤中的作用及机制
2022-09-30夏中元
李 璐 邱 珍 张 艺 田 浩 夏中元
糖尿病患者心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury, MIRI)的发生率、梗死心肌的面积及充血性心力衰竭的发生率均显著高于非糖尿病患者。MIRI合并脓毒症患者的心肌常同时面临供氧不足和氧利用受损的双重打击。脓毒症条件下,病原相关分子模式(pathogen-associated molecular patterns,PAMP)和损伤相关分子模式(danger-associated molecular patterns, DAMPs)是缺血再灌注期间心肌损伤加重的重要机制,而炎性反应和氧化应激也与脓毒症诱导的心肌损伤密切相关。
NLRP3炎性小体是一种细胞内多蛋白复合物,由Nod样受体蛋白3(nod-like receptor protein-3, NLRP3)、含有CARD的凋亡相关斑点样蛋白(ASC) 和半胱天冬酶-1前体(pro-caspase-1)组成。NLRP3炎性小体诱导pro-caspase-1进行自我切割和活化,刺激促炎性细胞因子IL-1β和IL-18的成熟和释放,引起炎性细胞积聚,放大炎性反应,诱导程序性细胞死亡。外源性刺激脂多糖(LPS)可通过诱导活性氧(ROS)产生、活化NLRP3炎性小体介导炎性反应和细胞焦亡的发生。糖尿病状态下,高血糖引起的代谢紊乱、氧化应激增加以及线粒体功能障碍导致ROS产生增加,加重糖尿病心肌损伤。笔者前期研究表明,ROS诱导NLRP3炎性小体激活介导的caspase-1依赖性细胞焦亡在糖尿病大鼠MIRI中起重要作用。
本研究拟探讨NLRP3炎性小体的激活对LPS诱导的H9C2心肌细胞高糖H/R损伤的作用及其潜在机制。
材料与方法
1.细胞与试剂:H9C2大鼠心肌细胞系购自中国科学院细胞库(上海);10%胎牛血清(FBS)购自美国Gibco公司;乳酸脱氢酶 (LDH)、超氧化物歧化酶 (superoxide dismutase, SOD) 和cell counting kit-8(CCK-8)试剂盒购自中国南京建成生物科技有限公司;线粒体ROS检测采用MitoTracker Red CMXRos试剂盒购自上海翔圣生物科技有限公司;Trizol试剂盒购自美国Invitrogen公司;反转录试剂盒购自日本TaKaRa Bio公司;NF-κB抗体购自美国Cell Signaling Technology (CST) 公司;ASC、caspase-1抗体购自美国Santa Cruz Biotechnology(Santa)公司;IL-1β抗体购自英国Abcam公司;NLRP3抗体购自美国Novus Biologicals公司;荧光二抗(山羊抗兔)购自美国CST公司。
2. H9C2心肌细胞培养与分组:H9C2心肌细胞用含10%的胎牛血清、1%双抗的DMEM于37℃、5%CO的细胞培养箱中进行培养。每两天更换培养基,当细胞密度达到80%~90%时,用0.05%胰蛋白酶消化细胞,将细胞接种在6孔板或96孔板中,置于细胞培养箱中培养。实验前12h,更换为无血清培养基,对细胞进行饥饿处理。细胞随机分为4组,即高糖(H)组(葡萄糖终浓度为30mmol/L的高糖DMEM培养基培养48h)、高糖+缺氧/复氧(H+H/R)组(高糖DMEM培养基培养48h后,于含95%N、5%CO和1%O三气培养箱中缺氧6h,然后于正常培养箱复氧4h)、高糖+LPS+缺氧/复氧(H+LPS+H/R)组(高糖培养基培养24h,再加入终浓度为1μg/ml的LPS继续培养24h,后进行缺氧6h复氧4h操作)和高糖+LPS+BAY11-7082干预+缺氧/复氧(H+LPS+BAY+H/R)组(施加LPS处理2h后,给予5μmol/L的BAY11-7082)。
3.心肌细胞活力检测:采用CCK-8测定试剂盒进行细胞活力测定。待细胞H/R刺激结束后,调整96孔板中细胞个数约为1×10个/毫升,每孔100μl培养基中加入10μl CCK-8试剂,于37℃培养箱避光孵育3h,酶标仪下测定450nm处吸光度()值。
4.细胞培养基中乳酸脱氢酶(LDH)水平检测:采用LDH测定试剂盒检测细胞培养基上清液中的LDH活性以评估细胞损伤,操作严格按照试剂盒说明书进行,混合试剂后,在室温下放置5min,酶标仪下测定450nm处吸光度值。
5.线粒体ROS检测:采用Mito Tracker Red CMXRos试剂盒检测线粒体ROS产生,步骤如下:细胞刺激结束后,吸去旧培养基,用PBS洗2遍,加入染色工作液,于37℃培养箱避光孵育30min;然后弃掉染色工作液,PBS洗3遍,加入新鲜培养基,于荧光倒置显微镜下进行观察和拍摄。
6.心肌细胞NLRP3、ASC、caspase-1和IL-1β的mRNA 表达测定:实时荧光定量PCR检测LRP3、ASC、caspase-1和IL-1β mRNA表达。使用Trizol试剂从细胞中提取总RNA,然后用反转录试剂盒将1μg的总RNA反转录成cDNA。使用NLRP3、ASC和caspase-1特异性引物通过定量RT-PCR仪进行总体积20μl反应体系进行扩增。读取Ct值,用2表示目的基因mRNA相对于对照组的表达量。
7.Western blot法检测心肌细胞NF-κB、NLRP3、ASC、caspase-1和IL-1β蛋白水平:使用含有蛋白酶抑制剂苯甲基磺酰氟(PMSF)和蛋白酶抑制剂混合物的预冷蛋白裂解液(RIPA)裂解心肌细胞,4℃下12000r/min离心15min,取上清保存。用BCA法测定蛋白浓度,加5×上样缓冲液混匀煮沸10min。用浓度为10%的SDS-PAGE凝胶进行电泳,并湿转于PVDF膜上。将PVDF膜在5%脱脂奶粉中室温封闭1h,分别加入NF-κB(1∶1000)、NLRP3(1∶200)、ASC(1∶200)、caspase-1(1∶200),IL-1β(1∶1000)的一抗4℃孵育过夜。TBST洗涤3次,每次10min,用荧光二抗(1∶15000)室温孵育1h,TBST洗涤3次,每次10min。采用Odyssey双色红外激光扫描显影仪检测蛋白条带,以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值表示目的蛋白表达水平。
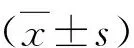
结 果
1.各组心肌细胞活力、上清LDH水平和线粒体ROS产生水平比较:与H组比较,H+H/R组细胞活性降低,LDH水平升高,线粒体ROS产生增加(<0.05);LPS处理后,H+LPS+H/R组与H+H/R组比较,细胞活性进一步降低,LDH水平进一步升高,线粒体ROS水平进一步增加(<0.05);使用BAY11-7082干预后,H+LPS+BAY+H/R组与H+LPS+H/R组比较,细胞活性增加,LDH水平下降,线粒体ROS产生减少(<0.05,图1)。

2.各组心肌细胞NLRP3、ASC、caspase-1和IL-1β的mRNA 表达的比较:与H组比较,H+H/R组细胞NLRP3、ASC、caspase-1和IL-1β的mRNA 表达上调(<0.05);LPS处理后,H+LPS+H/R组NLRP3、ASC、caspase-1和IL-1β mRNA表达较H+H/R组上调(<0.05)。BAY11-7082干预后,与H+LPS+H/R组比较,H+LPS+BAY+H/R组细胞ASC、caspase-1和IL-1β的mRNA表达下调(<0.05),NLRP3 mRNA表达差异无统计学意义,详见表1。

3.各组心肌细胞NF-κB、NLRP3、ASC、caspase-1和IL-1β蛋白表达比较:与H组比较,H+H/R组心肌细胞NF-κB、NLRP3、ASC、caspase-1和IL-1β蛋白表达上调(<0.05);LPS处理后,H+LPS+H/R组心肌细胞NF-κB、NLRP3、ASC、caspase-1和IL-1β蛋白表达较H+H/R组显著上调(<0.05);BAY11-7082干预后,与H+LPS+H/R组比较,H+LPS+BAY+H/R组细胞NF-κB、NLRP3、ASC、caspase-1和IL-1β蛋白表达明显下调(<0.05),详见图2、表2。


讨 论
与非糖尿病患者比较,糖尿病患者罹患心血管事件的风险更高,预后更差。缺血性心脏病患者在脓毒症期间氧耗的增加可以导致更加严重的急性冠状动脉综合征。LPS是革兰阴性细菌细胞壁的抗原成分,也是Toll样受体4激活剂,可以促进各种炎性细胞因子的上调,而这些细胞因子在炎性反应的诱导和调节中起关键作用。虽然相关研究表明,LPS处理可加重MIRI和H9C2心肌细胞损伤,但其与糖尿病状态下的MIRI研究鲜有报道。因此,本研究中使用1μg/ml的LPS刺激H9C2心肌细胞,结果表明LPS可以显著降低细胞活力,增加LDH水平,进而加重高糖下H/R诱导的H9C2细胞损伤。
NLRP3炎性小体作为炎性反应的介质,可以识别LPS、ATP、葡萄糖、ROS等PAMP和DAMP的刺激。NLRP3炎性小体的活化机制涉及NLRP3寡聚化、ASC募集和caspase-1活化,活化的caspase-1切割白IL-1β和IL-18前体,将其激活成为有活性的IL-1β和IL-18,并通过GSDMD细胞膜孔道将其释放至细胞外,招募更多炎性细胞,扩大炎性反应,引发下游促炎信号通路的级联反应,最终可使细胞发生自噬或焦亡等程序性死亡。近年来研究表明,抑制NLRP3介导的焦亡作用,可以减轻药物诱导或心肌梗死后的心肌损伤。
ROS可介导细胞自噬、焦亡和炎性反应的发生。据报道,LPS诱导心肌细胞的损伤主要依赖过量生成的ROS。此外,糖尿病的高血糖、高胰岛素血症和胰岛素抵抗状态增加了氧化应激水平,导致糖尿病心肌中各种细胞因子的过度产生。因此,高血糖增加ROS的产生,引发caspase-1依赖性的细胞焦亡可能是糖尿病性心肌病的重要病理机制之一。笔者前期研究发现,NLRP3激活诱导的caspase-1依赖性细胞焦亡导致糖尿病MIRI的发生与发展。本研究中笔者用LPS作为PAMP信号刺激H9C2心肌细胞,结果表明,经过LPS处理的H9C2心肌细胞在高糖H/R刺激下,心肌细胞活性明显降低,LDH释放水平、线粒体ROS产生明显增加,NLRP3、caspase-1和IL-1β的表达明显上调, H9C2心肌细胞损伤明显加重。因此,笔者推测LPS作为PAMP因子可通过增加线粒体ROS产生激活NLRP3炎性小体,诱导caspase-1和IL-1β炎性反应信号转导途径,进而加重高糖H/R诱导的H9C2细胞损伤。
NF-κB的持续激活在调节细胞增殖/凋亡和炎性反应期间炎性细胞因子水平增加中具有重要作用,也是NLRP3的上游激活因子。BAY11-7082是NF-κB的选择性抑制剂,它不可逆地抑制NF-κB磷酸化并直接抑制ATP酶活性,从而使ASC寡聚化并激活caspase-1,从而减少NLRP3炎性小体激活。BAY11-7082是一种有效的炎性小体抑制剂,可通过抑制NF-κB活性进而抑制NLRP3炎性小体活性,明显减轻组织炎性损伤。因此,笔者选择BAY-11-7082作为NLRP3炎性小体抑制剂,探究NLRP3炎性小体在LPS加重H9C2心肌细胞高糖H/R损伤的作用机制。笔者发现当使用炎性体抑制剂BAY11-7082后,心肌细胞活性明显增加,LDH水平和线粒体ROS的产生明显减少,并且NF-κB、NLPR3、ASC、caspase-1和IL-1β的蛋白表达也明显下调。以上结果表明,BAY11-7082作为炎性小体抑制剂可以抑制NLRP3炎性小体活化,进而减轻LPS诱导的H9C2心肌细胞高糖H/R损伤。
综上所述,本研究结果表明,LPS通过增加线粒体ROS 产生,激活NLRP3炎性小体介导的caspase-1信号途径,加重高糖H/R诱导的H9C2心肌细胞损伤。同时笔者还发现,BAY11-7082炎性体抑制剂可通过抑制NLRP3炎性小体激活来减轻LPS诱导的H9C2细胞高糖H/R损伤。因此,NLRP3炎性小体可能是减轻脓毒症期间心肌I/R损伤的新的治疗靶点。然而,本研究为细胞实验,存在着一定的局限性,还有待于进一步开展临床实验验证。
