Ⅰa期肝细胞癌腹腔镜肝切除术后“教科书式结局”的远期预后及影响因素分析
2022-07-05卢毅刁永康叶泰伟刘军伟沈国樑刘杰黄东胜张成武
卢毅,刁永康,叶泰伟,刘军伟,沈国樑,刘杰,黄东胜,张成武
(浙江省人民医院/杭州医学院附属人民医院 肝胆胰外科,浙江 杭州 310014)
肝切除是目前肝细胞癌(hepatocellular carcinoma,HCC)最有效的根治手段之一,随着腹腔镜技术的成熟,对于Ⅰa期HCC,有经验的大中心可常规实施腹腔镜肝切除(laparoscopic hepatectomy,LH)[1]。当前评价手术质量主要依赖某些单一指标,如是否R0切除、出血量、围手术期病死率、并发症发生率、住院时间等[2-3],这些单一指标很难准确反映整体手术质量。而“教科书式结局(textbook outcome,TO)”将多个参数组合成一个单独定义的质量指标,涵盖R0切除、无中转开腹、围手术期无输血、术后无并发症、术后90 d无死亡、住院时间无延长和无再入院[4],代表一种理想的术后短期预后,能从多层面更准确全面地评价手术质量。本研究分析影响Ⅰa期HCC接受腹腔镜肝切除术后发生TO的独立危险因素,评估TO与远期预后的关系。
1 资料和方法
1.1 一般资料
纳入2015年1月至2018年12月在我院320例接受腹腔镜肝切除的Ⅰa期HCC患者。纳入标准:(1)术前临床诊断HCC,术后病理证实;(2)单发肿瘤,直径≤5 cm,CNLC分期Ⅰa期;(3)肝功能Child-Pugh A或B级,吲哚菁绿排泄试验ICG-R 15 min<10%,正常肝脏残余肝体积(future liver remnant,FLR)/标准肝体积(standard liver volume,SLV)≥30%,慢性肝炎、脂肪肝患者FLR/SLV≥40%,肝硬化患者FLR/SLV≥50%;(4)接受腹腔镜肝切除。排除标准:(1)术前接受其他抗肿瘤治疗;(2)合并严重器官功能障碍;(3)腹腔镜手术禁忌证;(4)姑息性切除;(5)失访患者。本研究经医院伦理委员会审批,所有患者均签署知情同意。
1.2 观察指标
收集所有患者术前基线特征变量,包括年龄、性别、长期饮酒史(每天饮酒,持续时间≥1年)、糖尿病史、体重指数(BMI)、体力评分(performance status score)、合并乙型肝炎、合并肝硬化、肝功能Child-Pugh分级、术前血小板计数、术前谷丙转氨酶、术前谷草转氨酶、术前AFP等相关数据。
手术及肿瘤学变量包括肿瘤位置、大小、镜下血管侵犯、分化程度、包膜是否完整、手术时间、出血量、肝切除范围和切除类型、肿瘤切缘等。肝切除范围分为大范围肝切除和小范围肝切除,大范围肝切除指切除三个及以上肝段,小范围肝切除指切除两个及以下肝段。切除类型分为解剖性肝切除和非解剖性肝切除[5]。
TO为复合性指标,定义为:(1)R0切除;(2)无中转;(3)围手术期无输血;(4)术后30 d无并发症;(5)术后住院时间无延长;(6)出院后30 d无再入院;(7)术后90 d无死亡。同时满足上述七个条件才认为达到TO[6-7]。R0 切除定义为标本切缘在显微镜下未见癌细胞。术后并发症包括急性肝衰竭、出血、感染、胸腹腔大量积液等。术后住院时间延长指住院时间>第75百分位数。
1.3 随访和研究终点
所有患者随访时间截至2021年9月30日。研究终点包括总生存(overall survival,OS)时间和无复发生存(relapse free survival,RFS)时间。肝癌复发定义为影响学证据下肝内重复出现具有肝癌特点的结节,或出现非原发性肝癌所指的甲胎蛋白(AFP)异常升高。
1.4 统计学分析
2 结果
2.1 基线资料比较
320 例患者中,术后90 d存活319 例(99.7%),R0 切除311 例(97.2%),出院30 d无再入院309 例(96.6%),术中无中转开腹302 例(94.3%),围手术期无输血275例(85.9%),术后30 d无并发症266例(83.1%),术后住院时间无延长240例(75.0%),最终226例(70.6%)达到TO(TO组),其余94例未达到TO(非TO组)。两组BMI≥28 kg/m2、长期饮酒史、肝功能Child-Pugh B级、术中出血量>400 mL、大范围肝切除患者比例及肿瘤最大径、手术时间和术后住院时间存在统计学差异(P<0.05),其余指标无统计学差异(P>0.05),见表1。

表1 两组患者基线资料比较
非TO组94例患者中,55例患者术后30 d内出现并发症,主要包括:切口感染61.8%(34/55),术后大量胸腔积液20.0%(11/55),肺部感染16.4%(9/55),出血14.6%(8/55),肝功能衰竭5.6%(3/55),胆漏3.6%(2/55)。
在本研究中,未中转开腹也作为TO的指标之一,共19例出现中转开腹,主要原因包括肿瘤位置显露困难42.1%(8/19),出血31.6%(6/19),组织粘连严重26.3%(5/19)。
2.2 影响TO的危险因素
采用单因素及多因素Logistic回归分析了接受LH的Ⅰa期肝癌患者术后未达到TO相关的风险因素。结果显示,肥胖、饮酒史、Child-Pugh B级、肿瘤最大径>2 cm以及行大范围肝切除的患者更难达到TO结局,差异具有统计学意义(P<0.05),见表2。
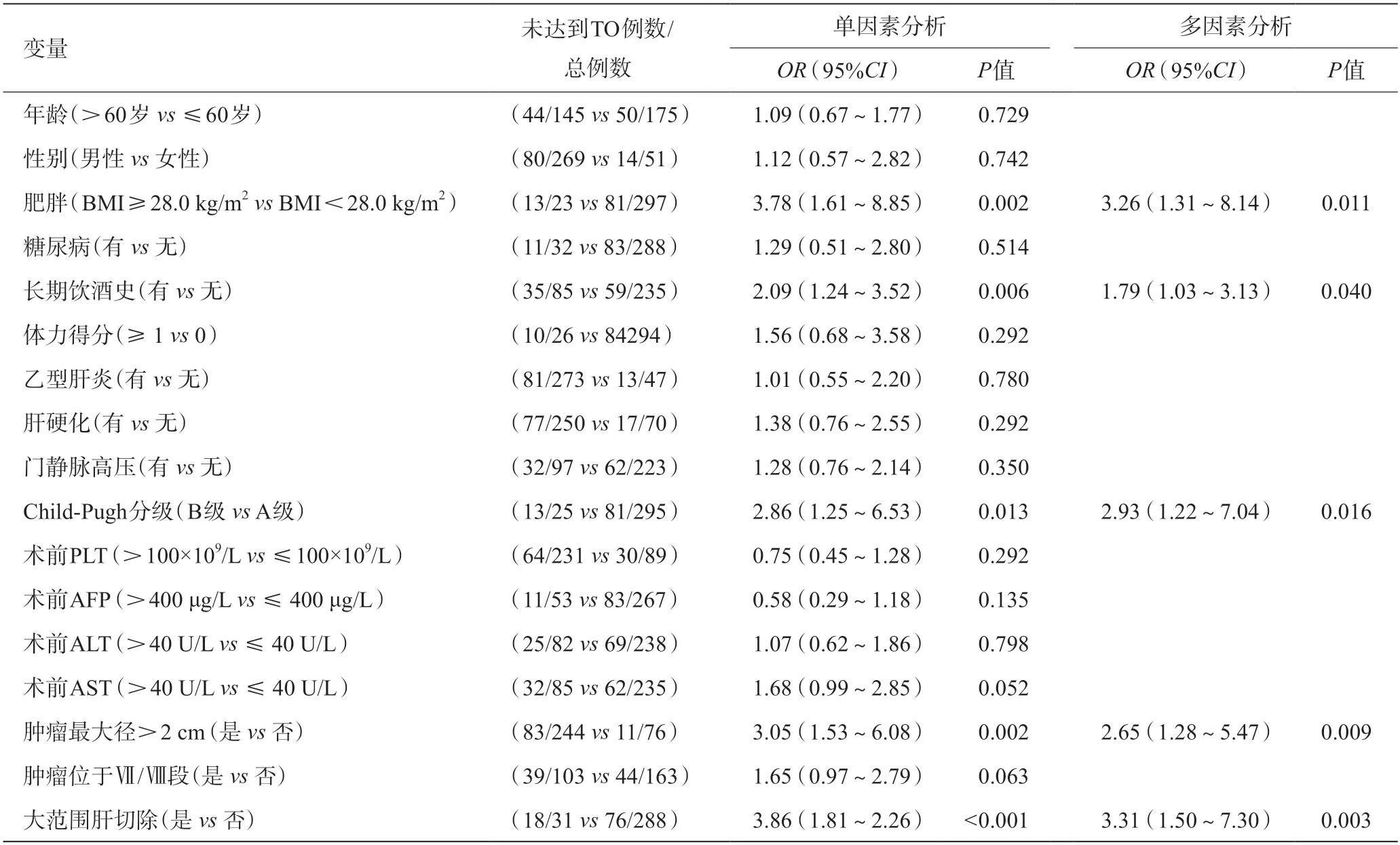
表2 单因素及多因素Logistic回归分析影响TO的危险因素
2.3 生存分析
剔除1 例术后90 d内死亡病例,其余319 例采用Kaplan-Meier法分别为TO组及非TO组的患者绘制OS及RFS曲线(图2)。TO组中1 年、3 年及5 年OS分别为97.7%、87.5%及77.2%,RFS为88.8%、68.1%及51.9%。非TO组中1年、3年及5年OS分别为92.5%、78.1%及72.8%,RFS为75.1%、60.2%及40.3%。通过Log-rank检验进一步分析,TO组与非TO组对比,OS与RFS均具有统计学差异,P值分别为0.036及0.024。
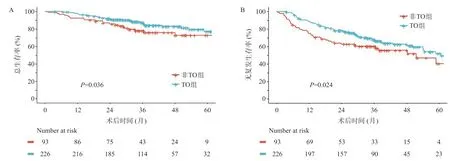
图1 TO组及非TO组的OS(A)及RFS(B)生存曲线
3 讨论
近年来,随着精准外科和微创外科手术技术的不断发展,肝癌患者手术相关病死率明显降低,但由于缺乏系统全面的评价标准,肝癌患者的术后并发症发生率、住院时间、再入院率等方面仍无法令人满意[8]。TO是一个综合衡量指标,将最理想的手术结果组合成单一参数,用于评估患者预后、外科护理质量、检测医院间变异[6]。2013 年Kolfschoten等[9]率先提出TO这一概念并应用于评价结肠癌手术质量,此后逐渐用于评估肝切除、肝移植的围手术期质量[10-11],目前国内还未见报道用于评估早期HCC腹腔镜肝切除手术。在满足TO所需的七项指标中,无中转开腹、围手术期无输血、术后无并发症、术后住院时间无延长比例较低,提示中转开腹、围手术期输血、术后并发症是影响TO的主要因素。
本研究纳入320例接受LH的Ⅰa期HCC患者,术后90 d内死亡1例,死于术后肝衰竭,病死率为0.31%,与Ciria等[12]的研究结果0.39%相似。术后30 d无并发症266例(83.1%)也接近之前Tsilimigras等[13]报道的86%。研究表明,R0切除和术后30 d无并发症的患者长期预后明显改善[14-15],而本研究中TO包含了以上两项指标。226例(70.6%)患者获得了TO,与意大利Görgec等[6]的数据74.8%相近。考虑到手术中转开腹率会影响腹腔镜肝切除的预后[16],本研究在定义TO时增加了无中转开腹这一指标,中转开腹的原因主要包括出血、肿瘤位置特殊显露困难、上腹部手术后严重致密粘连、术中意外损伤、气体栓塞等。因此,全面详细的术前评估是必不可少的,加上精细的操作和娴熟的技术,尽可能避免中转开腹,从而获得TO带来潜在的受益。
多因素分析显示,影响TO的因素包括:BMI、饮酒史、肿瘤最大径、是否大范围肝切除。究其原因可能是:(1)高BMI与HCC患者肝脂肪变性、NFALD相关,肥胖患者手术难度大,术后并发症多,短期预后也较差[17]。肥胖患者多数合并不同程度脂肪肝,切肝时创面易出血,增加围手术期输血可能性;且腹腔内网膜浑厚,一定程度上影响手术操作空间;皮下脂肪层厚增加术后切口感染的几率。(2)饮酒可改变肠道正常微生物菌群,损害黏膜免疫系统,乙醇及其代谢物有肝毒素作用,可致肝损伤加重肝硬化,增加术后肝衰竭风险,延长住院时间;术后肠道菌群易移位,增加感染风险,影响短期预后[18]。(3)肿瘤大小和位置直接影响手术方案,肿瘤最大径越大,肝切除范围越大,切肝平面也越大,出血量也越多,增加围手术期输血率。(4)大范围肝切除意味着剩余肝体积少,术后肝衰竭、大量胸腹腔积液、感染等并发症增加,延长术后住院时间[19-20]。本研究结果显示,肝硬化不具有统计学意义(P=0.292),首先接受LH的Ⅰa期患者肝硬化多为代偿期,其次合并活动性乙肝患者术前均已通过口服抗病毒药物得到控制,再次Ia期HCC肿瘤均为单发且肿瘤最大径≤5 cm,90.3%的患者肝切除范围不超过2个肝段,术后发生肝衰竭风险小,因此肝硬化在术后短期预后中没有成为独立危险因素。
本研究也存在一些局限性:(1)只纳入了Ⅰa期HCC患者,结果能否应用于其他分期有待验证,样本量也偏少,尤其是非TO患者;(2)本研究是回顾性研究,可能存在选择偏差;(3)纳入人群仅限于国内,故以HBV感染引起的HCC为主,对于HCV相关HCC患者是否存在相同结果仍然有待研究;(4)由于LH并非同一主刀医师,可能存在外科医师经验有差异。
综上所述,超过2/3 的Ⅰa期HCC患者接受腹腔镜肝切除术后能达到TO,其5 年OS与RFS明显优于术后未能达到TO的患者,肥胖、饮酒史、肝功能Child-Pugh B级、肿瘤最大径>2 cm及大范围肝切除的患者术后获得TO的机会明显减少。通过保肝治疗改善肝功能,精准手术减少术中出血和精细管理降低术后并发症,增加肝癌术后达到TO的几率,从而获得更好的远期预后。
