灵芝三萜提取工艺优化*
2022-05-11郑苗欣张振伟王雪婷周伟坚莫转林莫美华
郑苗欣,张振伟,王雪婷,周伟坚,莫转林,莫美华**
(1.华南农业大学食品学院,广东 广州 510642;2.华南农业大学基础实验与实践训练中心,广东 广州 510642)
作为一种传统中药,灵芝(Ganoderma lucidum)在我国有悠久的应用历史,具有抗肿瘤、抗衰老、免疫调节等多种功效[1-5]。灵芝三萜是其最主要的功能活性成分之一,具有抗氧化、保肝护肝、增强免疫等多种药理作用[6-8]。
灵芝三萜主要是从子实体或孢子粉中获取。然而相较于菌丝体的培养,子实体及孢子粉的生产都更为费时、费力,且成本较高,难以保证质量与产量[9]。不同灵芝子实体含有的三萜种类不同[10],灵芝菌丝体提取的三萜中含有子实体和孢子粉三萜中所没有的7-O-乙基灵芝酸O[11-12]。因此,灵芝液体发酵作为高效生产灵芝三萜的方法受到了国内外学者的广泛关注[4,13-15]。
为优化灵芝三萜提取工艺,采用超声辅助提取法提取灵芝三萜,通过正交试验确定最佳工艺参数。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
灵芝菌株T0,由华南农业大学食品学院应用真菌试验室保藏。
1.1.2 培养基
PDA培养基:马铃薯 200 g·L-1、葡萄糖 20 g·L-1、琼脂 20 g·L-1,pH 自然。
液体培养基:葡萄糖 20 g·L-1、玉米粉 10 g·L-1、麦麸 10 g·L-1、蛋白胨 5 g·L-1、KH2PO42 g·L-1、MgSO4·7H2O 2 g·L-1,pH 自然。
1.2 试验仪器与试剂
1.2.1 主要仪器设备
SW-CJ-1D超净工作台,苏州净化设备有限公司;DSX-280A/LDZX-40高压灭菌锅,上海申安医疗器械厂;LRH-150生化培养箱,上海一恒科学仪器有限公司;KQ-500E超声波清洗器,昆山市超声仪器有限公司;101-3电热鼓风干燥箱,上海锦屏仪器仪表有限公司;HH-2恒温水浴锅,江苏金坛市宏华仪器厂;H2050R高速冷冻离心机,湖南湘仪试验室仪器开发有限公司;YB-500A高速多功能粉碎机,上海力箭机械有限公司;AB204-N电子天平,上海Mettler-Toledo有限公司。
1.2.2 主要试剂
葡萄糖,广州化学试剂厂;琼脂,广州环凯生物公司;磷酸二氢钾,广州化学试剂厂;硫酸镁,天津市福晨试剂厂;蛋白胨,广州展晨生物科技有限公司;齐墩果酸标准品,上海源叶生物科技有限公司;冰乙酸,天津市富宇精细化工有限公司;香草醛,福晨(天津)化学试剂有限公司。试剂均为分析纯。
1.3 灵芝菌丝体的培养
1.3.1 菌种的活化培养
取活化的斜面菌种接种到PDA平板培养基上,放入26℃恒温培养箱中培养至菌丝长满平板。
1.3.2 液体发酵培养基的制备
使用1.1.2的液体培养基配方。玉米粉和麦麸加适量蒸馏水煮沸,用4层纱布过滤,将配方中其他成分加入滤液中溶解,并用蒸馏水定容。制备好的培养基装入250 mL锥形瓶中,每瓶100 mL,加入15颗玻璃珠,121℃灭菌30 min,灭菌结束后冷却备用。
1.3.3 接种和培养
用打孔器在长满菌丝的平板培养基表面取直径9 mm的圆片状菌块,接种到液体发酵培养基中,每瓶接种2块;封口后放入26℃恒温摇床中,160 r·min-1培养 10 d。
1.4 试验方法
1.4.1 试验材料预处理
取培养10 d的液体发酵产物,用蒸馏水充分清洗菌丝体6次,抽滤,收集菌丝体;置于55℃电热鼓风干燥箱中,烘干至恒重;粉碎机粉碎,过80目筛。
1.4.2 灵芝菌丝体三萜的提取工艺
灵芝三萜的提取采用超声辅助醇提法。精确称取1 g灵芝菌丝体干粉,加入95%乙醇溶液30 mL,50℃超声浸提30 min,冷却至室温;将提取液真空抽滤,滤渣用适量95%乙醇充分洗涤,合并滤液;转移至100 mL容量瓶中,用95%乙醇定容至刻度,即为样品总三萜提取液。
1.5 单因素试验
1.5.1 乙醇浓度
精确称取1 g灵芝菌丝体干粉,分别加入30 mL浓度为80%、85%、90%、95%、100%的乙醇溶液;50℃、500 W超声浸提30 min,冷却至室温;提取液真空抽滤,滤渣用适量相同浓度的乙醇充分洗涤,合并滤液;转移至100 mL容量瓶中,用相同浓度的乙醇定容至刻度。
1.5.2 提取时间
精确称取1 g灵芝菌丝体干粉,加入30 mL95%的乙醇;50℃、500 W超声浸提10 min、20 min、30 min、40 min、50 min,冷却至室温;提取液真空抽滤,滤渣用适量95%乙醇充分洗涤,合并滤液;转移至100 mL容量瓶中,用95%乙醇定容至刻度。
1.5.3 料液比
精确称取1 g灵芝菌丝体干粉,分别以料液比1∶10、1∶20、1∶30、1∶40、1∶50 加入 95%的乙醇溶液;50℃、500 W超声浸提30 min,冷却至室温;提取液真空抽滤,滤渣用适量95%乙醇充分洗涤,合并滤液;转移至100 mL容量瓶中,用95%乙醇定容至刻度。
1.6 正交优化试验
1.6.1 正交试验设计
在单因素试验的基础上,确定乙醇浓度(A)、提取时间(B)、料液比(C) 3个因素作为影响灵芝菌丝体三萜得率的工艺条件,设定3因素3水平正交试验,试验设计见表1。
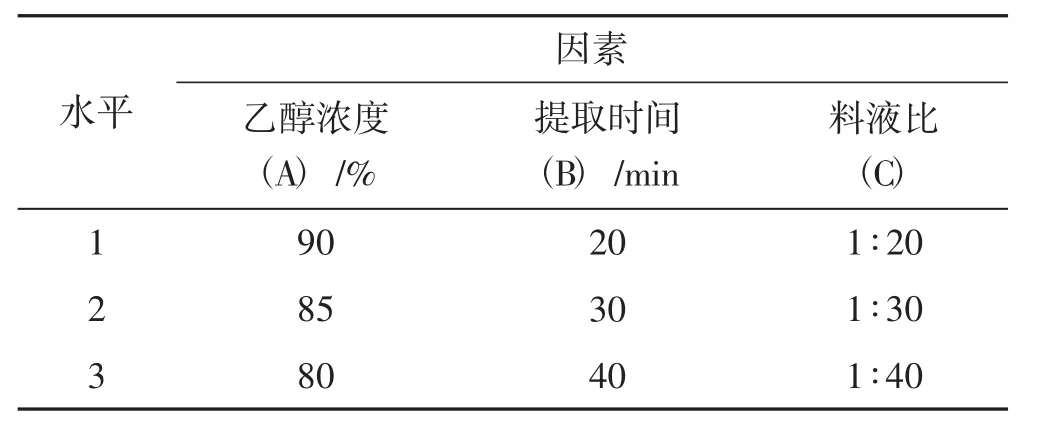
表1 正交试验因素水平Tab.1 Factor and level of orthogonal test
1.6.2 标准曲线的制作
以齐墩果酸标准品为对照品,采用香草醛-冰乙酸-高氯酸法绘制齐墩果酸标准曲线[16]。
1.6.3 灵芝菌丝体三萜的测定及得率的计算
精确量取1 mL样品总三萜提取液,挥干乙醇后,采用和测定标准曲线相同的操作方法,在560 nm波长下测定吸光度值,按每100克菌丝体干粉中提取到的总三萜克数计算。样品三萜得率(w,%)的计算公式为:
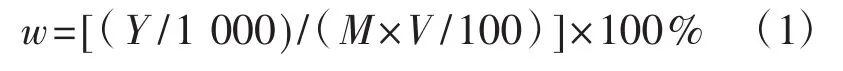
式中:Y为提取液中总三萜的质量(μg);M为样品的质量(mg);V为样品总三萜提取液的体积(mL)。
1.7 数据处理
数据计算与处理使用SPSS 26和DPS 7.05软件,图片的绘制使用Origin 2018。所有试验均设3个重复。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度对灵芝三萜得率的影响
不同乙醇浓度对灵芝三萜得率的影响见图1。
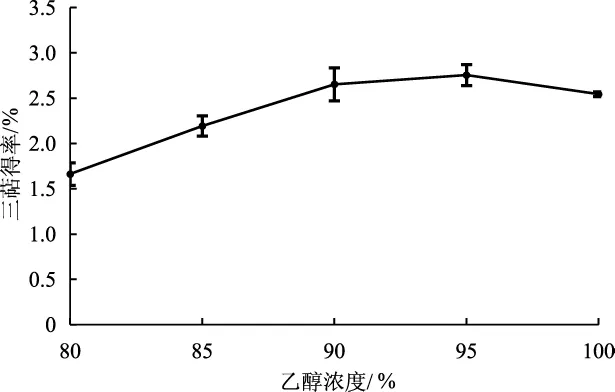
图1 乙醇浓度对灵芝菌丝体三萜得率的影响Fig.1 Effect of ethanol concentration on the yield of triterpenoid from Ganoderma lucidum mycelium
如图1所示,当其他条件相同时,在80%~95%范围内灵芝菌丝体三萜得率随乙醇浓度的升高而显著升高。三萜得率在乙醇浓度为95%时最高,为2.75%。灵芝中的三萜大都为醇溶性成分[17],因而在相同体积下,乙醇浓度越高,三萜的得率越高。而当乙醇浓度为100%时,三萜得率低于95%乙醇浓度,推测原因可能为100%乙醇浓度未能将极性较高的水溶性三萜提取出来[18]。
2.1.2 提取时间对灵芝三萜得率的影响
不同提取时间对灵芝三萜得率的影响见图2。
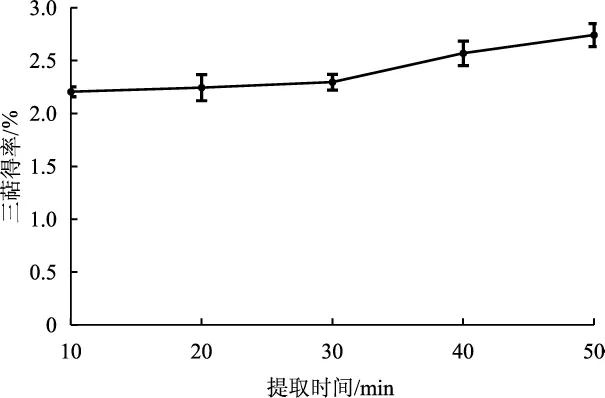
图2 提取时间对灵芝菌丝体三萜得率的影响Fig.2 Effect of extraction time on the yield of triterpenoid from Ganoderma lucidum mycelium
如图2所示,当其他条件相同时,灵芝菌丝体三萜得率在50 min内随提取时间延长而升高。提取前30 min三萜得率增长率较低;随着物料与溶剂的充分接触,三萜得率从30 min开始明显提高;提取50 min时三萜得率最高,达到2.74%,但得率增长率有所下降。这可能是因为随着时间的延长,除了三萜以外还有许多其他的物质被提取出来,给三萜的浸提增加了阻碍[19]。此外,也可能是因为随着提取时间的延长,三萜的生物活性也在逐步丧失[20]。综合考虑成本,灵芝菌丝体三萜的最优提取时间为40 min。
2.1.3 料液比对灵芝三萜得率的影响
不同料液比对灵芝三萜得率的影响见图3。
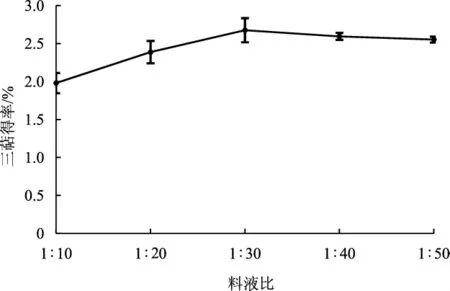
图3 料液比对灵芝菌丝体三萜得率的影响Fig.3 Effect of solid-liquid ratio on the yield of triterpenoid from Ganoderma lucidum mycelium
如图3所示,当其他条件相同时,三萜得率在料液比为1∶30时最大,达到2.68%;之后随着提取溶剂的增加,三萜得率呈现下降的趋势;因此,提取灵芝菌丝体三萜的最优料液比为1∶30。由结果推测,当提取溶剂较少时不利于超声的空化作用及其在溶剂中的传播速度,灵芝菌丝体细胞壁未被完全破坏,故而三萜得率较低[21]。料液比为1∶40、1∶50时得率降低,可能是因为在相同功率下,提取溶剂的增加导致超声无法完全破坏细胞壁,三萜无法完全溶出[22];或是因为三萜已基本溶出细胞,胞外、胞内的三萜浓度相等[23]。
2.1.4 正交试验结果
根据单因素试验结果,以乙醇浓度(A)、提取时间(B)、料液比(C)为变量,以灵芝菌丝体三萜得率为指标,进行正交试验,具体试验方案及结果见表2。
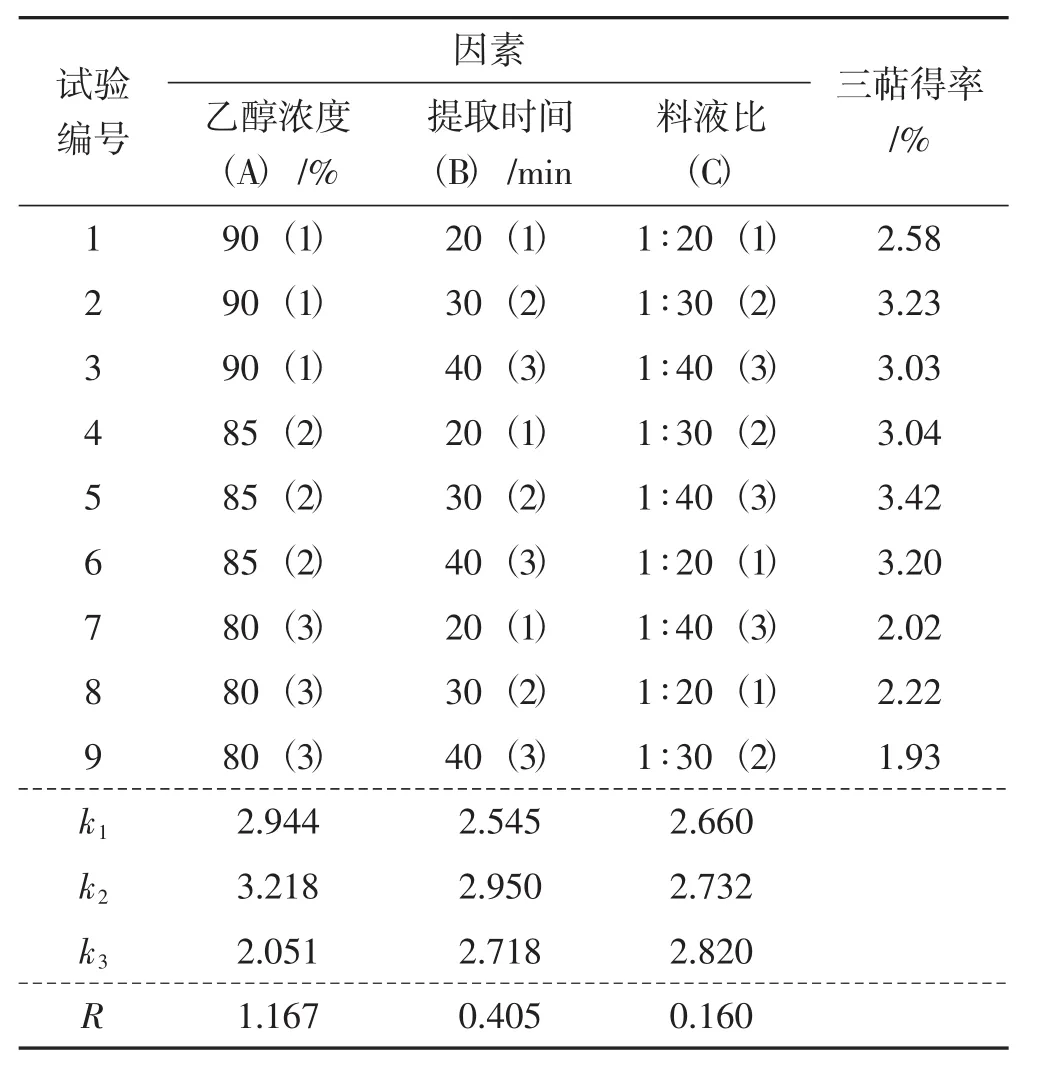
表2 正交试验结果Tab.2 Results of orthogonal test
由表2可知,通过对极差R进行比较,判断各因素对灵芝菌丝体三萜得率的影响顺序是:A>B>C,即乙醇浓度>提取时间>料液比。在对k值进行对比后判断3个因素的最佳组合是A2B2C3,即乙醇浓度85%、提取时间30 min、料液比1∶30。在此条件下进行验证试验,得到灵芝菌丝体三萜的平均得率为3.50%。
对正交试验结果进行方差分析,见表3。
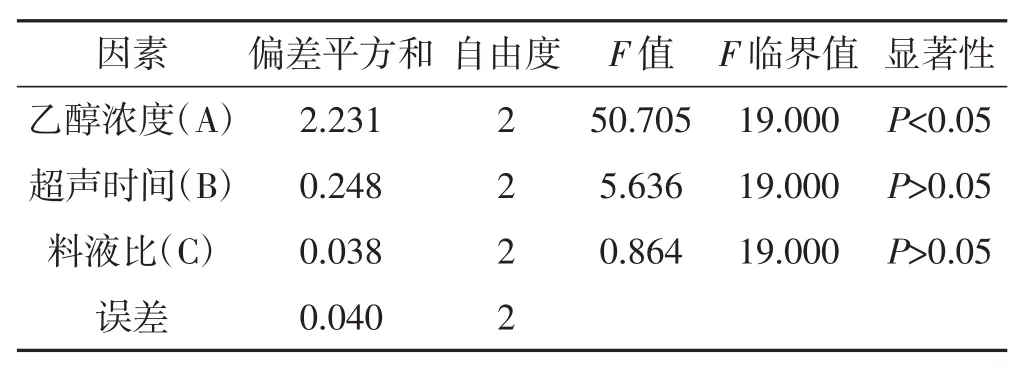
表3 方差分析Tab.3 Analysis of variance
由表3方差分析结果可知,乙醇浓度对三萜得率的影响显著,提取时间、料液比的影响不显著。
2.2 齐墩果酸标准曲线
根据1.6.2标准曲线的测定方法,以560 nm测得的吸光度值为横坐标,齐墩果酸的质量为纵坐标绘制标准曲线,见图4。
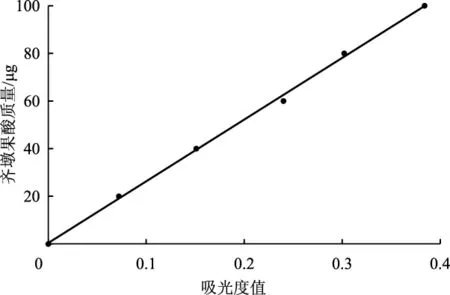
图4 齐墩果酸标准曲线结果Fig.4 Standard curve of oleanolic acid
如图4所示,三萜含量在0~100 μg范围内有良好的线性关系。得到的齐墩果酸线性回归方程为:
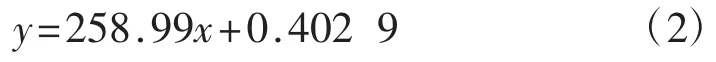
该回归方程的相关系数R2为0.998 6。
3 讨论与结论
刘奇等[23]研究发现,在单因素试验中,当料液比为1∶30时,三萜得率达到最高,这与此次试验得到的结果一致。推测当其他条件相同,而料液比为1∶30时,超声所产生的强烈振动可使细胞壁完全破裂,三萜溶出量最大[21]。但乙醇浓度和提取时间的单因素试验结果却和其他报道有较大差异,比如郑士彬[24]试验得到的最佳乙醇浓度为75%,最佳提取时间为120 min;这可能与超声功率和其他报道的试验条件不同有关。另外,试验使用的灵芝品种也不相同,不同品种的灵芝含有的三萜类型、含量具有很大差异[25-28];而不同的提取条件会影响三萜的活性,且甾醇、皂苷、油酸等杂质的溶出也会影响结果[29-31]。
在此优化条件下灵芝菌丝体三萜平均得率为3.50%,高于正交试验中其他提取条件下的结果,验证条件可行。江和栋等[32]利用多种方法对灵芝孢子粉三萜进行提取,超声提取工艺下三萜得率为3.51%,与本试验中的三萜提取工艺相近,且三萜得率近乎相等。但刘奇等[23]通过正交试验得到最优提取方案的三萜得率仅为0.71%;而刘世柱等[33]通过正交试验得到最优提取方法的三萜得率达7.76%;可见三萜得率不仅与提取工艺有关,而且与选用的菌种有很大关系。不同的提取工艺对三萜得率有较大影响,但提取工艺对三萜结构是否会产生影响进而改变其功能活性的研究还尚未见相关报道,有待进一步探讨。
灵芝三萜不仅具有广泛的生理活性和良好的应用前景,且随着人们对健康越来越重视,市场对灵芝三萜的需求量也在持续上升。虽然灵芝菌丝体液体发酵已大大减少了生产过程中所耗费的人力物力,但仍不足以满足实际生产的需要。因此,试验结果为进一步研究灵芝菌丝体三萜的提取工艺具有重要意义,也为灵芝三萜的开发奠定了良好的技术基础。
