miR-21-5p调控FGF18表达对结肠癌肿瘤干细胞生物学行为影响
2022-01-13席孝忠李国强肖雷姚坤厚
席孝忠,李国强,肖雷,姚坤厚
(1 信阳市中心医院肿瘤外科,河南 信阳 464000;2 河南大学淮河医院普通外科)
结肠癌是消化道癌症主要表型,其恶性程度较高[1],病死率位居恶性肿瘤前列,且呈逐年上升趋势,地域和人群差异显著[2]。研究表明,肿瘤干细胞分离和鉴定极大地推动了实体肿瘤如肺癌、消化道癌、生殖系统癌症等的深入研究[3-5]。细胞表面标志物,如CD133、CD44等,已被广泛用于各类恶性肿瘤干细胞的鉴定,如消化道癌等[6]。此外,miRNA是一类可以通过阻断mRNA翻译或者降解目标mRNA,从而发挥基因抑制的内源性非编码的小RNA。miRNA异常表达已被证实与癌细胞增殖、凋亡及转移等关联密切,并参与恶性肿瘤进程,其中miR-21在结肠癌中高表达[7]。本研究基于生物学预测网站发现成纤维细胞生长因子18(FGF18)为促癌基因[8],是miR-21-5p靶基因之一,然而有关其在结肠癌中的研究尚未见报道。基于此,本研究主要探究了miR-21-5p调控FGF18表达对结肠癌肿瘤干细胞增殖、迁移和侵袭的作用及其机制。
1 材料和方法
1.1 实验材料
结肠癌HT29细胞(中国科学院上海细胞生物学研究所提供);胰蛋白酶(Hyclone公司,USA);DMEM/F12培养基(Gibco公司,USA);细胞转染序列(上海奇骏牛物科技有限公司);分光光度计(上海美谱达仪器有限公司);倒置光学显微镜(宁波舜宇光学科技(集团)有限公司);细胞凋亡检测试剂盒(Sigma公司,USA);miR-21-5p、FGF18引物合成(Takara,大连宝生物工程有限公司);荧光定量PCR仪(ABI,USA);BCA试剂盒(广州威佳生物科技有限公司);Western blotting试剂盒(北京普利莱基因技术有限公司)。
1.2 实验方法
1.2.1CD133+/CD44+结肠癌干细胞分选 将结肠癌HT29细胞进行常规消化,参照既往文献的方法[9],采用流式细胞分选技术分离筛选CD133+/CD44+结肠癌干细胞。将分选后细胞重悬,在37 ℃、含体积分数0.05 CO2条件下于6孔板中培养。以供后续细胞增殖、迁移和侵袭及凋亡等实验应用。
1.2.2CD133+/CD44+细胞培养、分组及质粒转染观察CD133+/CD44+细胞的生长状况,置于37 ℃、含体积分数0.05 CO2条件下继续培养。细胞传代培养过程中,对细胞进行离心和消化处理,吹打成单个细胞。重复上述操作,离心、弃细胞沉淀,吹打混匀成单细胞悬液后,转至6孔板相同条件继续培养备用。选取传代后3~5 d处于对数生长期的状态良好的细胞冻存备用。
取细胞分为如下6组:空白对照组(A组,Blank组)、阴性对照组(B组,NC组)、miR-21-5p模拟物组(C组,miR-21-5p mimic组)、miR-21-5p抑制剂组(D组,miR-21-5p inhibitor组)、FGF18沉默表达组(E组,si-FGF18组)、FGF18沉默表达+ miR-21-5p模拟物组(F组,si-FGF18+miR-21-5p mimic组)。按照不同分组转染质粒,具体转染操作如下。①Blank组:不转染任何序列。②NC组:转染空白质粒。③miR-21-5p mimic组:转染miR-21-5p mimic质粒。④miR-21-5p inhibitor组:转染miR-21-5p inhibitor质粒。⑤si-FGF18组:转染si-FGF18质粒。⑥si-FGF18+miR-21-5p mimic组:转染si-FGF18和 miR-21-5p mimic质粒。
1.2.3CCK-8法检测细胞增殖抑制率 细胞增殖测定根据细胞计数试剂盒说明书进行操作。取各组转染细胞混悬液加入96孔板中,每组设6个复孔,置于常规细胞培养箱培养。每孔加入CCK8溶液10 μL,继续培养。采用分光光度计测量450 nm波长处吸光度值,计算细胞增殖抑制率。
1.2.4Transwell小室法检测细胞的迁移和侵袭能力 取各组转染细胞,消化离心后重悬计数。按常规操作程序分别进行细胞迁移和侵袭实验。细胞迁移实验步骤如下:细胞培养后取Transwell小室,使用40 g/L多聚甲醛固定,5 g/L结晶紫溶液染色并拭去未迁移细胞,光学显微镜下观察并求取平均值。细胞侵袭实验过程中,应用Matrigel稀释液包被Transwell小室底部膜的上室,并在37 ℃条件下将实验样品自然风干,其余操作同细胞迁移实验。比较各组细胞迁移和侵袭能力。
1.2.5流式细胞术检测细胞凋亡率 各组细胞转染48 h后收集细胞于流式管,胰蛋白酶消化液处理细胞,低温离心处理后调节细胞密度。采集细胞悬液,按照Annexin-V-FITC细胞凋亡检测试剂盒说明进行操作,检测细胞凋亡率。
1.2.6实时荧光定量PCR(qRT-PCR)检测miR-21-5p表达及FGF18mRNA表达 经细胞RNA沉淀、洗涤、溶解和浓度测定后,分别提取各组转染后CD133+/CD44+细胞总RNA。将RNA逆转录成cDNA,参照说明书进行。取反应液进行荧光定量PCR,参照说明书进行操作。采用相对定量法分别计算目的基因miR-21-5p和FGF18相对于内参照(U6)的相对表达量。
1.2.7Western blotting检测CD133、CD44以及FGF18蛋白表达 待细胞生长至汇合状态(80%),收集细胞加入裂解缓冲液,离心处理后提取各组CD133+/CD44+细胞总蛋白,用BCA试剂盒测定蛋白浓度。根据不同浓度进行定量,待样本处理完毕后进行聚丙烯酰胺凝胶电泳分离蛋白,转膜、室温下脱脂奶粉中置于摇床中封闭。滴加一抗兔抗人CD133、CD44和鼠抗人FGF18,4 ℃过夜,PBS洗涤,然后应用HRP标记的羊抗兔IgG抗体孵育(全程避光)。内参照为GAPDH。显影和定影后,采用Image J系统分析计算蛋白相对含量。
1.3 统计学分析
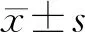
2 结 果
2.1 miR-21-5p与FGF18靶向关系
通过在线分析软件分析显示,FGF18基因与miR-21-5p序列间存在特异结合区域(图1),确定FGF18是miR-21-5p的靶基因。这一靶向关联为本文细胞实验奠定理论基础。

图1 FGF18基因与miR-21-5p序列间的特异结合区域
2.2 miR-21-5p调控FGF18表达对结肠癌干细胞增殖的影响
CCK-8检测结果显示,与Blank组和NC组相比,miR-21-5p mimic组CD133+/CD44+细胞增殖抑制率明显降低(F=16.28,P<0.05),miR-21-5p inhibitor组和si-FGF18组明显升高(F=26.53、23.96,P均<0.05),si-FGF18+miR-21-5p mimic组无明显差异(P>0.05)。而与si-FGF18组相比,si-FGF18+miR-21-5p mimic组CD133+/CD44+细胞增殖抑制率下降,差异有显著性(t=6.181,P<0.05)。见表1。
2.3 miR-21-5p调控FGF18表达对结肠癌干细胞迁移和侵袭影响
Transwell实验结果显示,与Blank组和NC组相比,miR-21-5p mimic组CD133+/CD44+细胞迁移和侵袭能力显著升高;miR-21-5p inhibitor组和si-FGF18组细胞迁移和侵袭能力显著降低,差异具有统计学意义(F迁移=11.23~19.55,F侵袭=21.68~52.85,P均<0.05);si-FGF18+miR-21-5p mimic组细胞迁移和侵袭能力无明显差异(P均>0.05)。而与si-FGF18组细胞相比,si-FGF18+miR-21-5p mimic组细胞迁移和侵袭能力明显上升(t=4.927、8.073,P均<0.05)。见图2。

a:细胞迁移率柱状图;b:细胞侵袭率柱状图;c:细胞侵袭能力实验检测。A:Blank组,B:NC组,C:miR-21-5p mimic组,D:miR-21-5p inhibitor组,E:si-FGF18组,F:si-FGF18+miR-21-5p mimic组。与Blank组和NC组相比,*P <0.05;与si-FGF18组相比,#P <0.05。
2.4 miR-21-5p调控FGF18表达对结肠癌干细胞凋亡的影响
流式细胞术检测结果显示,与Blank组和NC组相比,miR-21-5p mimic组CD133+/CD44+细胞早、晚期凋亡率呈下降趋势;而miR-21-5p inhibitor组和si-FGF18组凋亡率则上升(F早期=17.22~35.88,F晚期=24.12~109.80,P均<0.05);si-FGF18+miR-21-5p mimic组凋亡率差异无显著性(P均>0.05)。而与si-FGF18组相比,si-FGF18+miR-21-5p mimic组CD133+/CD44+细胞早、晚期凋亡下降(t=10.73、13.47,P均<0.05)。见表1。
2.5 miR-21-5p调控FGF18表达对miR-21-5p和FGF18相对表达影响
qRT-PCR检测结果显示,与Blank组和NC组相比,miR-21-5p mimic组FGF18mRNA和miR-21-5p的表达水平均显著上升,miR-21-5p inhibitor组FGF18mRNA和miR-21-5p表达水平均显著下调(FFGF18=29.44、886.10,FmiR-21-5p=12.18、764.70,P均<0.05);si-FGF18组miR-21-5p表达差异无显著性(P>0.05),而FGF18mRNA表达水平显著下降(F=32.90,P<0.05);且si-FGF18+miR-21-5p mimic组miR-21-5p表达水平显著上升(F=509.10,P<0.05),而FGF18表达无显著差异(P>0.05)。见表1。
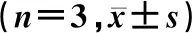
表1 miR-21-5p调控FGF18表达对结肠癌干细胞生物学行为及两者mRNA表达影响
2.6 miR-21-5p调控FGF18表达对CD44、CD133和FGF18蛋白表达影响
Western blotting结果显示,与Blank组和NC组细胞相比较,miR-21-5p mimic组CD44、CD133和FGF18蛋白表达水平均显著上升(F=109.00~551.90,P均<0.05);miR-21-5p inhibitor组和si-FGF18组的蛋白表达水平则显著下降(F=9.31~36.45,P均<0.05),si-FGF18+miR-21-5p mimic组的蛋白表达水平无明显变化(P均>0.05)。与si-FGF18组相比,si-FGF18+miR-21-5p mimic组CD44、CD133和FGF18表达均呈上升趋势(t=3.253~10.18,P均<0.05)。见图3。

a:CD44、CD133和FGF18蛋白表达电泳图;b:CD44、CD133和FGF18蛋白表达水平柱状图。A:Blank组,B:NC组,C:miR-21-5p mimic组,D:miR-21-5p inhibitor组,E:si-FGF18组,F:si-FGF18+miR-21-5p mimic组。与Blank组和NC组相比(n=3),*P<0.05;与si-FGF18组相比,#P<0.05。
3 讨 论
本研究首先通过生物学预测软件确定FGF18是miR-21-5p的靶基因。进而采用细胞培养并构建质粒转染方法,探究miR-21-5p调控FGF18表达对结肠癌肿瘤干细胞生物学行为的影响。本研究选用流式细胞分选技术筛选CD133+/CD44+结肠癌干细胞的临床意义在于,上皮来源的恶性肿瘤的发生可能与肿瘤干细胞的增殖、分化等潜能存在关联性[10]。针对肿瘤细胞的恶性特征,既往众多研究已发现肿瘤的进程可归因于肿瘤干细胞的特征,如其可自我更新、增殖分裂等,从而导致肿瘤细胞的耐药性、治疗失败、癌症复发等不良后果。肿瘤治疗多采用外源性干预手段抑制此类干细胞的自我更新,从而阻断细胞增殖、诱导细胞凋亡,最终实现逆转肿瘤细胞增殖分化、转移等[11]。作为肿瘤细胞的标志物,CD133、CD44已被证实在肝癌、骨肉瘤等中呈显著高表达,其表达上调可能与激活下游信号通路、抑制肿瘤细胞凋亡等相关联[12-13]。另外,miR-21-5p已被报道与人类消化道癌症等密切相关[14-15],并通过作用众多的基因靶点参与肿瘤进展,为肿瘤靶向治疗提供新途径。WU等[16]研究显示,miR-21-5p高表达可通过抑制PTEN、激活P13K/Akt信号通路、诱导上皮间质转化等机制促进食管癌发生进程。因此,作者推测miR-21-5p有可能通过特定靶基因,干预结肠癌干细胞生物学进程。FGF18作为成纤维细胞因子,属于纤维细胞因子(FGF)家族,是典型的促癌基因。FGF家族成员在血管生成、组织细胞增殖、成纤维细胞增生等方面发挥重要作用,通过翻译转录可发挥多种潜在功能[17]。FGF18在癌症中呈高表达,如在卵巢高级浆膜癌中呈显著高表达,促进癌症进展[18]。
本研究结果表明,下调miR-21-5p表达和沉默FGF18表达后CD133+/CD44+细胞增殖抑制率和凋亡率显著提升,而迁移和侵袭能力显著降低;而上调miR-21-5p表达结果与此相反;且在上调miR-21-5p表达基础上沉默FGF18表达,逆转了沉默FGF18表达对细胞增殖、凋亡、迁移和侵袭能力的作用。本文结果提示,miR-21-5p低表达可在结肠癌干细胞增殖、迁移和转移中发挥正向作用;同时,下调miR-21-5p表达可抑制FGF18表达,进一步凸显了对结肠癌干细胞生物学行为的调控作用。此外,上调miR-21-5p表达后导致FGF18、CD133、CD44蛋白表达水平显著上升;而下调miR-21-5p表达,靶向抑制FGF18,上述因子的表达水平均显著逆转。就其机制而言,微小RNA通常通过靶基因调节转录后表达。我们推测其可能与FGF18为miR-21-5p靶基因,miR-21-5p通过与其3′端非翻译区特异性结合,抑制作为促癌基因FGF18的表达水平,从而达到抑制肿瘤细胞增殖、促进细胞凋亡的结果。LU等[19]报道,过表达miR-21-5p可靶向15-PGDH,促进胆管癌生长。YAN等[20]亦在其研究中通过基因组微阵列数据和靶向预测miR-21-5p可靶向PIK3R1,抑制肿瘤细胞迁移和侵袭,降低PI3K/AKT信号转导并逆转上皮间质转化,在乳癌中发挥重要作用。本研究亦通过类似机制性探讨,初步显示miR-21-5p与其靶基因FGF18在结肠癌肿瘤干细胞中的作用,为临床探究结肠癌治疗提供了一定的实验依据。
综上所述,本研究证实抑制miR-21-5p表达并沉默FGF18表达,可抑制结肠癌肿瘤干细胞增殖、迁移和侵袭,并促进细胞凋亡。本实验为靶向miR-21-5p和FGF18的分子治疗策略提供了实验基础。同时,本研究有待进一步的动物移植瘤实验验证,并佐以进一步的实验探究抑制miR-21-5p表达对肿瘤细胞药物敏感性以及临床病人预后方面的影响。
