低聚半乳糖对益生性植物乳杆菌YW11冰淇淋加工特性的影响
2021-12-31赖田甜郑义马依淼韩骁默向蕙冯文颖刘少莉姚梦柯张敏杨贞耐
赖田甜,郑义,马依淼,韩骁默,向蕙,冯文颖,刘少莉,姚梦柯,张敏,杨贞耐
(北京工商大学北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048)
0 引言
低聚糖作为一种功能性糖在食品、药品、保健品等领域已被广泛应用。其中低聚半乳糖(galactooligosaccharide,GOS)是一种由半乳糖或葡萄糖连接1~7个半乳糖基而成的功能性低聚糖[1]。GOS在人母乳中含量较高,具有独特的理化性质和生理功能,能够选择性地促进双歧杆菌等益生菌的增殖,同时抑制有害菌的生长,且具有改善腹泻、调节肠道菌群平衡、促进矿物质吸、提高免疫力等多种功能[2]。由于GOS水溶性好,黏度低,保湿性强,对酸和热都很稳定,因此GOS一定程度上还可以改善食品质构,并使其具有特殊的风味[3]。
益生菌(Probiotics)是一类通过改善宿主菌群组成从而发挥有益作用的活性微生物,具有增强肠道防御功能,促进有益微生物繁殖,对人体健康具有重要作用[4]。将益生菌应用于食品工业可以提高食品的营养价值和功能性。由于益生菌必须达到一定数量才能发挥作用,因此在食品加工过程中如何保持益生菌活性尤为重要。据报道,低聚糖可增强益生菌在消化道的存活能力[5];低聚糖在食品贮藏过程中对益生菌有保护作用[6-7]。但是,GOS作为一种新型功能性低聚糖,在益生菌冰淇淋中的应用及对产品微生物和理化指标的影响研究较少。将GOS与益生菌配伍使用,开发功能性健康食品,是当前国内食品工业发展的新增长点[8]。
本研究采用植物乳杆菌YW 11作为实验菌株,该菌株为本课题组从西藏灵菇中分离筛选得到,具有良好的益生特性[9];其产生的胞外多糖分子量为1.1×105u,具有良好的理化性质和生物活性[10]。本研究探讨了不同添加量的GOS对植物乳杆菌YW 11增殖和抑制病原菌能力的影响,并将该菌株与GOS配伍应用于冰淇淋加工,进一步研究不同GOS添加量对冰淇淋理化性质、贮藏过程益生菌活性及菌株的模拟胃肠道耐受性的影响,为获得高活性益生菌冰淇淋奠定技术基础。
1 材料与方法
1.1 材料与仪器
植物乳杆菌YW11(NCBI检索号:KM 265361)分离于西藏灵菇样品,本课题组实验室保藏;志贺氏菌(CICC 21534),大肠杆菌(CMCC 44825),沙门氏菌(CICC 22956)等菌株保藏于本实验室;GOS(分析纯),上海源叶生物科技有限公司。
高压蒸汽灭菌器MLS-3750,日本Sanyo公司;S20型数显p H计,上海Mettler公司;Elx800型酶标仪,美国博腾仪器有限公司;恒温培养箱DHP-9032,上海一恒仪器科技有限公司;乳品发酵监控仪iCinac,法国AMSAlliance公司。
1.2 实验方法
1.2.1 菌株活化
植物乳杆菌YW 11保存在含50%甘油的MRS培养基中,-80℃冻存。将冻存菌株接种于MRS液体培养基,37℃连续活化2代后用于进一步实验。志贺氏菌(CICC 21534)、大肠杆菌(CMCC 44825)、沙门氏菌(CICC 22956)均保存在含50%甘油的LB培养基中,-80℃冻存。将冻存菌株接种于LB液体培养基,37℃连续活化2代后用于进一步实验。
1.2.2 GOS对植物乳杆菌YW11产酸(p H)的影响
以添加1%、2%、4%、6%GOS的MRS液体培养基为实验组,MRS液体培养基为对照组。活化两代之后的植物乳杆菌YW 11按3%[11]的接种量分别接种到上述液体培养基中,置于37℃恒温水浴锅中,使用iCinac(12 VDC,96 W)乳品发酵监控仪对植物乳杆菌YW11生长过程中的p H进行连续数据采集。测量数据每3 min记录一次,持续36 h。
1.2.3 GOS对植物乳杆菌YW11增殖的影响
以添加1%、2%、4%、6%GOS的MRS液体培养基为实验组,MRS液体培养基为对照组。活化两代之后的植物乳杆菌YW 11按3%的接种量分别接种到上述液体培养基中,37℃、200 r/min条件下震荡培养。在培养0,4,8,12,16,20,24,28,32,36 h时取样,使用酶标仪测定OD600 nm值。每个处理设3次重复,取平均值绘制生长曲线。
1.2.4 GOS对植物乳杆菌YW 11菌体蛋白含量的影响
以添加1%、2%、4%、6%GOS的MRS液体培养基为实验组,MRS液体培养基为对照组。取进入平稳期的植物乳杆菌YW 11发酵液,使用低温冷冻离心机(4℃)10 000 r/min离心5 min,用PBS缓冲液清洗沉淀物,重复3次,记录终沉淀菌体的质量。同时使用BCA蛋白浓度测定试剂盒对上清液中蛋白的含量进行测定。计算植物乳杆菌YW 11菌体总蛋白含量,探究不同GOS添加量对益生菌蛋白含量的影响。

1.2.5 GOS对植物乳杆菌YW 11抑菌作用的影响
参照马依淼等[12]方法,略作改动。以添加1%、2%、4%、6%GOS的MRS液体培养基为实验组,MRS液体培养基为对照组。采用牛津杯法测定GOS对植物乳杆菌YW 11发酵液对3种致病菌(沙门氏菌、志贺氏菌及大肠杆菌)的抑制效果。活化2代之后的3种致病菌按3%的量分别接种到LB固体培养基中,混匀后倒入培养皿,待其冷却凝固后,将灭过菌的牛津杯平稳地放在培养皿上,保证各牛津杯之间距离适当。在牛津杯中分别加100μL植物乳杆菌YW 11的发酵液即离心后的上清液,培养皿平放于37℃恒温培养箱中培养8 h后观察抑菌效果,并测量抑菌圈直径大小。每个处理设3次重复。
1.2.6 益生菌冰淇淋的工艺流程
配料(鲜牛乳、脱脂乳粉、麦芽糖浆、双乙酰酒石酸脂肪酸酯、海藻酸丙二醇脂肪酸酯)→分散均质(15 MPa,2 min)→巴氏杀菌→温度降至37℃→接种发酵(添加植物乳杆菌YW11)→添加砂糖、羧甲基纤维素钠、果胶、瓜尔豆胶→均质(20 MPa,2 min)→4℃老化→硬化→冷藏(-20℃)。
在冰淇淋制作中,以添加1%、2%、4%、6%GOS的植物乳杆菌YW 11冰淇淋为实验组,以未添加GOS的植物乳杆菌YW 11冰淇淋为对照组。
1.2.7 冰淇淋理化指标的测定
p H和可滴定酸度:p H值采用pH计测定。滴定酸度测定参照于志会等[13]方法。
黏度:冰淇淋浆料老化后,采用Texture Analyzer质构仪进行黏度的测定。
硬度:冰淇淋样品在-20℃冰箱贮存48 h后,采用Texture Analyzer XT2质构仪进行硬度的测定,P/5 Cylinder stainless探头,直径0.5 cm,测定速率1 mm/s,刺入深度0.5 cm。
膨胀率:根据称量的同重量混合原料的体积V1与同重量冰淇淋的体积V2,按照下式计算冰淇淋的膨胀率:

式中V2为同重量下冰淇淋的容积,L;V1为同重量下混合原料的容积,L;
融化速率:称取一定量-20℃贮存30 d冰淇淋成品,在25℃、相对湿度75%的环境下静置,每隔一定时间称其融化质量,抗融化性以融化率表示,融化率越低,说明抗融化性越好。按照下式计算融化率:

1.2.8 冰淇淋中植物乳杆菌YW 11模拟胃肠道耐受性实验
取50 g储存30 d的冰淇淋,与44 mL 0.05 g/L氯化钠溶液混合制成待测试液。
模拟胃液实验:参照卢旭[14]的方法,略作改动。用盐酸调节磷酸盐缓冲液(PBS,0.1 mol/L,p H 7.4)p H至3.0,配制质量分数为0.5%的胃蛋白酶溶液,用0.22μm微孔滤膜过滤除菌后待用。以2%(v/v)的接种量将样品溶液接种到体外模拟胃液中,混匀后置于37℃环境下培养2 h。之后进行活菌数的检测。平板计数法测定活菌数并计算存活率。
模拟肠液实验:参照邹婷婷[15]的方法,略作改动。用盐酸调节磷酸盐缓冲液(PBS,0.1 mol/L,p H 7.4)p H至6.8,添加牛胆盐与胰蛋白酶,使终浓度分别为6.0 mg/mL、1.0 mg/mL,充分溶解后,用0.22μm微孔滤膜过滤除菌后待用。以2%(v/v)的接种量将样品溶液接种到体外模拟肠液中,混匀后置于37℃下培养2 h。平板计数法测定活菌数并计算存活率。
1.2.9 冰淇淋中益生菌活菌数的测定
采用稀释涂布平板计数法测定储存期间冰淇淋的活菌数。取不同储存时间的冰淇淋样品用无菌生理盐水稀释,将稀释后的样品涂布于MRS固体培养基中,37℃倒置培养,记录各组冰淇淋样品-20℃储存1~60 d后各组冰淇淋的活菌数。
1.2.10 数据分析
每个样品至少测定3次,实验数据采用SPSS 22.0软件进行分析,P<0.05表示差异显著,使用origin8.5软件作图。
2 结果与分析
2.1 GOS对植物乳杆菌YW 11产酸的影响
图1反映了添加不同量GOS的培养基随植物乳杆菌YW 11发酵过程的p H值变化情况。由图1可知,各组发酵培养基由最初的p H 6.20左右逐渐降低,各组均呈现先下降后趋于平稳的趋势,但终止p H值不同。发酵培养前期,与对照组相比,GOS组培养基的p H下降更明显(P<0.05),这说明GOS组能促进前期植物乳杆菌YW 11的生长,代谢越快,酸度积累越高。GOS组组间p H变化无显著性差异(P>0.05)。发酵培养后期,对照组p H最先趋于稳定,稳定值为4.0左右;而GOS组培养基发酵终点为pH 3.90。这说明GOS的加入,使菌株对培养基利用效率更高,对植物乳杆菌YW11生长速率有一定促进作用。

图1 GOS对植物乳杆菌YW11在37℃生长过程中pH变化的影响
2.2 GOS对植物乳杆菌YW 11增殖的影响
图2反映了植物乳杆菌YW 11在添加不同量GOS的培养基中活菌数随发酵时间变化的情况。由图2可知,与对照组相比,GOS组植物乳杆菌YW 11在对数生长前期生长速率明显加快,表明GOS可通过提高益生菌的生长速率促进益生菌的生长。由于培养基营养成分消耗,在发酵24 h左右进入平台期[16]。此外,与对照组相比,GOS对植物乳杆菌YW 11的增殖具有显著的促进作用(P<0.5),随着GOS浓度的增加,活菌数总体呈先增长后降低的趋势,在GOS添加量为4%时活菌数达到峰值,这可能是因为高浓度的GOS在培养基中形成了较高的渗透压,使益生菌菌体脱水,一定程度上抑制了其生长[17]。辛跃强等[18]研究表明GOS作为益生元能较好地促进植物乳杆菌的生长,且促进效果强于以葡萄糖为碳源的对照组。

图2 GOS对植物乳杆菌YW11在37℃生长过程中活菌数变化的影响
2.3 GOS对植物乳杆菌YW 11菌体蛋白含量的影响
图3反映了GOS对植物乳杆菌YW11菌体蛋白含量的影响。由图3可知,较低浓度的GOS可显著地提高植物乳杆菌YW 11的菌体蛋白含量,较高浓度的GOS对植物乳杆菌YW 11菌体蛋白含量增加效果不显著。当GOS添加量为4%时,植物乳杆菌YW 11的菌体蛋白含量增加了近40%。菌体蛋白浓度高,意味着相同的菌体质量包含的功能性蛋白质的含量越多,益生菌的生命活动更旺盛,从而增强益生菌的功能特性。丁诗瑶等[19]研究了7株植物乳杆菌均具有一定的胆盐水解酶活性及蛋白水解酶活性。益生菌相关酶活性的提高,有助于增强菌株的胆盐耐受性,延长其在肠胃道的滞留时间,改变宿主的消化功能[20]。

图3 GOS对植物乳杆菌YW11菌体蛋白含量的影响
2.4 GOS对植物乳杆菌YW 11抑菌作用的影响
植物乳杆菌可以分泌抗菌类物质,一定程度上帮助宿主在其肠胃道中抵御有害致病菌的侵袭[21-22]。本实验研究了添加GOS后植物乳杆菌YW 11代谢产物对志贺氏菌(CICC 21534),大肠杆菌(CMCC 44825),沙门氏菌(CICC 22956)3种致病菌的抑菌效果,GOS对受试菌株的抑菌能力由抑菌圈直径的大小反映。抑菌圈直径越大,抑菌能力越强。如图4所示,与对照组相比,GOS的添加能够明显(P<0.05)提高植物乳杆菌YW 11的抑菌能力,但不同致病菌达到最佳抑菌效果时所需的GOS添加量有所差别。对于志贺氏菌与沙门氏菌抑菌效果最佳的GOS添加量为2%,最大抑菌圈直径分别为1.43 cm和1.55 cm,对于大肠杆菌抑菌效果最佳时,GOS添加量为4%,其最大抑菌圈直径为1.52 cm。低聚糖可有效调节微生物的生长,并刺激其细菌素的产生[23]。孙思睿等[24]研究发现在含GOS培养基中,植物乳杆菌KLDS1.0391更利于合成细菌素。
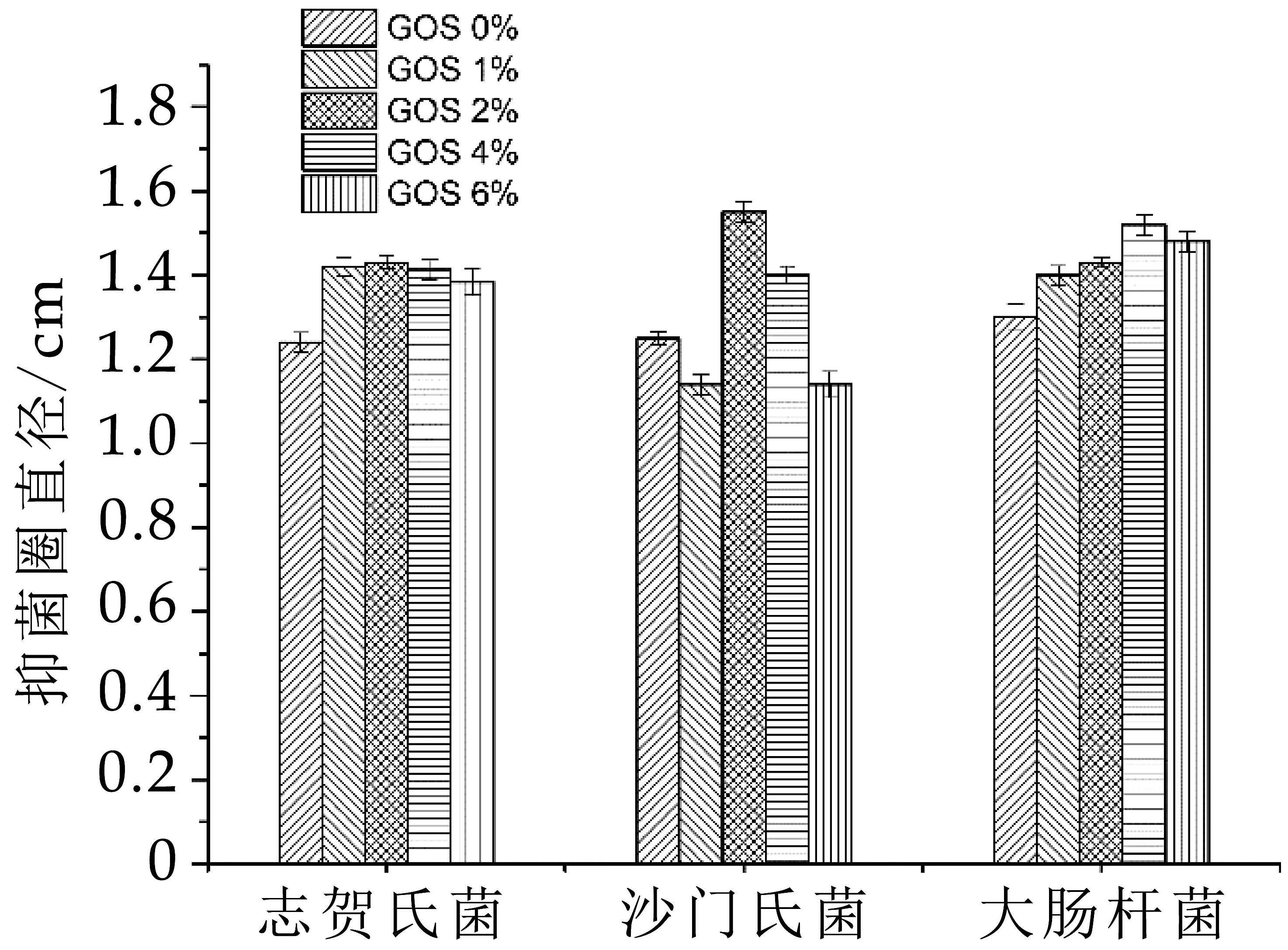
图4 GOS作用下植物乳杆菌YW11代谢产物对病原菌的抑菌效果
2.5 GOS对植物乳杆菌YW11冰淇淋理化特性的影响
冰淇淋产品的理化检测指标主要有酸度、黏度、硬度、膨胀率、融化率等,这些指标是影响冰淇淋品质和口感的主要因素。本实验对上述理化指标分别进行了检测。如表1所示,在相同的发酵时间条件下,浆料的p H和滴定酸度分别在5.69~5.89和35.34~48.76°T较小区间范围内变化,但是与对照组相比,GOS添加组的冰淇淋浆料酸度略高,主要是因为GOS的添加促进了植物乳杆菌YW11的增殖,促进了菌体产酸[25]。提高冰淇淋浆料黏度有利于减少其中的游离水成分,改善冰淇淋口感,并能有效降低冰淇淋的融化速度[26]。由表1可知,随着GOS添加量的增加,冰淇淋的黏度呈先上升后下降的趋势,这可能由于植物乳杆菌YW 11生长过程中会产生胞外多糖,使产品具有更高的黏度,但当GOS浓度过高时会影响菌体的生长,使黏度略有降低[27]。
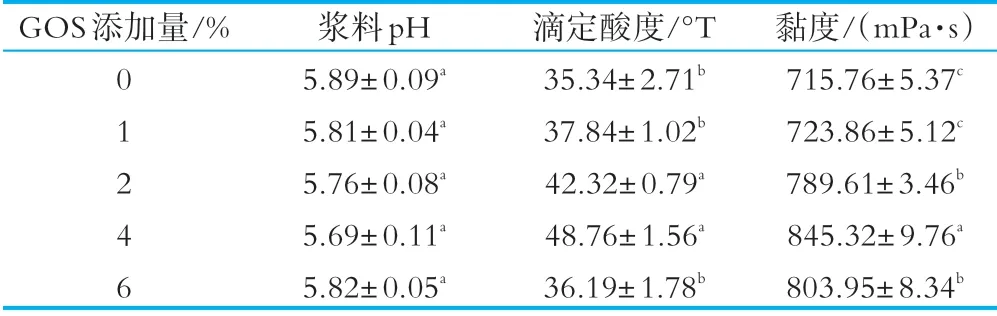
表1 不同添加量的GOS对植物乳杆菌YW11冰淇淋酸度和黏度的影响
如表2所示,随着GOS添加量的增加,冰淇淋的硬度呈上升趋势,可能是由于GOS具有良好的结合水分子的能力,可吸水溶胀形成凝胶,对维持物料结构的稳定性具有较大程度的贡献[28]。膨胀率随GOS添加量的增加呈先增加后下降的趋势,GOS添加量为4%时,膨胀率最高,这可能是由于冰淇淋浆料黏度随着GOS添加量的增加而提高,有利于其中气泡的形成及稳定性,但是当体系过于黏稠时,气泡稳定性降低,膨胀率下降[29]。此外,冰淇淋融化速率与其黏度变化趋势一致,这可能是由于冰淇淋黏度越大,其抗融性越好[26],并且GOS具有良好的持水性,对水分子具有一定的束缚作用,使其不能在体系中的其他分子之间自由移动[30]。

表2 不同添加量的GOS对植物乳杆菌YW11冰淇淋硬度、膨胀率和融化速率的影响
2.6 GOS对冰淇淋冷冻贮藏期间植物乳杆菌YW 11活性的影响
如何更好地保持益生菌产品在冷冻加工运输过程及产品货架期期间的活菌数和生物活性,提高益生菌产品的功能性是当前食品行业面临的难题。益生菌需在食品和宿主中达到一定数量(通常认为在食品中不低于6 log CFU/g),且保持其代谢稳定才能提供健康功效[31]。本研究对冰淇淋冷冻贮藏60 d期间益生菌活菌数的变化进行了检测。由图5可知,各组植物乳杆菌YW 11在冰淇淋贮藏过程中活菌数均呈下降趋势,这可能是因为冰淇淋基质的冷冻胁迫作用导致菌体出现不同程度的损伤,加速了菌体的死亡[32]。Aboulfazli等[33]研究表明凝冻过程会造成益生菌冰淇淋活菌数的显著降低。但菌体活菌数仍保持在6 log CFU/g以上。本研究GOS的添加对冰淇淋中益生菌存活具有明显的促进作用。冷冻贮藏60 d后,对照组冰淇淋的活菌数下降了2.3个对数级;GOS添加量为4%的植物乳杆菌YW 11冰淇淋活菌数最高,活菌数下降了1.93个对数级。因此,GOS的添加对益生菌冰淇淋产品活菌数的增加与保持都起到了重要的作用。耿铁柱等[34]研究表明复合低聚糖的添加可以提高益生菌饮料的活菌数量,可有效抑制贮藏期间活菌数的下降。李勇超等[35]研究发现酸奶发酵过程中添加魔芋低聚糖可促进酸奶中益生菌的增殖,并使益生菌活菌数在贮存过程中保持较高的水平。RAJAM等[6]研究也表明低聚糖在贮藏过程中能很好地改善植物乳杆菌的生存能力,对益生菌有保护作用。

图5 GOS对植物乳杆菌YW11冰淇淋贮藏期间活菌数变化的影响
2.7 冰淇淋中植物乳杆菌YW 11对模拟胃肠道的耐受性
人的肠胃道环境十分复杂,益生菌在胃肠道中存活的能力,将决定其能否在人体内正常发挥益生作用[19]。胃肠道环境对益生菌产品的功能特性具有重要影响,其主要表现在胃内过低的p H环境以及肠道内各类蛋白分解酶的作用会使益生菌产品中活菌数大大降低。对于益生菌的胃肠道耐受性,可通过体内或体外试验,二者的实验结果无显著性差异[36]。表3显示体外模拟胃肠道环境对冰淇淋中植物乳杆菌YW11活菌数及存活率的影响。
由表3可知,GOS组冰淇淋中植物乳杆菌YW 11菌株在模拟胃液环境中的存活率显著(P<0.5)高于对照组,GOS添加量为4%时菌株存活率相比对照组提高了12.66%,这表明GOS在强酸性条件下对植物乳杆菌YW 11具有较好的保护作用,可提高益生菌在人体中发挥的益生作用。同时,GOS组冰淇淋中植物乳杆菌YW 11在模拟肠液环境中的存活率均显著高于对照组,较高水平的GOS添加量具有更好的耐胆汁保护效果,GOS添加量为6%时菌株存活率相对于对照组增加了10.98%,表明GOS可以有效地增强植物乳杆菌YW 11耐受肠液腐蚀的能力。Begley等[37]研究表明,胆盐环境对菌体造成的胁迫主要是损伤益生菌细胞膜的结构和破坏细胞的稳定性。GOS的添加能很好地改善植物乳杆菌的耐酸耐胆盐的能力,在菌体表面形成保护膜,在极端酸性或胆汁环境中对益生菌起到一定的隔离保护作用[6]。
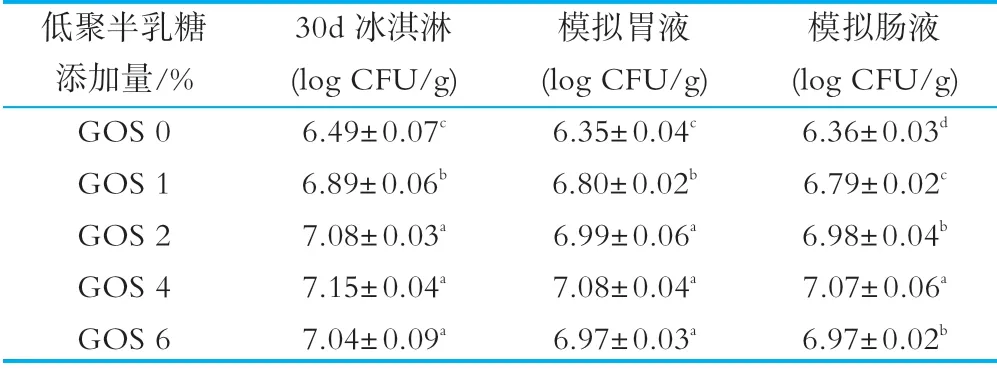
表3 体外模拟胃肠道环境对冰淇淋中植物乳杆菌YW11活菌数的影响
3 结论
通过研究GOS对益生性植物乳杆菌YW 11冰淇淋加工特性的影响,结果表明,添加4%GOS能显著促进植物乳杆菌YW 11的生长,使其菌体蛋白含量增加近40%;GOS能够显著提高植物乳杆菌YW11对志贺氏菌(CICC 21534)、大肠杆菌(CMCC 44825)、沙门氏菌(CICC 22956)的抑菌能力;将植物乳杆菌YW 11应用于冰淇淋加工,随着GOS添加量的增加,冰淇淋浆料的酸度略有提高,硬度得到改善,黏度、膨胀率及融化率均呈现先升高后降低的趋势;GOS能够有效改善益生菌在冰淇淋冻藏期间的活性及对胃肠道环境的耐受性;当GOS添加量为4%时,冰淇淋的各项理化指标及其中益生菌活性整体上达到最佳,GOS对于改善益生菌冰淇淋的理化性质和功能特性具有重要作用。本研究为将GOS与植物乳杆菌YW 11的配伍使用,为功能性益生菌冰淇淋的研究开发提供了新思路。
