乳双歧杆菌BL-99以及副干酪乳酪杆菌ET-22增强小鼠免疫功能的研究
2021-12-31赵雯刘伟贤张海斌马国文尹小静洪维鍊
赵雯,刘伟贤,张海斌,马国文,尹小静,洪维鍊
(内蒙古伊利实业集团股份有限公司,呼和浩特 010110)
0 引言
免疫系统是机体最重要的防御系统,可特异性或非特异性排除侵入机体的异物,同时也是激活免疫应答、进行免疫反应和维持对应免疫效果的重要组成部分[1],是一个需要免疫系统中各个组成紧密且有序的配合的复杂过程。这个过程主要包括了抗原的有序传递,细胞的激活,免疫分子的形成等一系列复杂的生理过程[2]。这些过程的有序发生促进了免疫反应的有效产生,从而对人体内部环境进行有序而有效的调节,并保持体内环境稳态的平衡。国内有研究表明,乳酸菌能够有效地影响并调节免疫功能的某些环节,主要体现在三个大方面体液免疫、细胞免疫和非特异性免疫。
乳酸菌是对宿主健康非常有益的微生物食品成分,研究表明乳酸菌可以通过直接与免疫细胞接触或调节肠道菌群组成来改善宿主免疫功能[3]。作为人及动物肠道中最重要的一类微生物,乳酸菌在维持肠道微生态平衡中起着至关重要的作用。在肠道菌群调节、增强机体免疫力、缓解乳糖不耐症和预防感染性腹泻等方面发挥重要作用[4-7],并且广泛应用在食品、保健品和药品等领域。近年来,越来越多的研究者倾向于关注其生理调节作用,如细菌素的分泌,肝功能恢复和氧化应激调节等,进而开发功能性发酵食品产品[8-9]。在这些研究中,细菌刺激对免疫促进特性的影响是一个有前景的部分[7,10]。许多食品微生物可诱发固有和/或适应性免疫反应,这种反应可能与不同细胞群的细胞因子产生有关[11]。
本文研究了两种双歧杆菌和两种乳酸杆菌对小鼠免疫功能的调节作用,分别从单核-巨噬细胞活性测定实验、NK细胞活性测定实验、细胞及体液免疫实验来综合判定4株乳酸菌对小鼠的免疫功能的调节作用。
1 材料与方法
1.1 材料与仪器
1.1.1 试验菌株及动物
动物杆菌(Bifidobacterium animalis,B0,商业菌)、乳双歧杆菌(Bifidobacterium lactis,BL-99)、副干酪乳杆菌(Lactobacillus paracasei,LPC0,商业菌)和副干酪乳酪杆菌(Lacticaseibacillus paracasei,ET-22)由内蒙古乳业技术研究院有限责任公司提供(副干酪乳酪杆菌为副干酪乳杆菌的新的命名,参考网址http://lactotax.embl.de/wuyts/lactotax/);健康BABL/c雄性小鼠70只,购自北京华阜康生物科技有限责任公司,饲养于中国疾病预防控制中心动物房。
1.1.2 试剂与设备
环磷酰胺、乙二胺四乙酸二钾,国药集团化学试剂有限公司;RPMI 1640细胞培养液、小牛血清、青霉素、2-巯基乙醇,上海瑞番生物科技有限公司;链霉素,北京索莱宝有限公司;ConA液,天津市广成化学试剂有限公司;无菌Hank’s液、Brd UP标记液、二硝基氟苯、豚鼠血清,美国Sigma公司;绵羊红细胞(SRBC),天津市大茂化学试剂厂;YAC-1细胞,赛默飞世尔科技(中国)有限公司;Tris-HCL缓冲液,天津市大茂化学试剂厂。
游标卡尺,金坛市双捷实验仪器厂;DHP-9272型电热二氧化碳培养箱,上海一恒科技有限公司;高压蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;精密电子天平(0.0001 g),瑞士梅特勒-托利多有限公司;全血细胞分析仪,帝斯曼公司;5804R型冷冻高速离心机,德国Eppendorf公司;振荡器,美国Mettler-Toledo有限公司;HDL超净工作台,北京东联哈尔仪器制造有限公司;酶标仪,山东博科生物产业有限公司;分光光度计,日本电子株式会社;足趾容积测量仪、Q Exactive HFX型高分辨质谱、流式细胞仪、移液器,美国Thermo公司;溶血空斑自动图像分析仪,德国维根斯公司;CX 43型显微镜,奥林巴斯株式会社;N 123002型-80℃冰箱,青岛海尔股份有限公司。
1.2 实验方法
1.2.1 菌悬液的配制
根据实验要求人体需求量及样品规格,参考20 g小鼠与70 kg成人体表面积比例参数0.0026,以6.34 mg/kg为小鼠灌胃体积。
1.2.2 动物分组及模型的构建
健康BABL/c雄性小鼠112只(n=14只/组),鼠龄6~8周,体重20~22 g,维持室温(25±2℃),相对湿度(55±2)%,12 h/12 h昼夜交替光照,自由进食和饮水。每组分两笼饲养,每笼10只,普通饲料适应性喂养5 d。具体分组及样品量如见表1所示。随机分为6个大组,每个大组14只小鼠,每个大组中设立1个正常对照组,每种样品设立1个剂量组。以灌胃方式喂养小鼠,灌胃体积为6.34 mg/kg的B0、BL-99、LPC0、ET-22,灌胃周期为28 d。

表1 动物模型分组
1.2.3 样品采集与处理
每天观察小鼠活动,耗食量,体重及大便性状,并定期称量小鼠的体重。在实验结束后,结肠炎组的小鼠采用戊巴比妥钠腹腔注射麻醉,腹主动脉取血,离心分离血清。分离小鼠结肠,以PBS冲洗多次后,测量长度,剪切2/3存于离心管中,-80℃保存。1/3储存于10%福尔马林溶液中固定备用。剥离完整脾脏,称重,计算脾脏指数。
1.2.4 碳廓清实验
在一定范围内,体内碳颗粒被清除速率与血碳浓度呈指数关系。以血碳浓度对数值为纵坐标,时间为横坐标,两者呈直线关系。此支线的斜率(κ)可表示吞噬速率。动物肝、脾重量影响吞噬速率,吞噬速率与免疫力相关。
动物连续灌胃干预28 d,称体重,尾静脉注射印度墨汁,注入墨汁后第2 min及第10 min,取血20μL,加入2 mL的0.1%碳酸钠溶液中,600 nm处测定OD值。将小鼠处死,取肝脏和脾脏,用滤纸吸干脏器表面血污,称重。
以吞噬指数表示小鼠碳廓清的能力,按照公式进行计算。
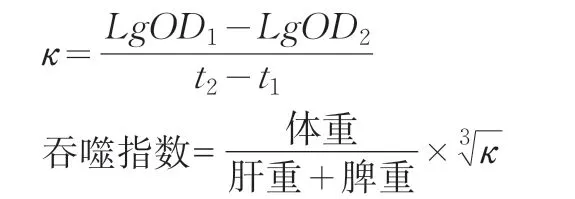
1.2.5 脏器、体重比值测定
将小鼠初始体重和灌胃干预28 d后称重分别作为初始体重和终体重,小鼠脱臼处死,取脾脏和胸腺,去尽筋膜,用滤纸吸干脏器表面血污,称重,计算脾脏、体重比值和胸腺、体重比值。
1.2.6 血清溶血素半数溶血值(HC50)的测定
用SRBC免疫动物后,血清中出现SRBC抗体(溶血素),在补体参与下,与SRBC一起孵育,可发生溶血反应,释放血红蛋白,通过测定血红蛋白含量反应动物血清中溶血素的含量。
动物连续灌胃干预28 d后经腹腔对每只小鼠注射SRBC 0.2 mL进行免疫。4 d后,摘除眼球取血于1.5 mL离心管内,4℃放置约1 h,使血清充分析出,2 000 r/min离心10 min收集血清。取血清用SA缓冲液稀释100倍。将稀释后的血清加入96孔板,每孔100μL,再依次加入10%(v/v)SRBC 50μL,补体100μL(用SA溶液按1∶8稀释),置37℃恒温水浴中保温30 min,1 500 r/min离心10 min。然后样品孔和空白对照孔各取上清液50μL,加入另一个96孔培养板内,加文奇氏试剂150μL,同时设半数溶血孔,加入12.5μL的10%(v/v)SRBC,再加文奇氏试剂至200μL,用震荡期充分混匀,放置10 min后,在540 nm处用全自动酶标仪测定各孔光密度值。
溶血素的量以半数溶血值(HC50)表示,按以下公式计算:

1.2.7 抗体生成细胞检测实验
经过SRBC免疫的小鼠脾细胞悬液与一定量的SRBC混合,在补体参与下,使分泌抗体的脾细胞周围的SRBC溶解,形成肉眼可见的空斑,溶血空斑数可反映抗体生成细胞数。
动物连续灌胃干预28 d后,经腹腔对每只小鼠注射0.2 mL的SRBC进行免疫反应。将SRBC免疫4 d后的小鼠处死,取脾,制成5×106个细胞/mL的细胞悬液。将琼脂糖加热溶解后,与等量双倍的Hank’s液混合,分装小试管,每管0.5 mL,再向管内加50μL的20%(v/v),用生理盐水配置)SRBC,取脾细胞悬液200μL,迅速混匀,倾倒至已刷琼脂糖薄层的六孔板上,带琼脂凝固后,放入二氧化碳培养箱中继续孵育1 h,然后加入SA缓冲液稀释的补体(1∶10),继续孵育2 h,计数溶血空斑数。
1.2.8 ConA诱导的小鼠淋巴细胞转化实验
当T淋巴细胞收ConA刺激后母细胞发生增殖反应,活细胞特别是增值细胞中线粒体水解酶可将MTT分解为蓝泽色结晶,其光密度值能反映细胞的增值情况。
动物连续灌胃干预28 d后,将小鼠处死,在75%酒精的烧杯中消毒后,无菌取脾,置于装有3 cm×3 cm四层纱布(高压灭菌)的小平皿中,加入适量无菌Hank’s液,用纱布将脾宝珠,用弯头蹑轻轻地将脾磨碎,制成单细胞悬液,用Hank’s液洗2次,每次1 000 rpm离心10 min,然后将细胞悬浮于2 mL的完全培养液中,计数活细胞数,调整细胞浓度为5×106个/mL。再将细胞悬液分两孔加入24孔培养办中,每孔1 mL,在其中一孔加入75μL的ConA液(相当于7.5μg/m L),另一孔作为对照,37℃培养72 h。培养结束前4 h,每孔轻轻吸去上清液,加入0.7 mL的不含小牛血清的RPMI 1640培养液,同时加入MTT(5 mg/mL)50μL/孔,继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,吹打均匀,使紫色结晶完全溶解。然后分装到96孔培养板中,每个孔分装2孔作为平行样,用酶联免疫检测仪,在570 nm波长测定光密度值。以加与不加ConA孔的光密度值的差值表示淋巴细胞的增值程度。
1.2.9 NK细胞活性测定
正常情况下,活细胞浆内含有的LDH不能透过细胞膜,当细胞受到NK细胞的杀伤后,LDH释放到细胞外。LDH可使乳酸锂脱氢,进而使NAD还原成NADH,后者再经递氢体还原成紫红色甲胺类化合物,在490 nm处测定吸光值。
动物连续灌胃干预28 d,开始实验前24 h将靶细胞YAC-1进行传代培养,用前以Hank’s液洗2次,用含10%小牛血清的RPMI 1640完全培养液调整细胞浓度为1×105个/m L(靶细胞)。小鼠颈椎脱臼猝死,无菌取脾,制成皮细胞悬液,用Hank’s液洗2次,1000 rpm离心10 min,再用2 mL含10%含小牛血清的RPMI 1640完全培养基重悬,用台盼蓝活细胞染色计数(活细胞数应在95%以上),调整细胞浓度为1×107个/mL(效应细胞),使效靶比为100∶1。取靶细胞和效应细胞各100μL,加入U型96孔培养板中,靶细胞自然释放孔加靶细胞和培养液各100μL,靶细胞最大释放孔加靶细胞和1%的NP40各100μL,上述均设3个平行孔,培养4 h,将96孔培养板以1 500 rpm离心5 min,每孔吸取上清100μL置平底96孔培养板中,同时加入LDH基质液100μL,反应3 min,然后每孔加入1 mol/L的HCL溶液30μL终止反应,在酶标仪490 nm处测OD值,NK活性按下式计算:
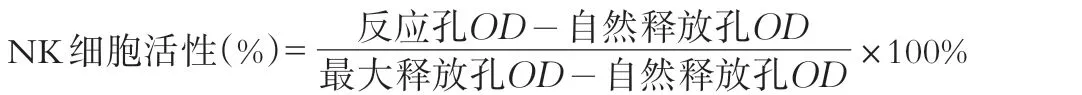
1.2.10 迟发型变态反应
SRBC可刺激T淋巴细胞增值成致敏淋巴细胞,4 d后,当再以SRBC攻击时,攻击部位出现肿胀,其肿胀程度可反映迟发型变态反应程度。
动物连续灌胃干预28 d后,每鼠腹腔注射0.2 mL的2%压积SRBC(v/v,用生理盐水配制),致敏4 d后,测量左后足趾部厚度,同一部位测量3次,取平均值。然后在测量部位皮下注射20μL的20%SRBC,注射后于24 h测量左后足趾部厚度,同一部位测量3次取平均值,以攻击前后足趾厚度的差值(足趾肿胀度)来表示DTH的程度。
1.2.11 小鼠腹腔巨噬细胞吞噬实验
巨噬细胞具有活跃的吞噬功能,能清除体内抗原物质及变性的细胞,在特异性及非特异性免疫中均起重要作用。巨噬细胞受抗原刺激后活化,可使其吞噬功能明显增强,吞噬百分率及吞噬指数可以反映机体的免疫能力。
动物连续灌胃干预28 d后,灌胃结束前4 d给每只小鼠腹腔注射0.2 mL的2%SRBC激活小鼠巨噬细胞,实验当天用颈椎脱臼法处死小鼠,腹腔注射加小牛血清的Hank’s液3 mL/只,轻轻按揉腹部20次,以充分洗出腹腔巨噬细胞,然后将腹壁剪开一个小口,吸取腹腔洗液0.5 mL混合液,加入玻片的琼脂圈内。放置孵箱内37℃孵育15~20 min。孵育结束后迅速用生理盐水将未贴壁细胞冲净,于甲醇液中固定1 min,Giemsa染色15 min。用蒸馏水冲洗干净,晾干,用40×显微镜计数吞噬率和吞噬指数。吞噬率为每100个吞噬细胞中,吞噬鸡红细胞的吞噬细胞所占的百分率;吞噬指数为平均每个吞噬细胞吞噬鸡红细胞的个数。
结果按下式计算:

1.2.12 实验数据统计
所有试验数据均使用SPSS软件进行单因素方差分析,使用Origin软件、Excel软件和GraphPad Prism 8.02进行绘图分析。试验结果以平均值±标准差(Mean±SD)表示,p<0.05表示差异具有统计学意义。
2 结果与分析
2.1 乳酸菌对小鼠的脏器/体重比值影响
饲喂乳酸菌粉期间,小鼠活动正常,生长发育良好,未观察到异常体征或死亡。4株乳酸菌对小鼠的脏器/体重比值如图1所示,从图中可以看出,各组乳酸菌对小鼠脾脏/体重比值和胸腺/体重比值与对照组之间无显著性差异(p<0.05),说明4种乳酸菌均未对小鼠脾脏和胸腺产生显著影响作用。
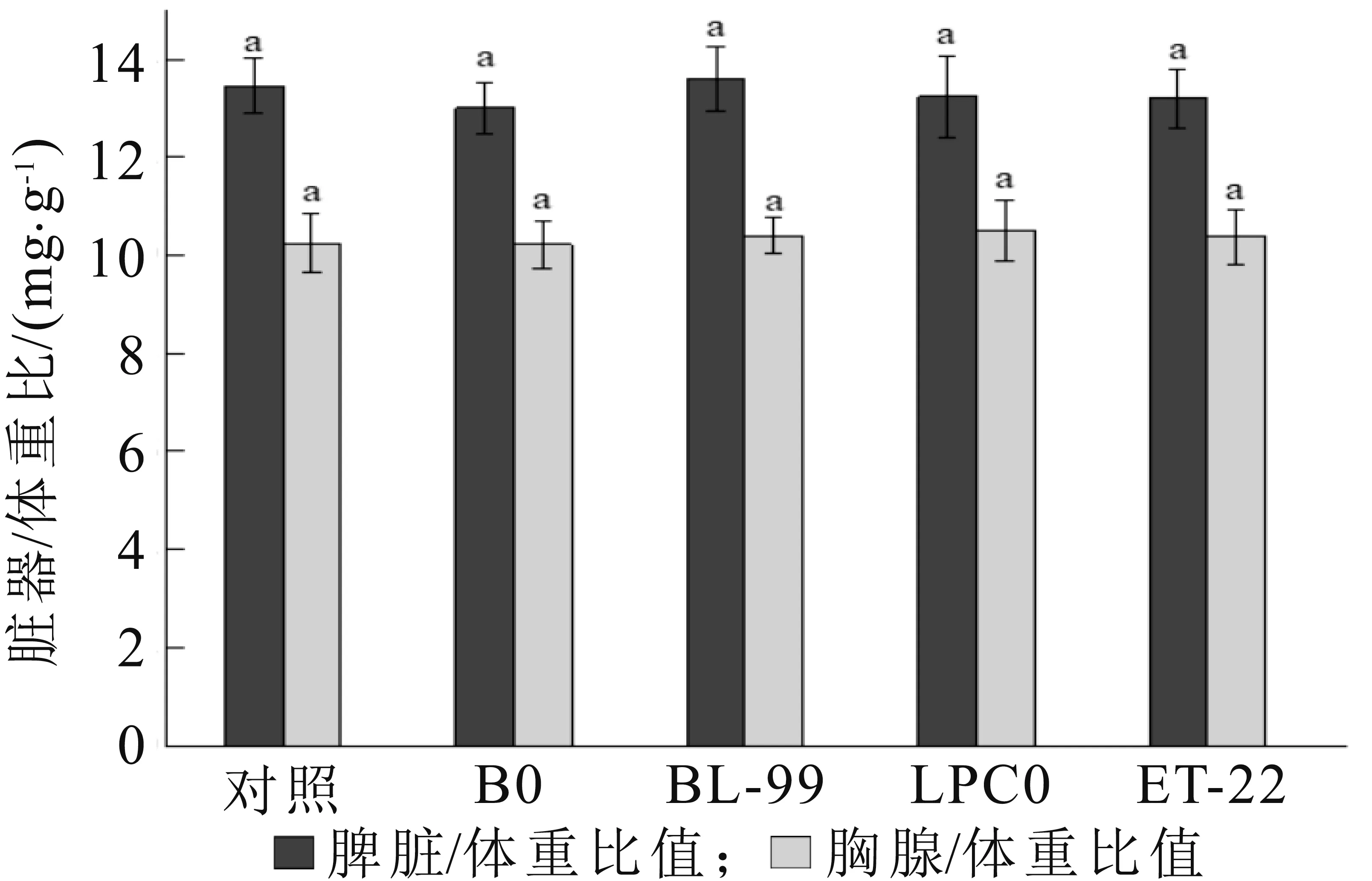
图1 小鼠体重及脏器体重比值
2.2 乳酸菌对小鼠体液免疫功能的影响
2.2.1 半数溶血值
与对照组相比,B0、BL-99、LPC0和ET-22组半数溶血值HC50均有极显著性升高(p<0.01),并且全部呈阳性,如表1所示。

表1 半数溶血值HC50结果
2.2.2 抗体生成细胞数
抗体生成细胞数结果显示,样品组与对照组相比,B0、BL-99、LPC0和ET-22组极显著高于对照组(p<0.01),并且全部呈阳性。4株菌的半数溶血值HC50与抗体生成细胞数结果均呈阳性,证明其具有体液免疫作用,如表2所示。

表2 抗体生成细胞数结果
2.3 乳酸菌对小鼠细胞免疫功能的影响
2.3.1 脾淋巴细胞转化
小鼠淋巴细胞转化实验结果由加入ConA前后的吸光值差值(OD)表示,结果见表3,由表可以得出,与对照组相比,B0组显著高于对照组(p<0.05),结果呈阳性,其他各组的OD差值与对照组相比无显著性变化。
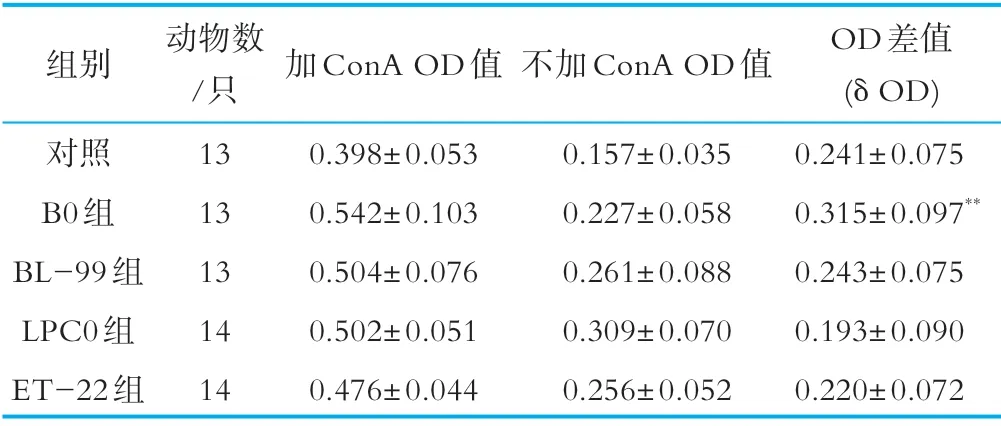
表3 小鼠脾淋巴细胞转化实验结果
2.3.2 迟发型免疫反应
从表4可以看出,SRBC攻击前,各组小鼠的足趾厚度均处于同一水平,SRBC共计24 h后,小鼠足趾部出现肿胀,肿胀度使用攻击前后足趾部厚度差值表示。通过统计分析发现,与对照组相比,B0、BL-99、LPC0组则极显著高于对照组(p<0.01),结果呈阳性;ET-22组没有显著性,结果呈阴性。

表4 小鼠迟发型变态反应足趾肿胀结果
2.4 乳酸菌对小鼠单核-巨噬细胞功能的影响
2.4.1 碳廓清实验
碳廓清实验的吞噬指数结果显示,除BL-99组低于对照组外,其他给予各种受试样品的小鼠碳廓清实验的吞噬指数与对照组相比均无显著差异(p>0.05),BL-99组干预小鼠的吞噬指数与对照组相比具有显著差异(p<0.05),如表5所示。

表5 碳廓清实验中吞噬指数结果
2.4.2 NK细胞活性
从表6可以看出,除B0组外,与对照组相比,其他各组样品的NK细胞活性均高于对照组,且差异具有极显著性(p<0.05),检测结果为阳性。

表6 NK细胞活性检测结果
2.4.3 巨噬细胞吞噬荧光微球实验
从吞噬细胞吞噬率和吞噬指数结果可以得出,B0组吞噬率和吞噬指数与对照组相比均无显著性差异,BL-99组吞噬率和吞噬指数与对照组相比均具有显著性差异,LPC0、ET-22组吞噬指数均极显著高于对照组(p<0.01),BL-99、LPC0和ET-22结果呈阳性,证明其有免疫功能作用,如表7所示。
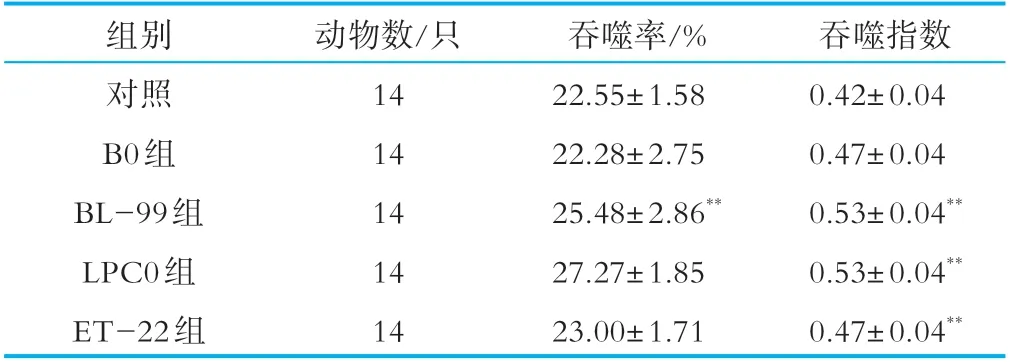
表7 巨噬细胞吞噬率及吞噬指数结果
3 结论
机体的免疫系统能够识别和清除外来入侵物和抗原[12],还可识别和清除体内发生突变的肿瘤细胞、衰老死亡的细胞或其他有害的成分,可以说是一道精密、复杂、保护机体抵御外来伤害的屏障。免疫系统包括免疫器官、免疫细胞、免疫分子3个部分,胸腺和脾脏属于免疫器官[13],免疫细胞中的NK细胞[14]与非特异性免疫有关,T细胞与细胞免疫有关,而B细胞与体液免疫有关[15]。本实验用脏器/体重比来反映免疫功能,并分别从单核-巨噬细胞活性测定实验、NK细胞活性测定实验、细胞免疫、体液免疫来验证4株益生菌是否可以增强小鼠免疫功能,依据判定标准,上述几个指标检测中任两个结果为阳性,即可表明菌株具有增强免疫力的功能。
益生菌和益生元的功能复杂多样,不同益生菌的免疫激活和调节机制不同[16],而免疫器官的比重常常用来作为评价免疫能力的一个指标[14]。半数溶血值的测定可检测小鼠体内产生的抗体溶血素在补体的参与下,与SRBC共同孵育后会发生溶血反应,释放血红蛋白来评价产生溶血素的能力;T细胞受ConA刺激后可使母细胞增殖,其转化率可反映细胞免疫功能;NK细胞是一种免疫淋巴细胞,与抗肿瘤抗病毒有关,具有非特异性杀伤作用。
本研究发现,各组益生菌对小鼠脏器/体重比值与对照组之间无显著性差异(p<0.05),说明4株益生菌均未对小鼠脾脏和胸腺产生显著影响作用。体液免疫通过半数溶血值和抗体生成细胞数实验发现,4株益生菌均能显著影响小鼠体液免疫。细胞免疫结果表明,脾淋巴细胞转化和迟发型免疫反应,B0均极显著高于对照组,BL-99和LPC0,在迟发型免疫反应中显著高于对照组。碳廓清实验、NK细胞活性以及巨噬细胞吞噬荧光微球实验结果表明,除B0以外,其他3株益生菌均对单核-巨噬细胞功能具有显著性影响。实验依据《保健食品功能评价技术规范》设计,同时,结果符合评价程序中“具有增强免疫力”的评价标准,因此可判断,4株菌均具有增强免疫力的功能。
综上,该试验条件下的4株益生菌未对小鼠产生负面影响,并能够从多方面增强小鼠的免疫机能。
