肝硬化上消化道出血患者血清miR-130a表达情况及与病情严重程度和预后的相关性
2021-11-01杨洪光杨晓瑜
谈 理,杨洪光,郑 波,杨晓瑜
肝硬化是一种或多种病因引起的慢性进行性肝病,主要以肝功能损伤及门静脉高压为特点,晚期常引起上消化道出血等并发症,严重影响患者的生存质量和生命安全[1]。既往研究表明,肝硬化患者上消化道出血6周后的病死率高达15%[2],且40%~70%因首次出血死亡[3],积极寻找疾病诊断及预后评估的相关指标是制定个体化治疗方案,降低病死率的关键。肝硬化患者肝功能显著下降,加之上消化道出血及腹腔积液刺激,使免疫功能明显降低[4]。miR-130a是一种内源性非编码小分子单链RNA,可通过选择性结合靶基因上的信使RNA,起到抑制基因表达的作用[5]。现有研究已表明,miR-130a可参与细胞凋亡、分化、组织发育等生理过程,还能有效调控机体免疫反应[6]。但miR-130a是否与肝硬化上消化道出血病情及预后有关,目前相关报道较少。据此,本文探究肝硬化上消化道出血患者血清miR-130a表达情况及与病情严重程度和预后的相关性,旨在为发病机制研究提供参考依据。
1 资料与方法
1.1一般资料 选择2017年1月—2020年1月于我院就诊的肝硬化208例。①纳入标准:肝硬化符合《肝硬化诊治指南》[7]中代偿期或失代偿期肝硬化相关诊断标准;上消化道出血患者伴有呕血、黑便及大便隐血试验阳性,且经胃镜证实;年龄>18岁;患者及其家属对本研究知情,并签署知情同意书。②排除标准:合并缺铁性贫血、巨幼红细胞性贫血、自身免疫性溶血性贫血等血液系统疾病者;口、鼻、咽部出血者;合并恶性肿瘤者;近期服用影响凝血功能药物者;合并肾衰竭、急性感染性疾病者。另选择同期健康体检的志愿者57例为对照组。本研究经医院医学伦理委员会批准执行。
1.2研究方法
1.2.1临床资料收集:记录肝硬化患者入院时及对照组体检当天的一般资料,对所有肝硬化患者进行6个月的出院随访,并记录死亡情况。一般资料包括姓名、性别、病程、病因等,实验室检测血液相关指标包括血小板(PLT)、白蛋白(ALB)、凝血功能[凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)、国际标准化比值(INR)]等,终末期肝病模型(MELD)评分应用公式计算,MELD=9.6×In(肌酐mg/dl)+3.8×In(胆红素mg/dl)+11.2×In(INR)+6.4×病因,公式中病因为胆汁淤积或酒精性肝炎均记0分,其他病因记1分,得分越高,表示其风险越大。
1.2.2血清miR-130a检测:采用定量逆转录聚合酶链反应(qRT-PCR)检测血清miR-130a相对表达量,具体步骤如下:①血清样本提取:采集空腹静脉血10 ml,置于无菌采血管,离心后取上清液-80 ℃超低温冷冻保存;②总RNA提取:取180 μl血清样本,加入1 ml总RNA提取试剂Trizol液(Invitrogen,Grand Island,NY),振荡器混匀,室温下静置5 min;加入0.2 ml三氯甲烷,振荡器混匀15 s,室温下静置10 min;4 ℃条件下12 000 r/min离心15 min;吸取上层水相液体至新的1.5 ml EP管,加入1 ml异丙醇,振荡器混匀,室温下静置10 min;4 ℃条件下12 000 r/min离心10 min,弃去上清液,加入75%乙醇1 ml,轻轻摇动;4 ℃条件下离心5 min,弃去上清液,在室温下干燥或真空干燥5 min,加入焦碳酸二乙酯30 μl,待其溶解后置于-80 ℃低温冰箱中保存。③RNA质量检测:使用NanoDrop 8000紫外-可见光分光光度计进行RNA浓度检测,比值为1.8~2.0。④qRT-PCR分析:参考GenBank数据获取待测基因序列,应用Primer 5.0软件分析,引物浓度0.4 μmol/L,RNA模板0.6 μl,93 ℃预变性5 min,93 ℃变性40 s、58 ℃退火30 s、72 ℃延伸60 s,共40个循环;每个待测样本设置3个平行样本,以β-actin作为内参基因,根据目标基因设计合成相应上下游引物进行qRT-PCR扩增,采用2-ΔΔCt进行miR-130a基因相对表达量的计算。miR-130a正向引物:5'-AGTCTATACAAGGGCAAGCTCTC-3',反向引物:5'-CCCAATACGACCAAATCCGTT-3';β-actin正向引物:5'-CTCGCTTCGGCAGCACA-3',反向引物:5'-AACGCTTCACGAATTTGCGT-3'。
1.2.3分组方法:①根据是否合并上消化道出血将肝硬化患者分为出血组90例与无出血组118例;②根据肝功能Child分级评分将出血组分为A级组13例、B级组26例、C级组51例,其中A级:得分5~6分,B级:得分7~9分,C级:得分10~15分[8];③根据上消化道出血严重程度分级将出血组分为轻度组34例、中度组45例、重度组11例,其中轻度:失血量<500 ml,血压、心率、血红蛋白基本正常,仅头晕,休克指数(心率/收缩压)0.5;中度:失血量500~1000 ml,血压下降,心率>100/min,血红蛋白70~100 g/L,出现晕厥、口渴等症状,休克指数1.0;重度:失血量>1500 ml,收缩压<80 mmHg,心率>120/min,血红蛋白<70 g/L,出现四肢发冷、意识模糊等症状,休克指数1.5[9]。
1.3观察指标 比较所有研究对象的临床资料,比较各组血清miR-130a相对表达量,分析血清miR-130a表达对肝硬化患者上消化道出血的评估价值,以及肝硬化上消化道出血患者血清miR-130a表达与肝功能分级、出血严重程度的相关性。以肝硬化上消化道出血患者住院期间或出院6个月内死亡作为预后终点,评估影响患者预后的独立危险因素。
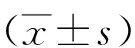
2 结果
2.1一般资料比较 3组年龄、性别比较差异无统计学意义(P>0.05)。出血组病因、PLT、PT、TT、INR与无出血组比较差异无统计学意义(P>0.05)。出血组病程、APTT、FIB、肝功能Child分级评分、MELD评分、血清miR-130a表达水平高于无出血组,ALB低于无出血组(P<0.05)。出血组和无出血组PT、APTT、TT、FIB、INR、血清miR-130a表达水平高于对照组,ALB、PLT低于对照组(P<0.05)。见表1。

表1 肝硬化合并、未合并上消化道出血患者和健康体检志愿者3组的一般资料比较
2.2血清miR-130a表达对肝硬化患者上消化道出血的评估价值 血清miR-130a表达水平评估肝硬化患者上消化道出血的最佳截断值为7.3,曲线下面积为0.861(95%CI:0.806,0.905),对应的敏感度、特异度分别为83.90%、77.78%。见图1。

2.3不同肝功能分级肝硬化上消化道出血患者血清miR-130a表达水平比较 A级组血清miR-130a表达水平为7.12±1.26,B级组为9.12±2.04,C级组为13.26±3.24。A级组血清miR-130a表达水平低于B级组和C级组,且B级组低于C级组(P<0.05)。
2.4不同出血严重程度肝硬化上消化道出血患者血清miR-130a表达水平比较 轻度组血清miR-130a表达水平为7.44±1.83,中度组为8.86±1.46,重度组11.12±0.97。轻度组血清miR-130a表达水平低于中度组和重度组,且中度组低于重度组(P<0.05)。
2.5相关性分析 肝硬化上消化道出血患者血清miR-130a表达与肝功能分级及出血严重程度均呈显著正相关性(r=0.451、0.527,P均<0.001)。
2.6单因素Cox回归模型分析 本组肝硬化上消化道出血患者住院期间或出院6个月内死亡21例,以死亡作为预后终点。单因素分析显示,病程、肝功能Child分级评分、MELD评分、血清miR-130a表达水平是影响肝硬化上消化道出血患者预后的相关因素(P<0.05,P<0.01)。见表2。

表2 影响肝硬化上消化道出血患者预后的单因素Cox回归模型分析
2.7多因素Cox回归模型分析 将上述单因素分析中差异有统计学意义的指标纳入多因素分析,结果显示,病程、肝功能Child分级评分及血清miR-130a表达水平是影响肝硬化上消化道出血患者预后的独立危险因素(P<0.01)。见表3。

表3 影响肝硬化上消化道出血患者预后的多因素Cox回归模型分析
3 讨论
现代医学认为在肝硬化代偿期时,随着肝功能的下降及侧支循环的不断开放,出现门静脉高压症状,表现为门静脉内径增宽及食管、胃底静脉曲张等特征。随着肝硬化患者病情加重,逐渐从代偿期过渡到失代偿期,门静脉高压继续加重,在各种因素的影响下极易引起上消化道出血[10-11]。另外,随着病程的延长,肝硬化患者肝功能损伤程度逐渐加重,导致其凝血功能紊乱及ALB等生化指标异常[12]。本研究结果显示,出血组病程、APTT、FIB、肝功能Child分级评分、MELD评分、血清miR-130a表达水平高于无出血组,ALB低于无出血组;出血组和无出血组PT、APTT、TT、FIB、INR、血清miR-130a表达水平高于对照组,ALB、PLT低于对照组。提示肝硬化患者上述指标出现明显异常,其中部分指标可能提示上消化道出血的发生,而肝功能Child分级评分、MELD评分可在一定程度上反映患者病情严重程度。另外,ROC曲线结果表明血清miR-130a表达水平可作为评估肝硬化患者发生上消化道出血的有效指标。
目前,临床有关肝硬化患者并发上消化道出血的危险因素研究较多,但因样本纳入标准及分析方法不同,国内外研究结果亦存在争议[13-14]。周思举[15]研究认为,肝硬化患者发生上消化道出血是由于肝功能降低引起的凝血功能障碍及腹腔积液等出血刺激因素;同时由于患者免疫系统紊乱,极易导致院内感染率升高。miR-130a是具有调节基因表达功能的关键因子,能在机体抗感染过程中起到重要作用[16]。大量研究已证实,miR-130a与急性冠状动脉综合征、颅脑损伤等疾病具有明显的相关性[17-18]。薛扬和郭宏强[19]研究发现,乙型肝炎病毒相关慢加急性(亚急性)肝衰竭患者血清miR-130a表达水平较健康体检者异常升高,考虑可能与诱导免疫细胞因子的释放有关。另外,本研究结果还显示,A级组血清miR-130a表达水平低于B级组和C级组,且B级组低于C级组;轻度组血清miR-130a表达水平低于中度组和重度组,且中度组低于重度组;肝硬化上消化道出血患者血清miR-130a表达与肝功能分级及出血严重程度均呈明显正相关性。提示血清miR-130a表达能反映肝硬化上消化道出血患者的肝功能及出血严重程度。动物及细胞学研究证明,miR-130a可参与多种病因导致的肝衰竭发病过程,且能反映肝功能的损伤程度[20]。肝硬化患者升高的miR-130a表达水平与丙氨酸转氨酶等互相影响,从而加重病情发展。
有研究表明,miR-130a在人类获得性免疫及固有免疫中均具有至关重要的作用,主要通过靶基因蛋白对自身免疫系统产生作用[19]。但miR-130a在肝硬化患者中的研究相对较少,与患者预后相关的分析报道也极少见。本研究结果发现,病程、肝功能Child分级评分及血清miR-130a表达水平是影响肝硬化上消化道出血患者预后的独立危险因素。随着肝硬化患者病情的加重,门静脉高压症状越发严重,导致食管、胃底静脉曲张,极易破裂出血,危及患者生命安全。miR-130a可有效调控患者淋巴细胞、内皮细胞、中性粒细胞的活性,并参与炎症反应,加强药物对病变细胞的杀伤力,还可促进淋巴细胞与肝脏病变组织结合,从而建立反应灶,但其相对表达量升高提示病情严重程度增加,因而患者预后相对较差。
综上所述,肝硬化上消化道出血患者miR-130a表达水平显著升高,并与肝功能及出血严重程度呈显著正相关性。从分子水平研究与肝硬化上消化道出血发病相关的基因,对病情评估及治疗具有重要的临床意义。
