剪切波弹性成像弹性模量值与乳腺癌临床病理及分子分型的关系
2021-11-01刘品红王珊珊
刘品红,王珊珊,于 龙
乳腺癌是一种发病率较高的受雌性激素影响的高异质性恶性肿瘤疾病,可严重危害女性生命健康[1]。乳腺癌的分子分型可受多种混杂因素影响,有临床研究证实,不同分子分型乳腺癌的治疗方法及预后也存在差异[2-3]。因此,及早准确鉴别乳腺癌的分子分型对提高患者生存质量具有重要意义。由于乳腺癌病灶组织的硬度值较良性组织更大,超声弹性成像技术则能通过检测病灶组织弹性变化来鉴别良恶性乳腺病变,故临床多采用超声弹性成像技术区分乳腺肿瘤类型。国内外研究认为,实时剪切波弹性成像(SWE) 技术可定量测定肿瘤病灶的弹性模量值,并鉴别肿瘤性质[4-5]。但目前关于SWE弹性模量值与乳腺癌临床病理的关系,及其在不同分子分型乳腺癌病灶中的差异研究尚少。基于此,本研究采用SWE技术分析弹性模量值与乳腺癌不同分子分型及临床病理的关系,结果报告如下。
1 资料与方法
1.1一般资料 选取2018年10月—2020年12月在我院接受治疗的93例女性乳腺癌(112个病灶)为研究对象。年龄26~47(36.73±10.82)岁;病程1.5~5.0(3.26±1.73)年;病灶侧别:左侧67例,右侧20例,双侧6例;病灶直径1.12~2.60(1.86±0.74)cm。①纳入标准:均经手术病理证实为乳腺癌,且术前均接受SWE检查;术前未接受乳腺癌相关治疗;患者均自愿签署知情同意书。②排除标准:已接受手术、辅助放化疗的乳腺癌患者;存在严重心脑血管、肝肾系统疾病者;免疫组织化学资料不完整者。
1.2检查方法 患者取仰卧位,暴露双侧乳房及腋窝,术前采用二维超声(AixPlorer,SuperSonic Imagine)检查乳腺病灶,探头频率4~15 MHz,分析肿瘤病灶大小、形状及血流情况的图像特征;切换至SWE模式,设定感兴趣区,覆盖整个病灶边界,注意避免压迫乳腺组织,患者屏气后,静置探头3 s,将获得的图像保存至超声仪内。按此法获得各病灶弹性图像3帧,将测量框置于病灶最硬处,定量测定乳腺癌病灶硬度,记录代表肿块硬度的弹性模量平均值(Emean)、最大值(Emax)。所有操作均由同一位具有3年以上相关操作经验的医师完成。
1.3病理分级和免疫组织化学 取乳腺癌患者术后组织病理标本,石蜡包埋,连续切片,层厚4 μm,根据WHO乳腺肿瘤分类标准进行组织学分级[6]。全自动免疫组织化学法或原位杂交染色法测定孕激素受体(PR)、雌激素受体(ER)、细胞增殖抗原标记物(Ki-67)和人类表皮生长因子受体-2(HER-2)的表达情况。HER-2表达根据美国临床肿瘤学会/美国病理医师学院发布的检测指南[7]评价为阴性或阳性,Ki-67蛋白阳性表达为细胞核内棕黄色颗粒>15%,若≤14%则为阴性表达。
1.4分子分型标准 根据《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》[8]将乳腺癌病灶分为Luminal A型、Luminal B型、三阴性乳腺癌(TNBC)和HER-2过表达型。
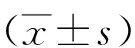
2 结果
2.1病理类型与分子分型 本研究112个病灶中,根据病理类型分为浸润性导管癌87个(77.68%)、浸润性小叶癌9个(8.04%)、导管内癌7个(6.25%)、黏液腺癌6个(5.36%)、其他3个(2.68%);根据分子分型分为Luminal A型47个(41.96%)、Luminal B型36个(32.14%)、HER-2过表达型21个(18.75%)、TNBC 8个(7.14%)。其中病理类型以浸润性导管癌最多,占比77.68%;分子分型以Luminal A型病灶最多,占比41.96%。
2.2不同分子分型乳腺癌病灶的Emax、Emean值比较 Luminal A型、Luminal B型、TNBC和HER-2过表达型病灶的Emax、Emean值比较差异有统计学意义(P<0.01);TNBC和HER-2过表达型病灶的Emax、Emean值均高于Luminal A型(P<0.05);但与Luminal B型比较差异无统计学意义(P>0.05)。见表1。

表1 不同分子分型乳腺癌病灶的Emax、Emean值比较
2.3不同临床病理特征乳腺癌病灶的Emax、Emean值比较 不同组织学分级、肿瘤直径及HER-2表达乳腺癌病灶的Emax、Emean值比较差异均有统计学意义(P<0.05,P<0.01)。不同病理类型、PR、ER、Ki-67表达乳腺癌病灶的Emax、Emean值比较差异无统计学意义(P>0.05)。见表2。

表2 不同临床病理特征乳腺癌病灶的Emax、Emean值比较
2.4Pearson相关性分析 Emax、Emean值与分子分型、组织学分级、肿瘤直径、HER-2表达均呈显著正相关(P<0.05,P<0.01)。见表3。

表3 Emax、Emean值与乳腺癌不同分子分型及临床病理的Pearson相关性分析
3 讨论
乳腺癌是一种具有多样化影像学特征的乳腺恶性肿瘤,有研究指出,病灶硬度与其恶性程度存在密切相关性[9]。同时,因乳腺癌肿瘤组织分子表达不同,且病理学特征亦有差异,故需根据不同分子分型给予对应的治疗方法,方能达到改善患者预后的效果[10]。专家共识指出,免疫组织化学检查是判断乳腺癌分子分型的公认标准,但由于该检查为侵入性操作,具有一定的局限性。SWE是一种脉冲声波下的触诊技术,能够通过定量分析系统收集到的弹性模量值,客观判断组织的硬度变化,已被广泛应用于甲状腺、乳腺肿瘤的临床诊断[11-12]。
国内有研究报道,乳腺癌病灶中Luminal A型占比为47.19%[13]。本研究结果显示,112个乳腺癌病灶中有87个为浸润性导管癌,占比77.68%;而分子分型中Luminal A型病灶占比41.96%,与上述研究结果相似。乳腺癌进展期周围结缔组织不断增生,肿瘤内血管持续生长,可使肿瘤体积变大,且硬度也随之增强。既往研究也曾发现,与HER-2和Ki-67阳性组比较,上述因子阴性组的Emax值明显降低[14-15]。而本研究结果显示,与Luminal A型比较,TNBC和HER-2过表达型病灶的Emax、Emean值均有明显升高,提示Emax、Emean值与乳腺癌的分子分型存在一定关联。而Pearson相关性分析结果也进一步证实了Emax、Emean值与乳腺癌的分子分型呈显著正相关。考虑原因为HER-2过表达型乳腺癌生长速度快且局部侵袭度高,病理表现为微血管密度高及淋巴细胞浸润,故而该类型乳腺癌病灶硬度也较Luminal A型高;TNBC病灶多为浸润性导管癌,且直径较大,组织学分级较高,恶性化程度更高,硬度也更大[16]。且上述2种分子分型的乳腺癌极易复发、转移,该类患者的预后较差,为临床诊治增加了难度。
有研究指出,预后较差的分子分型与Emax值具有密切相关性[15]。本研究结果也发现,高组织学分级乳腺癌病灶的Emax、Emean值高于低组织学分级;Pearson相关性分析结果表明,SWE弹性模量值与组织学分级呈正相关。乳腺癌组织学分级标准包括核分裂计数,提示高组织学分级病灶内的细胞排列更紧密,亦有更高的硬度。表明Emax、Emean值能够有效地判断乳腺癌恶性程度,从而弥补常规超声的不足。国内外研究也表明,肿瘤大小与硬度有关,且肿瘤大小可影响Emax值[14,17],而本研究结果也显示,肿瘤直径较大(>1.5 cm)病灶的Emax、Emean值高于肿瘤直径较小者,且呈显著正相关。考虑原因为当病灶直径较大时,其周围增生的结缔组织也更多,加之直径较大肿瘤内部有更多的微血管形成及间质水肿,故可影响弹性模量值。国内研究指出,ER阴性表达情况下,HER-2阳性患者SWE的杨氏模量值明显更高,且其多模态超声图像也存在差异[18]。而本研究也发现,Emax、Emean值与HER-2阳性表达有关。可能是因为HER-2阳性表达会引起细胞外基质中蛋白质积聚,而细胞外基质可通过胶原交联调节自身结构,并增加肿块硬度,这种调节机制还可促进肿瘤细胞的迁移。有研究指出,Ki-67的表达与乳腺癌淋巴结转移及患者的生存率有关,Ki-67表达水平越高,乳腺癌病灶恶性度越大,易发生侵袭,还可促进微血管增殖[19-21]。但本研究结果则表明,Ki-67表达与Emax、Emean值无明显相关性,考虑原因可能与样本纳入标准及检测方法的不同有关;此外,还可能由于导管内的病灶直径较大,SWE的测量也存在偏差,加之部分最硬处测量点难以准确选择,也可能产生测量偏差。如进行SWE时探头加压明显,也会影响弹性模量值的测量准确性,使之产生伪像。因此,操作时需调整量程,减少由测量点选择引发的误差;并避免对乳腺组织加压,保证患者屏住呼吸,以确保测量的准确性,减少误诊、漏诊率[22-23]。
综上所述,Emax、Emean值与分子分型、组织学分级、肿瘤直径及HER-2表达呈显著正相关,临床可将Emax、Emean值作为判断乳腺癌病情的有效指标。但本研究尚存不足之处,如研究样本较小,未深入分析Emax、Emean值对高侵袭度分子分型乳腺癌的预测价值等,还需进一步的大样本研究检验。
