细胞角蛋白19片段抗原21-1和循环肿瘤细胞检测对晚期食管癌化疗效果及预后生存的评估作用
2021-11-01杨学文肖书傲刘书尚郑高赞李孟彬
杨学文,肖书傲,刘书尚,郑高赞,李孟彬
食管癌在我国发病率较高,在所有因恶性肿瘤死亡的患者中,约50%为食管癌患者[1]。食管癌患者在早期无明显症状,到中晚期才出现进行性吞咽困难、有异物感、哽噎感等症状。晚期食管癌患者已不具备手术指征,需采用放化疗来延长生存期[2]。随着对分子生物标志物的不断研究,发现可利用特异度、敏感度高的分子生物标志物评估患者的预后生存情况,并明确化疗方案。细胞角蛋白19片段抗原21-1(CYFRA21-1)在初治的非小细胞肺癌患者中阳性表达率较高,是诊断中、晚期恶性肿瘤的重要标志物[3-4]。外周血循环肿瘤细胞(CTCs)是从肿瘤原发病灶脱落,通过血管或淋巴系统进入血液循环的肿瘤细胞。近年来有学者报道,CTCs在乳腺癌、肺癌等恶性肿瘤的侵袭、增殖中发挥主要作用,还能反映肿瘤的负荷状态,并及时评估治疗效果[5]。但CYFRA21-1和CTCs联合检测对晚期食管癌患者化疗效果及预后生存评估价值的相关文献报道较少。本研究旨在探讨CYFRA21-1和CTCs检测评估晚期食管癌化疗效果及预后生存的作用,为晚期食管癌患者疗效评估寻求切实可行的检测方法。
1 资料与方法
1.1一般资料 收集2014年1月—2018年1月我院收治的85例经临床及病理检查确诊为晚期食管癌的临床资料。男48例,女37例;年龄45~78(64.10±2.47)岁;病程2.4~4.8(3.12±0.54)年;临床分期:Ⅲ期48例,Ⅳ期37例。病灶长度≥5 cm者44例,<5 cm者41例。①纳入标准:均符合晚期食管癌诊断标准,且经病理检查明确诊断为鳞状细胞癌[6];临床资料及影像资料均完整;在纳入研究前2个月未进行相关放、化疗治疗;肿瘤无远处转移。②排除标准:合并其他系统恶性肿瘤者;化疗无法耐受者;合并严重心律失常、心肌梗死、脑梗死者;心、肺、肾等重要器官衰竭者。
1.2方法
1.2.1化疗方法:本研究中85例晚期食管癌术后化疗方案采用多西紫杉醇+顺铂。化疗前予以盐酸格拉司琼(山东罗欣药业集团股份有限公司;国药准字H20050279)3 mg静脉滴注,1/d,以防化疗时发生呕吐反应。在给予多西紫杉醇1 d前开始口服地塞米松(天津金耀药业有限公司;国药准字H12020514)16 mg/d,持续3 d,以防过敏反应和体液潴留。然后给予多西紫杉醇(江苏恒瑞医药股份有限公司;国药准字H20020543)60 mg/m2静脉滴注,治疗时间为1 h。第2~4天给予适当水化后的顺铂注射液(江苏豪森药业股份有限公司;国药准字H20040813)25 mg/m2静脉滴注2 h。化疗以4周为1个疗程,连续治疗4个疗程。
1.2.2血清CYFRA21-1检测方法:患者于入院后第1天及化疗结束后采集清晨空腹静脉血3 ml,无须抗凝,4 ℃条件下放置30 min,3000 r/min离心15 min,分离血清,-18 ℃保存待测。CYFRA21-1检测采用酶联免疫吸附试验,检测过程严格按说明书操作,680ELX-800酶标仪及相关试剂盒均由美国伯乐公司提供。CYFRA21-1>3.3 ng/ml为阳性[7]。
1.2.3外周血CTCs检测方法:患者于入院后第1天及化疗结束后采集清晨空腹静脉血7.5 ml,采用酶联免疫吸附试验检测外周血CTCs水平,酶标仪及相关试剂盒均购自美国伯乐公司。晚期食管癌CTCs阳性判定最佳临界值为1个,即7.5 ml外周血中只要发现CTCs均可判定为阳性[8]。
1.3观察指标 比较晚期食管癌患者化疗前后的CYFRA21-1、CTCs阳性率,以及化疗后不同CYFRA21-1、CTCs表达患者的预后生存情况。分析CYFRA21-1、CTCs及二者联合检测评估晚期食管癌患者预后生存的价值。
1.4随访 对85例晚期食管癌进行为期3年的随访,方式为复诊或电话随访,随访截止时间为2021年1月,记录不同CYFRA21-1、CTCs表达晚期食管癌患者的预后生存情况。
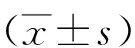
2 结果
2.1化疗前后CYFRA21-1、CTCs阳性率比较 晚期食管癌患者化疗前CYFRA21-1和CTCs阳性率分别为84.71%和95.29%,化疗后分别为41.18%和49.41%。晚期食管癌患者化疗后CYFRA21-1和CTCs阳性率均低于化疗前(P<0.01)。
2.2化疗后不同CYFRA21-1、CTCs表达患者的预后情况 随访结束时共有51例晚期食管癌患者死亡。CYFRA21-1阳性和阴性晚期食管癌患者的病死率分别为58.82%和41.18%,CTCs阳性和阴性患者分别为72.55%和27.45%。CYFRA21-1、CTCs阳性晚期食管癌患者的病死率均高于阴性患者(P<0.01)。
2.3化疗后不同CYFRA21-1、CTCs表达患者的半数生存时间比较 CYFRA21-1阴性和阳性晚期食管癌患者的半数生存时间分别为(27.28±0.20)个月和(22.50±1.15)个月,CTCs阴性和阳性患者分别为(24.94±1.19)个月和(19.85±0.45)个月。Kaplan-Meier法分析显示,CYFRA21-1和CTCs阳性晚期食管癌患者的半数生存时间均短于阴性患者(P<0.05)。见图1。

2.4CYFRA21-1、CTCs及二者联合检测评估患者预后生存的价值 CYFRA21-1、CTCs及二者联合检测评估晚期食管癌患者预后生存的曲线下面积(AUC)分别为0.860、0.850、0.962,以二者联合检测的AUC最大。二者联合检测的敏感度、特异度分别为88.65%、87.32%,均高于CYFRA21-1和CTCs单一检测(P<0.05)。见表1、图2。

表1 CYFRA21-1、CTCs及二者联合检测评估晚期食管癌患者预后生存的价值
注:CYFRA21-1为细胞角蛋白19片段抗原21-1,CTCs为循环肿瘤细胞,AUC为曲线下面积;与二者联合比较,aP<0.05

3 讨论
化疗为晚期食管癌患者的首选治疗方式,虽然同一阶段的疾病采取相同化疗方案,但大多数患者的预后都不同[9]。因此,采用分子生物标志物来预测患者的预后生存情况,然后根据患者个体差异制定受益最大的化疗方案,对改善预后意义重大。
CYFRA21-1广泛存在于上皮细胞及上皮细胞起源的恶性肿瘤细胞中,特别是在鳞癌中表达较高[10]。Mishra等[11]通过双抗体夹心法检测非小细胞肺癌患者血清中CYFRA21-1表达水平,发现CYFRA21-1水平与肺癌临床分期呈正相关,故认为其与病情严重程度相关。Messaritakis等[12]通过比较化疗前及化疗2周后乳腺癌患者的CYFRA21-1水平变化情况,发现当CYFRA21-1水平下降幅度>35%时,其与患者客观化疗效果显著相关,因此在化疗后检测CYFRA21-1并与化疗前比较,可预测患者对化疗的反应。本研究结果显示,晚期食管癌患者化疗后血清CYFRA21-1阳性率低于化疗前;化疗后,CYFRA21-1阳性患者的病死率高于阴性患者,这一研究结果与既往文献报道相一致[13]。
Sparano等[14]报道显示,CTCs阳性食管癌患者的5年总生存率在40%以下,显著低于CTCs阴性患者,认为CTCs阳性状态是食管癌患者总生存期和无进展生存期的独立预测因素。Neubauer等[15]通过Cellsearch检测CTCs在转移性食管癌患者中的表达情况,并分析CTCs与食管癌患者预后的关系,该研究结果进一步证实上述观点。大多数食管癌患者对放化疗非常敏感,但小部分患者可能无法耐受该治疗方案,为了给患者提供个体化的放化疗方案,需要及时的评估疗效,以确定患者是否适应该方案[16-18]。本研究结果发现,晚期食管癌患者化疗前CTCs阳性率在95%以上,化疗后CTCs阳性率下降至50%以下;化疗后,CTCs阳性患者的病死率为72.55%,明显高于CTCs阴性患者,这一研究结果与既往文献报道相一致[19]。可见连续监测食管癌患者CTCs表达情况,对于评估化疗效果及预后有重要的辅助意义。
搜检国内外文献发现,关于CYFRA21-1及CTCs检测对食管癌Kaplan-Meier生存分析的研究较少。本研究结果显示,CYFRA21-1及CTCs表达阳性的晚期食管癌患者半数生存时间均短于阴性患者。ROC曲线分析显示,二者联合检测评估晚期食管癌患者预后生存的AUC最大,其敏感度、特异度分别为88.65%、87.32%,均高于CYFRA21-1、CTCs单一检测。提示CYFRA21-1及CTCs可作为评估食管癌预后的重要标志物,同时可作为评估化疗效果的指标。但由于研究时间及条件的限制,本研究结果可能存在一定偏倚性,后续将开展大样本、前瞻性、长时间的研究,对本研究观点加以论证。
综上所述,CYFRA21-1及CTCs可评估晚期食管癌的化疗效果,二者与预后关系密切,可通过CYFRA21-1、CTCs联合检测评估患者预后情况。
