PEG介导的假禾谷镰孢菌GFP遗传转化体系的建立
2021-08-30闫佩瑶张莉王明玉于海涛于金凤
闫佩瑶,张莉,王明玉,于海涛,于金凤
(1.山东农业大学植物保护学院,山东 泰安 271018;2.潍坊市农业科学院小麦研究所,山东 潍坊 261041)
小麦茎基腐病(wheat crown rot)是一种典型的土传性真菌病害,在小麦整个生育期均可发病,后期出现枯白穗等症状,分布范围广、危害严重[1,2]。小麦茎基腐病由多种镰孢属真菌(Fusariumspp.)引起,因不同地区种植条件差异,引起该病害的主要致病菌也不同[3]。Burgess等[4]调查表明,假禾谷镰孢菌(F.pseudograminearum)为澳大利亚东部地区小麦茎基腐的主要致病菌。在意大利[5]、伊朗[6],其主要致病菌为黄色镰孢菌(F.culmorum)。近几年,我国也对小麦茎基腐病优势病原菌进行了相关报道。张向向等[7]发现黄淮地区病原菌主要由亚洲镰孢菌(F.asiaticum)和禾谷镰孢菌(F.graminearum)组成,且以亚洲镰孢菌种群为主。周海峰等[8]也对来自黄淮麦区多个省份的小麦茎基腐病株进行鉴定,发现禾谷镰孢菌占比最大,假禾谷镰孢菌次之。孟程程[9]采集山东小麦茎基腐病发病样本,结果表明,假禾谷镰孢菌占74.7%,是引起山东省小麦茎基腐病的主要致病菌。
荧光标记蛋白作为一类标记蛋白,被广泛应用于研究植物与微生物的相互作用以及在不同环境条件下检测微生物定殖情况等领域[10]。绿色荧光蛋白(green fluorescent protein,GFP)是一类在腔肠动物体内发现的生物发光蛋白[11]。Shimomura等[12]首先从水母(Aequoria victoria)中分离出GFP。此后,Prasher等[13]克隆了GFP基因的cDNA序列并对其构成进行了研究。之后Chalfie等[14]发现GFP能够在多种真核和原核生物中表达。自从GFP首次在大肠杆菌和线虫中被成功表达出来[13],又不断在其他异源生物中被表达出来[14-16],该蛋白便成为现代生物化学研究中最重要的工具。通过荧光蛋白标记病原菌,能够在荧光显微镜下清楚、直接地观察到病原菌菌丝和孢子位置,为病原菌的检测、侵染部位观察以及抗性植株的筛选提供了有效手段,具有广阔的应用前景[17]。基于此,本研究对假禾谷镰孢菌进行原生质体制备,优化PEG介导的假禾谷镰孢菌遗传转化方法,利用荧光显微镜进行假禾谷镰孢菌侵染小麦茎部观察,初步了解假禾谷镰孢菌侵染小麦过程,以期为小麦茎基腐病的防控提供参考。
1 材料与方法
1.1 试验材料
供试菌株:假禾谷镰孢菌WHF104、大肠杆菌DH5α,均由本试验室保存。
供试品种:济麦22。
供试质粒:pBARGPE1。
GFP扩增引物:5′-CACCTTGATGCCGTTCTTCTG-3′,5′-GGCAGTAAGCGAAGGAGAATGT-3′。
1.2 培养基
试验过程中所用培养基及配制方法如表1所示。

表1 试验所用培养基配制方法
1.3 试验试剂
CTAB抽提液:CTAB 4 g,0.5 mol/L EDTA(pH=8.0)8 mL,NaCl 16.36 g,ddH2O 200 mL,121℃高压蒸汽灭菌25 min。
0.5mol/L Tris-HCl(pH=8.0):Tris 30.25 g,ddH2O 400 mL,浓盐酸8 mL,冷却至室温,加浓盐酸至pH=8.0,去离子水定容至500 mL,121℃高压蒸汽灭菌25 min。
0.5mol/L Tris-HCl(pH=7.0):Tris 30.25 g,ddH2O 400 mL,浓盐酸20 mL,冷却至室温,加浓盐酸至pH=7.0,去离子水定容至500 mL,121℃高压蒸汽灭菌25 min。
50×TAE电泳缓冲液:Tris 242 g,冰醋酸54.1 mL,0.5 mol/L EDTA(pH=8.0)100 mL,去离子水定容至1 000 mL。
5 mg/mL肝素钠:肝素钠0.1 g,加去离子水至200 mL,过滤除菌,分装后-20℃保存。
50 mg/mL hyg B(hygromycin B):潮霉素B 2 g,加去离子水至10 mL,过滤除菌,-20℃保存。
40% SPTC:PEG-4000 40 g,STC溶液定容至100 mL,过滤除菌,-20℃保存。
原生质体酶解液:Driselase 250 mg,Lysing 50 mg,加0.7 mol/L的NaCl至10 mL,磁力搅拌器搅拌溶解,4 000 r/min离心6 min,吸取上清液,过滤除菌(现配现用)。
1.4 假禾谷镰孢菌原生质体的制备与GFP转化
1.4.1 假禾谷镰孢菌原生质体的制备 取活化好的假禾谷镰孢菌菌落边缘菌块于100 mL CMC培养基中,25℃、175 r/min培养5 d。用灭菌单层滤布过滤,收集滤液于离心管中,室温3 700 r/min离心7 min。弃掉上层离心液,并加入100 mL YEPD培养基,25℃、175 r/min振荡培养12 h。用灭菌三层擦镜纸过滤,收集菌丝并用氯化钾溶液清洗3次。用灭菌滤纸挤压干水分,并称取0.5 g加入灭菌的50 mL离心管中待用。加入酶解液,慢慢摇匀,30℃、100 r/min振荡培养2 h。灭菌滤布过滤后用氯化钾溶液洗净,收集滤液,10℃、4 000 r/min离心10 min。弃上清留沉淀,用氯化钾溶液重悬,4℃、4 000 r/min离心2 min。弃上清,加入1 mL STC溶液重悬,4℃、4 000 r/min离心2 min。弃上清,再用800μL STC溶液重悬,并缓慢加入120μL的40% SPTC溶液,冰上静置。
1.4.2 PEG介导的假禾谷镰孢菌原生质体转化将5μL肝素钠和75μL目的质粒溶液加入到上述产物中,冰上静置20 min。加入1/3体积(200μL)的SPTC溶液,轻柔混匀,于室温放置30 min。倒入50 mL无菌离心管中,并加入10 mL TB3培养液,室温静置2 h后,30℃、90 r/min揺培12 h。将其加入30 mL 45℃左右的Bottom Agar培养基中,并加入抗生素(Hyg B 50μg/mL,Amp 100μg/mL),倒板,25℃培养1 d后再在上面倒入Top Agar培养基,培养2~4 d后挑单菌落到含有潮霉素抗性的PDA平板上。
1.5 转化菌株总DNA的提取
采取CTAB法提取菌株DNA[18],采用GFP基因特异性引物进行扩增,扩增体系:模板DNA 1μL,2×Phanta Max Buffer 12.5μL,引物(100 μmol/L)各1μL,ddH2O定容至25μL。扩增程序:95℃3 min;95℃30 s,56℃30 s,72℃40 s,35个循环;72℃10 min。扩增产物采用1%琼脂糖凝胶电泳进行检测。
1.6 转化菌株遗传稳定性分析
用灭菌牙签挑取转化菌株外围菌丝至载玻片,并用移液枪吸取少量孢子至载玻片,加少量无菌水,荧光显微镜下观察菌丝及孢子的荧光情况。将获得的转化菌株PDA平板连续培养5代,转接到含有抗生素的平板上,荧光显微镜下观察菌丝及孢子。
1.7 转化菌株致病性测定
从转化菌株中随机挑选4个菌株接种到麦粒培养基上,25℃培养14 d后取出晾干。济麦22于培养皿中催芽3 d后播种于花盆中(底部直径15 cm),花盆中加入灭菌土,每盆播种10粒种子,每处理3次重复。在播种小麦种子周围每盆撒施两颗带菌麦粒,以接种野生型菌株作为对照。接种3周后调查病情指数。
灭菌土的制备:将土样杂质清除干净,再将两倍体积的土与一倍体积的基质混合均匀,分装到灭菌袋中,高温灭菌,冷却后备用。
1.8 转化菌株不同温度下对小麦侵染试验
将济麦22催芽3 d后播种,每盆10粒,每处理重复3次。将荧光蛋白标记假禾谷镰孢菌接种于麦粒培养基上培养。在播种小麦种子周围每盆撒施两颗带菌麦粒,分别放入10、15、20℃的光照培养箱中,除温度不同其他条件一致。对照不接种带菌麦粒。培养10 d后将麦苗连根挖出,保持根系完整,并用清水洗净。用体视荧光显微镜观察不同温度下假禾谷镰孢菌对小麦茎部侵染情况。
1.9 转化菌株不同天数下对不同包衣处理小麦侵染试验
供试种衣剂为酷拉斯(苯醚甲环唑、咯菌晴、噻虫嗪,三元复配,瑞士先正达作物保护有限公司)和奥拜瑞[戊唑醇、吡虫啉,拜耳作物科学(中国)有限公司],每100 kg种子用量均为300 mL。
选取籽粒饱满的济麦22种子,在播前3 d按照不同种衣剂要求的包衣比例对麦种分别进行包衣。每盆播10粒,每处理重复3次。在播种小麦种子周围每盆撒施两颗带菌麦粒,以无种衣剂包衣、接菌处理以及无种衣剂包衣、不接菌处理为对照。20℃光照培养,分别在7、14、21 d每处理取3株麦苗连根挖出,保持根系完整,并用清水洗净。在体视荧光显微镜下观察假禾谷镰孢菌在不同温度下对小麦茎部侵染情况。
2 结果与分析
2.1 假禾谷镰孢菌GFP转化菌株的验证
荧光显微镜观察结果(图1)表明,转化菌株的菌丝和孢子都能发出明亮的荧光,证明含GFP基因的载体成功转入假禾谷镰孢菌中,并可以正常表达(图1B、D)。将转化子在不含潮霉素B的PDA平板上连转5代,菌株仍可正常生长并表达荧光(图1F、H)。说明GFP基因的载体转入假禾谷镰孢菌后,能够稳定遗传表达。
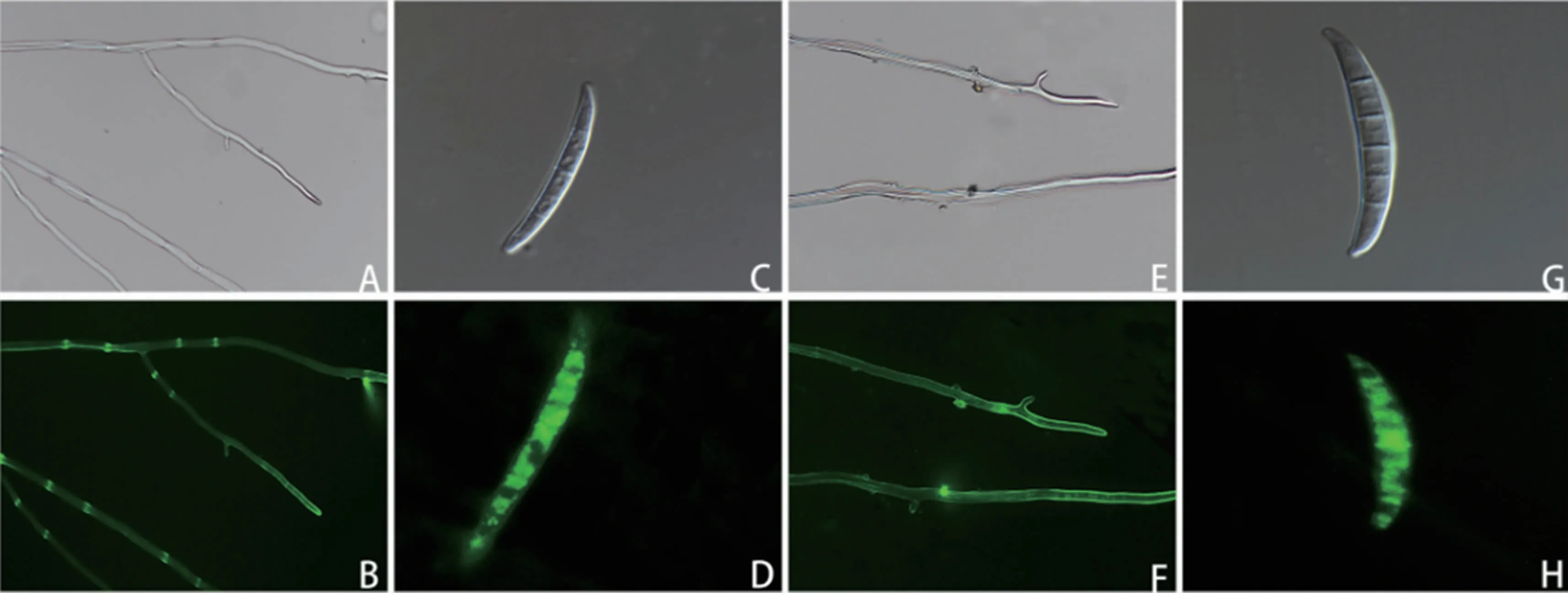
图1 绿色荧光蛋白标记的转化菌株菌丝及孢子的遗传表达
PCR检测结果(图2)表明,随机选取的5个转化菌株,以GFP特异性引物进行PCR扩增,均能扩增到目的条带(1 050 bp)。

图2 假禾谷镰孢菌转化菌株的GFP基因PCR检测
2.2 假禾谷镰孢菌GFP转化菌株致病性测定
随机挑选4个菌株进行致病性测定,由图3可以看出,转化菌株致病力与原始菌株相比无显著差异,小麦病情指数均大于50,说明含GFP基因的载体转入假禾谷镰孢菌基因组后,不影响菌株致病性。
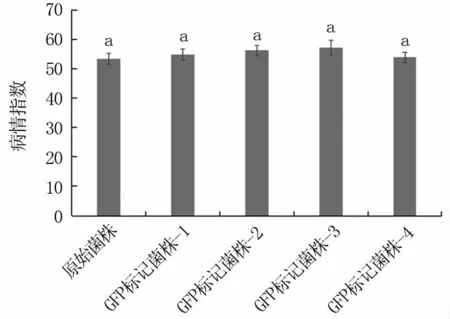
图3 转化菌株致病性测定
2.3 假禾谷镰孢菌不同温度下对小麦茎侵染的影响
由图4可以看出,培养10 d后,假禾谷镰孢菌在20℃光照培养条件下对小麦茎的侵染表达明亮荧光,在10℃和15℃光照培养条件下荧光微弱。表明温度为20℃时,有利于假禾谷镰孢菌的侵入,而在10℃和15℃则不利于病原菌的侵入。因此,可以适当推迟播期,从而降低小麦茎基腐病发病率。

图4 假禾谷镰孢菌不同温度下对小麦茎的侵染
2.4 种衣剂处理对假禾谷镰孢菌侵染小麦的影响
由图5可以看出,前3周假禾谷镰孢菌对酷拉斯、奥拜瑞种衣剂包衣处理小麦茎秆几乎不侵染,茎秆只表达微弱的荧光,与无种衣剂、不接菌的小麦茎秆荧光类似。而无种衣剂、接菌处理的小麦茎秆第7 d便表现出明亮的荧光,21 d后荧光更强烈。表明种衣剂包衣处理能有效阻止假禾谷镰孢菌在前期的侵入,从而降低小麦发病率。
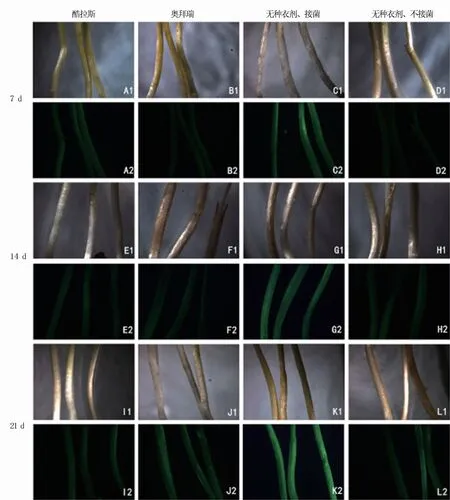
图5 不同种衣剂处理转化菌株在不同天数下对小麦茎的侵染
3 讨论与结论
近年来,假禾谷镰孢菌成为引起国内外小麦茎基腐病的重要致病菌[7]。缺乏抗病品种是小麦茎基腐病发生严重的重要原因[19]。当前对于假禾谷镰孢菌侵染小麦的过程和致病机制等并不完全了解,建立PEG介导的假禾谷镰孢菌遗传转化体系,为该病原菌致病相关基因的研究提供了一种高效便捷的方法,同时,探讨其侵染小麦的过程,也为小麦茎基腐病的防治提供了新思路。
适当推迟播期能减少病原菌侵染机会,在不影响冬前形成壮苗的前提下适当晚播,可防止冬前麦苗长势过旺、过早拔节从而遭受冻害导致小麦抗病能力下降,并在后期严重影响小麦的品质和产量。实际生产应从培育壮苗和防病增产两方面综合考虑,确定小麦播种时期[20]。本试验采用PEG介导的原生质体转化方法,对主要致病菌假禾谷镰孢菌进行荧光蛋白标记,结果表明,20℃更有利于假禾谷镰孢菌的侵入,而低温(10℃和15℃)则不利于病原菌的侵入。
药剂拌种不仅省时、省药、成本低,还能有效防治小麦幼苗被侵染,保证出苗安全[21]。本研究中发现假禾谷镰孢菌在前期很难侵入种衣剂包衣处理的小麦。表明播种前种衣剂包衣处理能够降低小麦茎基腐病冬前发病率,减少病原菌基数和来年被侵染概率。
