青蒿素耐药与脾脏清除疟原虫机制研究进展
2021-02-07王华晶姜廷良李沧海
王华晶,姜廷良,李沧海
(中国中医科学院 1.青蒿素研究中心、2.中药研究所唐氏中药研究中心,北京 100700)
青蒿素的低毒性与强大的抗疟活性,使其从上市以来一直是抗疟治疗的一线药物。由于疟原虫(plasmodium)对氯喹(chloroquine)、奎宁(quinine)等单一化学抗疟药物的敏感性逐渐降低,世界卫生组织(World Health Organization,WHO)推荐了以青蒿素及其衍生物为基础与其它抗疟药配伍使用的青蒿素联合疗法,简称为ACT疗法(artemisinin-based combination therap,ACTs),一般用药三日就可达到治疗效果,该方法可显著降低疟疾的死亡率[1]。
近些年,东南亚一些国家尤其是柬埔寨相继出现了经ACTs三日治疗以后,血液内仍存有疟原虫的病例。也就是疟原虫的清除时间延长,导致世卫组织在2005年的《全球耐药性报告》中对可能存在的青蒿素耐药性提出了担忧[2]。2007年,在柬埔寨拜林地区进行了一项研究,单用青蒿琥酯或采用青蒿琥酯与甲氟喹联用治疗疟疾患者,发现这两种治疗方法都会引起疟疾患者血液内的疟原虫清除时间延长。因此,提出了疟原虫对青蒿素类药物产生了耐药性。青蒿素耐药性的最新定义是[3]:青蒿琥酯单药治疗或ACTs治疗疟疾患者后,血液中疟原虫清除时间延长。但对“延长”机制尚缺乏足够的科学共识。
研究表明,恶性疟原虫13号染色体上的Kelch13编码基因(K13)的突变与疟原虫清除时间延长密切相关,这也被认为是引发疟原虫对青蒿素类药物产生耐药性的最主要原因。但也有研究发现,在东南亚的泰国、柬埔寨、老挝一些地区,疟原虫清除时间延长伴有K13突变,而在东南亚的缅甸、非洲的尼日利亚、刚果共和国等一些地区,疟原虫清除时间延长不伴有K13突变。即使是同时感染K13突变疟原虫的患者,在抗疟治疗过程中,疟原虫的清除时间也有很大差异[4]。上述研究提示,K13突变并非患者体内疟原虫清除时间延长的必要条件。
由于青蒿素及其衍生物的耐药概念与传统药理学的耐药定义内涵不一致,而疟原虫体内清除速率影响因素不仅与病原体自身改变有关,而且也涉及到宿主机体状态和处理能力相关。例如脾脏通过特异性孔蚀功能清除疟疾患者体内的疟原虫,在疟原虫的清除率中占很大比重,在用青蒿素及其衍生物治疗的脾功能正常患者体内,这一清除机制显得尤为重要。而对于脾切除患者,在用青蒿素及其衍生物治疗后,疟原虫的清除时间会明显延长,这一现象表明脾脏对于疟疾患者体内的疟原虫清除具有重要意义。但是脾脏对疟原虫的清除作用与ACTs治疗后出现的疟原虫清除时间延长即耐药有无相关性,目前尚不明确。此外,患者感染疟原虫后,机体会产生获得性免疫,免疫细胞产生的抗体可与裂殖子表面抗原结合防止裂殖子入侵红细胞;免疫因子调节或中和染虫红细胞,促进染虫红细胞自身的溶解作用,从而促进疟原虫的清除。这些功能主要由细胞色素IgG亚类,IgG1和IgG3介导[5]。同时机体的免疫器官脾脏依赖物理生化、免疫功能等同时发挥清除疟原虫的作用。因此,这里所说的青蒿素耐药(疟原虫的体内清除时间延长)与抗疟药物对疟原虫的杀伤作用、人体免疫细胞的调节作用、免疫器官的外排异物功能等具有密切关系。故本文就青蒿素耐药性相关机制研究与脾脏的滤过、免疫功能及脾脏对疟原虫的清除机制等进行综述整理,以期为疟原虫对青蒿素耐药性的研究提供新的思路和参考。
1 疟原虫基因突变及青蒿素耐药
恶性疟原虫K13(Pfkelch13)基因突变被认为是疟原虫对青蒿素类药物产生耐药性的主要原因。
疟原虫依赖于消耗染虫红细胞内的血红蛋白得以生长与繁殖,在消耗血红蛋白的过程中会产生一些血红蛋白降解产物,这些降解产物可激活青蒿素类药物从而发挥药物的杀虫功效。Birnbaum等[6]发现Pfkelch13和UBP1、AP-2μ、内吞蛋白Eps15等组成与吞噬宿主红细胞相关的内吞区室。Pfkelch13对于疟原虫摄取染虫红细胞内血红蛋白至关重要,该蛋白控制内吞作用水平,进而影响血红蛋白降解产物的浓度。如果Pfkelch13发生变异,血红蛋白降解产物的浓度降低,导致青蒿素类药物无法被充分激活并杀死疟原虫。
K13蛋白是Kelch类超家族的726个氨基酸成员,具有C末端六叶β-螺旋桨结构域、疟原虫特异性N末端结构域和BTB/POZ结构域。虽然在Pfkelch13中鉴定出两百多种非同义突变,但其中只有9种突变被证实具有体外抗逆转录病毒能力(F446I、N458Y/I、M476I/V、Y493H、R539T、I543T、P553L、R561H、C580Y)。在柬埔寨地区,C580Y、Y493H和R539T的突变最为普遍。在中缅边境,主要是F446I突变,其次是R539T、P574L、N458Y、R561H和A676D[7]。
2 脾脏结构与功能
脾脏位于机体腹部,在隔膜的正下方,是一个细长的暗红色器官,被一层纤维膜(支撑较大血管系统的结缔组织)包裹[8],与胃相邻,是机体最大的血液过滤器,可有效截留并清除血液循环中的异常红细胞,对于维持机体正常血液循环发挥很重要的作用。也是体内最大的次级淋巴器官,负责清除体内外来物质和衰老或受损的红细胞,同时引发血源性抗原的免疫反应。
脾脏包含红髓(red pulp,RP)与白髓(white pulp,WP)两个功能性区域,啮齿动物的这两个区域通过边缘区(marginal zone,MZ)连接,而人类通过滤泡周围区(perifollicular zone,PFZ)连接[9-10]。RP占脾脏的大部分,呈海绵状结构,充满着流经脾静脉窦(splenic sinus)和髓束(cords)的血液,该区域的主要功能是过滤血液和保护血液中的铁循环。WP占比不到脾脏的25%,却是脾脏的主要免疫功能区。
2.1 红髓的两条血液循环通路脾脏无输入淋巴管,因此所有细胞和抗原通过血液进入脾脏。动脉血通过脾动脉进入脾脏,脾动脉在脾脏有许多的中央小动脉分支,中央小动脉周围有包含T细胞区的动脉周围淋巴鞘(periarteriolar lymphoid sheaths,PALS)。PALS旁边是B细胞滤泡。PALS和B细胞滤泡一起构成脾脏的WP,WP被边缘区包围,动脉血通过毛细血管进入MZ。进入MZ的80%-90%的血液直接进入脾静脉窦,经过窦后微静脉,汇入脾静脉,这条通路称为快速闭合循环通路。MZ被滤泡周围区域(perifollicular zone,PFZ)包裹,血液流经PFZ后,一些血管终止,血液流入由PFZ和RP构成的慢速开放循环通路[11]。脾脏对血液的滤过作用就在这条通路中的RP中进行。
识别红细胞的大小、形状、变形性的改变是脾脏的特异性功能,红髓巨噬细胞(macrophages,MPs)对红细胞的这些改变具有高度灵敏性。当血液进入红髓以后流速减慢,血液会先与MPs、树突细胞(dendritic cells,DCs)等免疫细胞接触,MPs识别并摄取病原体和细胞碎片以及衰老的红细胞等,一些病原体可直接被MPs识别,但许多病原体首先需要经过“调理(opsonising)”,在此过程中,病原体表面被补体或其他脾源性调理素(促吞噬素,备解素)包裹,这些分子可与巨噬细胞上的受体相互作用,促使病原体被清除。
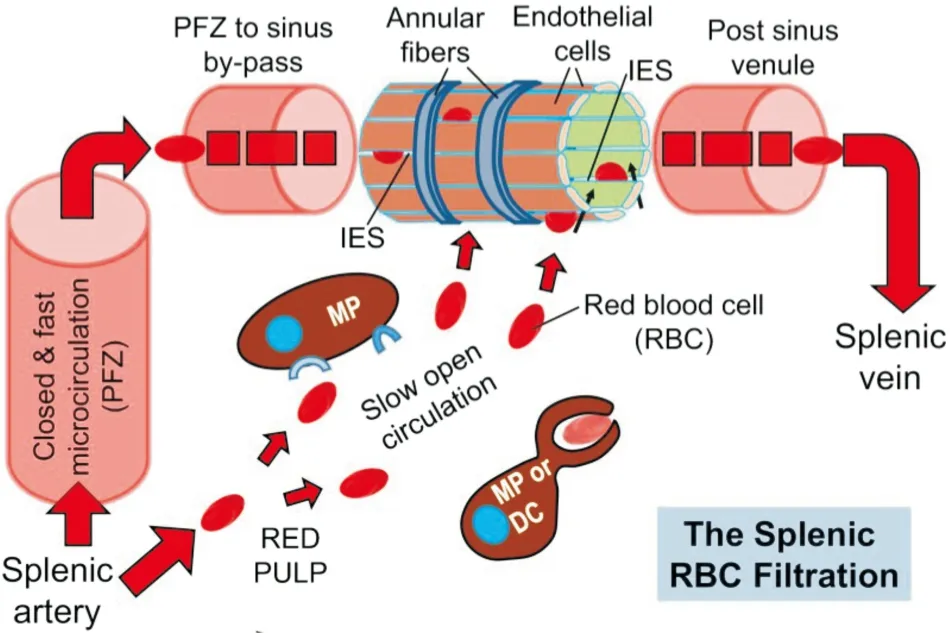
Fig 1 Diagram of two blood circulation pathways of spleen[12]
剩余血液要重回血液循环必须经过脾静脉窦。脾静脉窦是由内皮细胞衬里组成,平行定位并通过应力纤维连接到环状纤维,形成一个网状系统,应力纤维的收缩性允许在内皮细胞之间形成间隙,间隙平均长度和宽度分别为1.89 μm和0.65 μm,硬度是毛细血管的10倍[12]。剩余血液成分通过脾静脉窦的内皮细胞间隙返回血管内循环。红细胞与内皮细胞间隙之间不存在配体-受体相互作用,后者通过物理机械传感方式截留异常红细胞。红细胞通过该间隙时,因为压力,会发生挤压变形。正常红细胞的细胞表面面积变化范围在80-180 μm2,可变容积范围在60-160 μm3,具有良好的可变形性及恢复性,通过较窄毛细血管时,会发生子弹状的变形,通过内皮细胞间隙时会发生哑铃状变形,经过这两种通道后,正常红细胞都会恢复其原形,且正常功能不会受损。当红细胞膜表面积缺损程度≥18%,红细胞表面积/体积比值降低≥27%时,可变形性明显降低,无法正常通过内皮细胞间隙而被截留。正常红细胞在老化期间会发生表面积损失和可变形性降低。感染病原体的红细胞体积肿大,可变性降低而无法通过间隙被截留。
正常红细胞变形性强,可正常通过间隙并返回静脉系统。而变形性异常的红细胞会被截留,通过MPs或DCs的作用被清除。所以,脾脏在维持血液循环中的红细胞大小、形态的稳定性中发挥重要作用。
被截留的病原体或细胞碎片,被红髓巨噬细胞识别并清除。红髓巨噬细胞与血液单核细胞衍生的巨噬细胞相反,主要表达低亲和力受体FcγRIIa和FcγRIIIa。不表达抑制性FcγRIIb受体,而表达非常低水平的高亲和力受体FcγRI[13]。此外,红髓巨噬细胞吞噬并溶解异常红细胞后,可很好的回收来自红细胞的铁,促进铁的再循环。
2.2 白髓的免疫功能在脾动脉的中央小动脉分支周围存在T细胞区(也称为小动脉周围淋巴鞘,PALS)和B细胞区,这两个区域共同构成了脾脏的WP。WP是一个淋巴区域,与淋巴结的结构非常相似,没有血流,可启动机体适应性免疫应答。
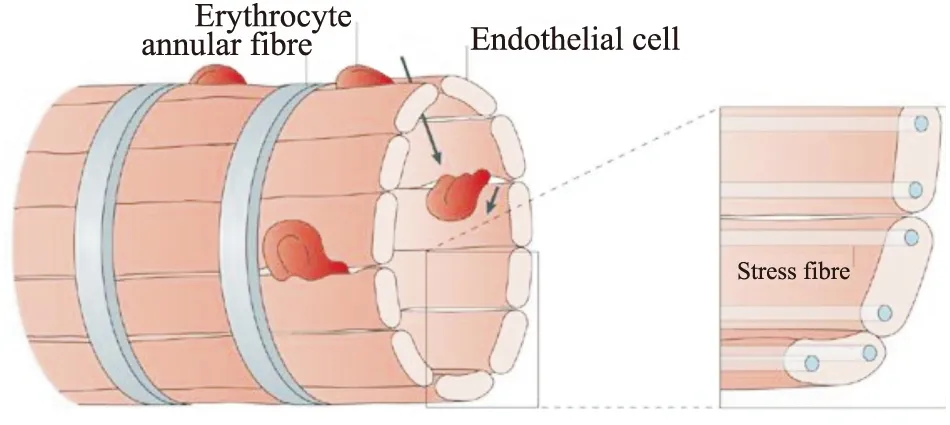
Fig 2 Splenic sinus
WP的功能与维持由特定的趋化因子控制,在淋巴细胞通过边缘区进入白髓时,这些趋化因子将T细胞和B细胞转移到各自的区域,从而在白髓中建立特定区域。CXC趋化因子配体13(CXC-chemokine ligand,CXCL13)将B细胞转移到B细胞区,CCL19和CCL21将T细胞和DCs转移到T细胞区。而且趋化因子受体及其配体对于T/B细胞区的细胞浓度至关重要,例如CC趋化因子受体7(CC-chemokine receptor,CCR7)的缺失会导致T细胞散乱的分布在脾脏中[14]。这些趋化因子的表达受淋巴毒素α1β2(LT-α1β2)和肿瘤坏死因子(TNF)的影响。当缺少通过LT-β受体(LT-βR)或TNF受体1(TNFR1)发出的信号时,脾脏中的稳态趋化因子CXCL13、CCL19和CCL21的水平降低,从而导致WP的解体。LT-βR和TNFR1均由抗辐射基质细胞表达,而它们的配体则由造血细胞表达。这些受体被结合后,核因子κB被激活,从而诱导了各种趋化因子的表达。CXCL13是由CD35 +卵形树突状细胞(follicular dendritic cells,FDCs)与FDCs相邻的基质细胞产生的,它对转移B细胞到B细胞区至关重要。T细胞区中基质细胞和DCs产生的CCL19和CCL21对T细胞的转移和储存也至关重要。在T细胞区的发育过程中,表达LTα1β2的B细胞是基质细胞充分表达CCL21所必需的[15]。
T/B细胞两个分区有利于对外来和自身抗原作出适当的免疫调节,B细胞遇到外来抗原首先在CXCL13、CCL19和CCL21等一系列趋化因子浓度梯度诱导下迁移至T、B细胞分界处,在该处T细胞的帮助下,B细胞进一步分化或返回B细胞区。B细胞区中含有对B细胞活化和存活至关重要的细胞混合物,返回该区域的B细胞大量增殖和分化,形成B细胞生发中心(germinal center,GC),生发中心是体液免疫应答过程中B细胞大量增殖、选择、消亡的场所。为响应同源抗原和T-依赖性B细胞生发中心的反应,脾脏中的幼稚细胞和中央记忆T细胞被激活,从而产生抗体。GC作为体液免疫功能单位,其形成依赖于T/B细胞区域边界的完整性[16]。
2.3 边缘区的免疫功能WP由先天免疫细胞组成的边界包裹,这个边界也称为边缘区(MZ)。边缘区域形成了先天性和适应性免疫应答之间的桥梁,MZ含有 MPs、DCs、B细胞辅助中性粒细胞(B cell-helper neutrophils ,NBH)、先天性淋巴细胞3型(innate lymphoid cells type 3,ILC3)、CD4+T淋巴细胞、MZ B细胞和记忆B细胞。该区域中表达特定模式识别受体的MPs可以有效地摄取血源性病原体。MZ B细胞可以被这些巨噬细胞激活,或者可以直接识别血源性病原体,之后它们变成抗原呈递细胞(antigen-presenting cells,APCs)或产生IgM的记忆细胞。IgM记忆B细胞是脾脏边缘区特有的细胞群,可产生天然抗体五聚体IgM,这类抗体能够直接或通过补体沉积在病原体的包膜上促进吞噬,切除脾脏后,机体IgM记忆B细胞减少[17]。
3 脾脏清除疟原虫的机制
3.1 免疫清除感染疟原虫的红细胞与脾脏免疫细胞的第一次接触发生在边缘区[18],边缘区的巨噬细胞和树突状细胞,具有摄取外来物质并将其呈递给辅助性T细胞的能力。由CD11c标记物标记的树突状细胞在疟原虫进入血液后5 d内从脾脏边缘区域迁移到CD4+T细胞区域。在同一时期,树突状细胞中激活T细胞所必需的CD40、CD54和CD86共刺激因子明显上调。这表明,脾脏树突状细胞在疟疾感染早期的脾脏免疫反应阶段发挥重要作用。
在疟疾感染期间,脾脏对疟原虫的过度反应会引起脾肿大。以前的研究表明,脾脏中的巨噬细胞参与免疫反应以对抗疟疾,在感染期间,脾脏中巨噬细胞的数量明显增加,这些巨噬细胞可以清除疟原虫或感染疟原虫的红细胞。巨噬细胞的大量聚集引起脾脏肿大,不仅促使感染红细胞的破裂,还会引发正常红细胞的破裂,造成机体的严重贫血。髓样相关蛋白(myeloid-related protein,MRP)8和MRP14由中性粒细胞和单核细胞表达,有研究表明MRP8+和MRP14+巨噬细胞的积累与各种炎症性疾病相关的病理变化有关,也被称为炎性巨噬细胞的标志物。Haruka研究感染伯氏疟原虫的小鼠发现,小鼠血清中MRP8和MRP14水平升高;感染疟原虫的d 7,小鼠脾脏明显增大,脾脏组织学分析显示是疟色素的沉积和单核细胞的积累引起,组织的免疫组化学染色显示是MRP8+和MRP14+的巨噬细胞的积累,表明疟疾期间的脾肿大与MRP8+和MRP14+巨噬细胞的积累有关。
哺乳动物的中性粒细胞存在一类表达TCRαβ组合受体的亚群(5%-8%)。有研究表明,感染伯氏疟原虫ANKA株的小鼠,在感染的早期阶段诱导脾脏中表达TCRβ的CD11b+Ly6G+中性粒细胞扩增。在感染后的d 3,表达TCRβ的中性粒细胞的比例与外周血的染虫比例具有显著相关性。此外,TCRβ+中性粒细胞吞噬染虫红细胞的效率比TCRβ-中性粒细胞高4倍。提示脾脏的中性粒细胞通过TCRβ表达,增强吞噬能力以影响疟原虫的感染率[19]。
3.2 孔蚀清除
3.2.1孔蚀的定义 早先发现脾脏可通过物理方式截留疟原虫,Schnitzer等1972年研究感染诺氏疟原虫(Plasmodiumknowlesi,Pk)的猴子,在未给药的情况下,利用电镜技术观察感染猴的脾脏切片,发现脾脏中有一部分染虫红细胞(iRBCs)从髓束通过静脉窦壁进入窦腔的过程中发生挤压变形,iRBCs的不含疟原虫的部分进入窦腔,含疟原虫的部分被截留在髓束,两者通过一条细长的茎条状物质连接。因为压力,连接两者的茎条容易断裂,断裂以后,截留在髓束的染虫部分被巨噬细胞吞噬;进入窦腔的部分恢复成“红细胞”,这种细胞被称为“曾经染虫红细胞”(O-iRBCs,也有称为含有环状期感染红细胞表面抗原的RESA-RBCs,本文均以前者名统称),并将这一过程称为“孔蚀(pitting)”,提出脾脏通过孔蚀清除血液中的疟原虫[20]。以后一些学者进一步佐证了Schnitzer等的发现,将“孔蚀”明确表述为:感染疟原虫的红细胞从髓束穿过静脉窦壁进入窦腔的过程中,红细胞内的疟原虫被截留而不破坏红细胞的形态,被感染过的红细胞可重新返回血液循环。
同时巨噬细胞和树突细胞的异质群体在红髓内形成吞噬网络,负责疟原虫残余物的清除工作。
3.2.2孔蚀的检测 在恶性疟原虫的裂殖子中存在一种颗粒,这些颗粒在裂殖子侵入红细胞以后被释放,并且沉积在染虫红细胞的细胞膜中,该颗粒被称为环状体感染的红细胞表面抗原(ring erythrocyte surface antigen,RESA)。RESA在疟原虫侵入红细胞以后,固定表达在红细胞膜表面,可充当疟原虫感染红细胞的足迹。
在人体脾脏的红髓,恶性疟原虫被挤出iRBCs以后,O-iRBCs会进入血液循环。利用疟原虫DNA与RESA双染色法区分iRBCs(RESA阳性、DNA阳性)与O-iRBCs(RESA阳性、DNA阴性),只有正常疟疾患者的血液涂片中能观察到RESA阳性DNA阴性的红细胞,在恶性疟原虫体外培养与脾切除患者的血液涂片中未发现RESA阳性DNA阴性的红细胞[21]。利用这种标记方法,可以更有效研究脾脏的孔蚀发生率。尤其是抗疟治疗前后或不同药物治疗后,孔蚀发生率之间的差异。
综上所述,骨关节结核在发生与发展的过程中,伴随着机体内多种细胞因子表达水平的变化,IL-15、MCP-1和TGF-β含量显著增高,提示其可能参与骨关节结核的免疫调节过程,但其具体机制尚未明确,有待深入研究。IL-15、MCP-1和TGF-β的表达水平有望成为骨关节结核的预防、诊断、病情监测及判断预后的重要临床参考指标。
但现阶段,只确证了恶性疟原虫固定表达在人体iRBCs膜上的蛋白,伯氏、约氏等其他种类疟原虫固定表达在iRBCs膜上的蛋白还有待进一步研究。
4 影响孔蚀的因素
众多实验表明,脾脏的孔蚀与疟原虫的生长周期、染虫红细胞膜的刚性(或称可变形性、柔韧度)、粘附性、渗透性、抗原性、微结构以及使用的抗疟药物有关。
4.1 疟原虫生长周期感染疟原虫的红细胞预先暴露于青蒿琥酯致死剂量中8-12 h,离体灌注人体脾脏。组织学分析发现不同的截留形式:① 环状体期的疟原虫被完全挤出iRBCs,宿主红细胞可进入脾静脉;② 早期滋养体的疟原虫一部分被挤出iRBCs,其余部分通过丝状或哑铃状仍与其宿主红细胞相连,但宿主红细胞已经发生挤压变形并通过了内皮细胞间隙。③ 晚期滋养体期iRBCs的柔韧性丧失,在通过内皮细胞间隙时,红细胞破裂或完全被截留。④ 裂殖体期的iRBCs被完全截留在红髓。
这一现象与疟原虫的生长周期有关。恶性疟原虫裂殖子侵入红细胞以后,在iRBCs中形成的液泡中经过环、滋养体及裂殖体期的变形阶段,最终红细胞破裂释放16-32个裂殖子。此循环需要48 h,在这个变化过程中,宿主红细胞的体积、柔韧性、粘附性和营养物质渗透性也会随之变化[22]。
4.1.1环状体期 环状疟原虫为单核,在iRBCs内呈变形虫形态,疟原虫体积<10 μm3,完全被iRBCs细胞质所包围,疟原虫与iRBCs之间没有联系膜,iRBCs的体积为92.6±5.1 μm3,此时iRBC细胞膜的柔韧性没有明显变化。
4.1.2滋养体期 滋养体阶段疟原虫扩大并变圆,iRBCs的表面变得不规则,疟原虫的细胞体和细胞核增大膨胀,在疟原虫的细胞质中形成含有血红蛋白晶体的消化液泡,扁平的顶质体存在于细胞核和消化液泡之间的线粒体附近,疟原虫体积≥10 μm3。同时染虫红细胞的表面开始出现突起(Knobs),这个突起是由Var多基因家族转录而成,在iRBCs的膜表面表达的一类高分子量、具有抗原多样性、由疟原虫编码的恶性疟原虫红细胞膜蛋白(PfEMP1;一个蛋白质家族的简称,含有多种略有差异的蛋白质群),不同结构的PfEMP1可以和不同的宿主受体结合,主要有CD36、细胞内粘附分子-1(ICAM-1)或血管内皮细胞。iRBCs的粘附性是在感染疟原虫的16 h后出现,疟原虫是在滋养体期开始表达PfEMP1,这也可以解释iRBCs的粘附性与PfEMP1的调节有关。疟原虫编码的骨架结合蛋白1(SBP1),是一种跨膜蛋白,位于疟原虫诱导的染虫红细胞细胞质内的Maurer′s 裂缝(MCs;国内将它称为“茂氏裂缝”或“茂氏裂”),该蛋白参与PfEMP1在红细胞表面的表达过程,这在染虫红细胞表达粘附性的过程中至关重要。单圆盘形的膜形结构(Maurer′s裂缝)分散存在于红细胞的细胞质中,但是不直接接触iRBCs膜和疟原虫液泡膜。iRBCs的体积为104.8±9.1 μm3。此时,iRBCs细胞的刚性增加。
在晚期滋养体阶段,iRBCs的体积进一步增大,由于疟原虫摄取了大量红细胞的营养物质,红细胞细胞质的体积会减小,疟原虫出现多个未分裂的核体,在消化液泡中会出现成簇的血红蛋白晶体。iRBCs膜表面的突起仍然存在,数量要比早期滋养体阶段多。而Maurer′s裂缝的数量逐渐较少。
4.1.3裂殖体期 在裂殖体阶段,疟原虫是多核且分裂的。疟原虫占据了iRBCs体积的大部分,在iRBCs表面有突出的球形突起,疟原虫的顶质体、线粒体也已完成复制,平分到每个裂殖子中。消化液泡被裂殖子包围,iRBCs的体积为101.1±8.5 μm3。此时的iRBCs已经完全失去其原生形态。
脾静脉窦的内皮细胞间隙平均长度和宽度分别为1.89 μm和0.65 μm。疟原虫自身柔韧性很差,一般无法正常通过内皮细胞间隙。正常红细胞具有典型的双凹圆盘形[23],具有很强的柔韧性。疟原虫处于早期环状体阶段时,iRBCs的形状和柔韧性与正常红细胞无明显差异,在经过脾静脉窦壁时,iRBCs内的疟原虫被挤出,O-iRBCs返回血液循环;随着疟原虫的发育,红细胞的双凹状逐渐变为球状[24],iRBCs的体积、刚性增加,可通过脾静脉窦内皮细胞间隙的iRBCs逐渐减少,滋养体、裂殖体更容易被脾脏隔离。由此可知孔蚀一般是发生在疟原虫的环状体时期[25]。
环状阶段的iRBCs没有粘附性,滋养体、裂殖体阶段的 iRBC的刚性和粘附性增加导致微血管系统的血液动力学阻力增加,这在疟疾的发病机制中发挥重要作用。
4.2 青蒿素类药物已有研究资料提示,不同抗疟药物对不同类型的疟原虫(如恶性疟、间日疟)对脾清除染虫红细胞,具有不同影响。就孔蚀的作用而论,Wojnarski[26]通过临床观察发现,口服以蒿甲醚-苯芴醇或双氢青蒿素-哌喹的复合疗法(ACT)的患者,孔蚀检出率高达55.8%,使用奎宁、甲氟喹、阿托伐醌-氯脈等非青蒿素类药物的孔蚀检出率均低于10%,认为青蒿素类药物在清除iRBCs过程中,具有孔蚀依赖性。
Chotivanich等[27]探讨青蒿琥酯和奎宁治疗急性疟疾患者血液中的疟原虫清除机制,发现两者既不降低iRBCs的可变形性,也不增加其抗体结合力,而且可提高孔蚀的发生率:在无并发症的疟疾患者接受青蒿琥酯治疗的24 h内,O-iRBCs数量显著升高,用奎宁治疗患者体内的O-iRBCs数量升高非常缓慢(7 d);在重症患者,接受青蒿琥酯治疗的数小时内O-iRBCs数量显著升高,接受奎宁的并不呈现。对于单纯性疟疾和儿童疟疾患者,青蒿琥酯治疗组的孔蚀发生率也大于奎宁治疗组。对于这一现象的推测可能是孔蚀主要发生在疟原虫的环状体时期,青蒿素类药物作用于疟原虫生长过程中的每个阶段,像奎宁、甲氟喹等非青蒿素类药物,主要是作用于疟原虫生长过程中的成熟阶段,对环状体时期的疟原虫药效不大。氯喹还可增加iRBC的刚性,降低iRBC在内皮细胞间隙的通过率。因此青蒿素类药物对孔蚀的影响更明显。
此外,严重疟疾患者出现的延迟性贫血与孔蚀发生率有关。严重的疟疾患者进行抗疟治疗时,红细胞大量死亡,一般在7 d以内会有贫血现象,表现为血红蛋白降低10%以上,延迟性贫血是指血红蛋白值的这个降低过程发生在开始治疗8 d后。统计分析这些病例,发现这些病例中,用青蒿琥酯进行治疗的患者居多,在21名用青蒿琥酯治疗的严重疟疾患者中有12名患者发生延迟性贫血,而且孔蚀率越高,患者更容易出现延迟性贫血。因此提出了青蒿琥酯会引发严重疟疾患者的延迟性贫血。对于这一现象的推测是,青蒿素类药物会升高孔蚀的发生率,使得更多的O-iRBCs返回血液循环,但是这些红细胞的细胞膜已经是受损的状态,利用高速成像流式细胞仪记录并分析正常RBCs、iRBCs和O-iRBCs的表面积发现,iRBCs的表面积大约是正常RBCs表面积的97.1%,O-iRBCs的表面积是正常RBCs表面积的91.1%,返回血液循环的O-iRBCs因为细胞膜受损严重,细胞内的血红蛋白等营养物质会外漏,寿命要比正常RBCs大幅缩短(正常RBCs平均寿命为1 027 h,O-iRBCs的平均寿命为183 h),虽然严重疟疾患者在用青蒿琥酯治疗初期不会发生贫血,但是8 d后,返回血液循环的O-iRBCs会大量死亡,所以贫血现象会延迟[28]。
一般认为,血液循环中的感染疟原虫的红细胞通过脾脏和吞噬细胞两大系统进行消除。Aogo等[29]通过伯氏疟原虫感染小鼠以及用氯屈膦酸盐脂质体耗竭吞噬细胞系统等实验,认为两大系统在清除血流中染虫红细胞的作用大体各占一半;而青蒿琥酯的作用主要抑制疟原虫的复制,对诱导清除的作用似乎不大。
综之,由于相关研究尚待深入,目前依然存在人类脾脏在疟疾中的作用是“过滤器”还是“庇护所”的不同议论[30]。但从已有临床和实验结果来看,脾脏通过免疫和物理等途径,在消除红细胞内的疟原虫上起着相当重要的角色。至于被截留在脾内的裂殖体和配子母细胞成为复燃的种子,尚缺乏足够事实依据。
5 小结与展望
ACTs三日疗法是疟疾的一线治疗方法,但近年出现ACTs治疗3 d后,血液内仍存有疟原虫的病例报道,由此提出把血液中疟原虫清除时间延长判断为疟原虫对青蒿素类药物产生了耐药性。但现阶段对“延长”机制尚缺乏足够的科学共识,揭示“清除时间延长”的真谛,有助于澄清对青蒿素耐药性问题的异议。疟原虫的体内清除速率不仅与疟原虫本身的变异、与抗疟药物的作用机制有关,还受人体免疫和吞噬细胞的调节作用、免疫器官的外排异物等功能的影响。其中人体最大的血液过滤器及次级淋巴器官脾脏就参与了机体清除疟原虫的工作。
脾脏通过特异性孔蚀这一物理过程截留血液中的疟原虫,结合红髓中免疫细胞特异性吞噬疟原虫和红细胞碎片这一生化过程加速清除血液中的疟原虫。孔蚀主要发生在疟原虫的环状体时期,处于滋养体期和裂殖体期的染虫红细胞会被完全截留在红髓中。青蒿素类药物作用于红内期疟原虫生长过程中的每个阶段,而非青蒿素类药物主要是作用于疟原虫生长过程中的成熟阶段,所以青蒿素类药物对孔蚀发生率的影响更大。
脾脏的血液滤过功能在机体清除疟原虫的过程中产生多大的贡献,还无法判断。脾脏红髓中的免疫细胞对被截留的染虫红细胞或疟原虫的识别方式,配体-受体的结合方式仍不清楚。截留在红髓中的疟原虫还有无复染的可能、疟原虫的“青蒿素耐药”这一说法与脾切除后引起的疟原虫清除时间延长之间的相关性有待进一步研究。青蒿素自身对脾脏功能有无影响,脾静脉窦的内皮细胞间隙在病理状态下的血液滤过机制如何改变还不清楚。研究这些问题可为了解脾脏清除疟原虫机制、脾脏对抗疟药物抗疟作用的贡献度提供科研基础;同时,也可为另一些以红细胞为寄主的其他人畜共患的病原体如牛羊的边虫病、犬巴贝斯虫病等的消除,提供借鉴。
