丹参酮II-A通过调控TLR4/IκBα/NFκB信号通路抑制LPS诱导的细胞炎症
2021-02-07侯道荣崔斯童
侯道荣,刘 振,崔斯童,马 骏
(1.南京医科大学医药实验动物中心,江苏 南京 211166;2.南京医科大学附属南京医院神经外科,南京市第一医院,江苏 南京 210006)
炎症通常被认为是对感染或损伤的防御反应,但是,如果过度或持续,它将导致多种炎症疾病,如败血症、关节炎、癌症、动脉粥样硬化和自身免疫性疾病的发生[1]。炎症的发病机制是一个复杂的过程,受细胞因子和多种促炎性因子的诱导,如前列腺素E2(PGE2)、一氧化氮(NO)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和肿瘤坏死因子-α(TNF-α)的调节[2]。在许多急慢性炎症性疾病中,过度产生的促炎症介质会进一步加重了炎症浸润和免疫反应[3]。因此,这些促炎性介质是开发抗炎药的重要靶点。
巨噬细胞广泛分布于体内,在炎症反应中起重要作用[4]。巨噬细胞通过模式识别受体(PPR)识别致病物质并利用促炎性因子(如IL-1β、IL-6和TNF-α)调节炎症反应[5]。脂多糖(LPS)是常用的巨噬细胞激活剂[6]。LPS是革兰阴性菌外膜的主要成分,其诱导的巨噬细胞的激活是TLR4介导的细胞内包含NFκB信号级联的结果[7]。研究表明[8],NFκB的激活可导致促炎性介质,如诱导型一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)、IL-1β、IL-6和TNF-α的释放。
丹参酮Ⅱ-A(Tan IIA)是从丹参中提取的脂溶性化合物。已证明Tan IIA在抗炎活性中起重要作用[9]。Tan IIA用于治疗各种炎症反应,如脂多糖诱导的THP巨噬细胞炎症骨肿瘤、动脉粥样硬化和心血管疾病的脊髓炎症[7];Tan IIA能有效抑制大鼠脑缺血/再灌注损伤模型中促炎细胞因子,包括肿瘤坏死因子(TNF)和白介素-6的释放[10]。本研究将探究Tan IIA对LPS诱导的RAW 264.7巨噬细胞炎症的具体的作用机制。
1 材料
1.1 细胞株小鼠单核巨噬细胞RAW 264.7细胞购自上海中科院细胞库。
1.2 药品与试剂Tan IIA(T4952,美国Sigma公司),使用DMSO 溶液配制;LPS(L2630,美国Sigma公司);DMEM 高糖培养基(11960044,美国Gibco公司)、胎牛血清(10099,美国Gibco公司)、青链霉素(15070063,美国Gibco公司)、L-谷氨酰胺(25030081,美国Gibco公司);TNF-α ELISA 检测试剂盒(EK0527,武汉博士德生物工程有限公司)、IL-6 ELISA 检测试剂盒(EK0411,武汉博士德生物工程有限公司);IL-1β ELISA检测试剂盒(AE58504HU,中国Abebio公司)、CCK-8试剂盒(OCPA(C)20132001,中国和元生物技术有限公司);蛋白检测试剂盒(23225,美国Thermo Fisher Scientific公司);ECL Western blot底物(35055,美国Thermo Fisher公司);MMP-2 兔单克隆抗体(ab92536,1 ∶1 000,英国Abcam公司)、MMP-9兔多克隆抗体(ab38898,1 ∶1 000,英国Abcam公司)、NF-κB 兔单克隆抗体(ab32360,1 ∶1 000,英国Abcam公司)、p-NFκB 兔多克隆抗体(ab28849,1 ∶1 000,英国Abcam公司)、TLR4兔单克隆抗体(ab22048,1 ∶1 000,英国Abcam公司)、IκB-α 兔单克隆抗体(ab32518,1 ∶1 000,英国Abcam公司)、p-IκB-α兔单克隆抗体(ab92700,1 ∶1 000,英国Abcam公司);GAPDH兔单克隆抗体(A19056,1 ∶1 000,中国Abclonal公司);羊抗兔IgG辣根过氧化物酶二抗(ab7090,1 ∶1 000,英国Abcam公司);羊抗鼠IgG辣根过氧化物酶二抗(ab97040,1 ∶1 000,英国Abcam公司)。
1.3 仪器全波长多功能酶标仪(美国PerkinElmer公司),迁移小室(美国Corning公司),二氧化碳培养箱(美国Thermo Fisher公司);光学倒置显微镜(德国Leica公司)。
2 方法
2.1 细胞培养将小鼠巨噬细胞RAW 264.7细胞以1×106/孔的密度接种于6孔板中。细胞培养基为DMEM完全培养基添加10% (V/V) FBS,1×105IU·L-1青霉素G,100 kg·L-1链霉素和2 mL谷氨酰胺。细胞于5% CO2,37 ℃培养箱中培养。取对数生长期细胞用于实验。
2.2 分组与干预RAW 264.7细胞以1 × 106/孔的密度铺于6孔板,铺板后d 2使用随机数字表法将细胞板分随机分为模型组(LPS)、干预组(LPS+Tan IIA)和对照组(DMSO)。LPS组,细胞加入1 mg·L-1LPS培养24 h;LPS+Tan IIA组,细胞加入Tan IIA(终浓度为10 μmol·L-1,Tan IIA溶于DMSO)培养2 h,随后加入1 mg·L-1LPS继续培养24 h;DMSO组,细胞加入等体积的DMSO培养24 h。所有实验重复3次。
2.3 细胞增殖测定RAW264.7细胞活力测定使用CCK-8试剂盒进行。各组细胞更换培养基后,按照CCK-8试剂盒说明书操作。RAW264.7细胞以每孔1 × 104的密度铺于96孔板中(设置6个复孔),并且使用DMSO、LPS、LPS +Tan IIA处理细胞。72 h的孵育期间,每24 h每孔加入10 μL CCK-8。使用酶标仪测定每孔450 nm的吸光度值(OD)。
2.4 细胞迁移测定将所有细胞培养试剂和迁移板放在37 ℃培养箱温育;待RAW264.7细胞培养至对数生长期,消化细胞,用PBS和无血清培养基先后洗涤1次,用100 μL无血清培养基悬浮细胞,计数,调整浓度为2×108·L-1;在迁移板下室(即24孔板底部)加入700 μL 含10%血清的培养基,上室加入100 μL细胞悬液,继续在孵箱培养24 h;用镊子小心取出迁移检测板,吸干上室液体,移到预先加入约800 μL甲醇的孔中,室温固定30 min;取出迁移检测板,吸干上室固定液,移到预先加入约800 μL Giemsa染液的孔中,室温染色20 min;轻轻用清水冲洗浸泡数次,取出小室,吸去上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞;用小镊子小心揭下膜,底面朝上晾干,移至载玻片上用中性树胶封片;显微镜下随机取9个视野计数,统计结果。实验组中迁移的细胞数除以对照组中迁移的细胞数,再乘以100%即为相对迁移率。
2.5 细胞炎性因子检测取对数生长期的RAW264.7 细胞,按5×105/孔接种于6孔板中培养24 h。待其贴壁后弃去上清液,加入试剂继续培养24 h,然后用1.5 mL离心管收集上清,按照ELISA试剂盒说明书步骤检测细胞上清液中IL-6、TNF-α、MCP-1和IL-1β的含量。
2.6 Western blot 检测使用Western blot检测各组细胞中信号通路相关蛋白MMP-2、MMP-9、NF-κB、p-NFκB、TLR4、IκB-α和p-IκB-α的表达。细胞匀浆后分离蛋白,用含1mmol·L-1PMSF的RIPA冰裂解缓冲液4 ℃孵育10 min,12 000g离心10 min。用Pierce BCA蛋白检测试剂盒检测蛋白浓度。然后用SDS-PAGE将同样定量的蛋白质分离并转移到0.2 μm PVDF膜上。在室温下用含3% (W/V) BSA的TBST缓冲液中封闭后,一抗4 ℃孵育过夜。用HRP标记的二抗室温孵育1 h。使用Pierce ECL Western blot底物检测蛋白。使用ImageJ软件定量,使用GraphPad Prism软件作图。
3 结果
3.1 Tan IIA对LPS处理的RAW 264.7细胞增殖的作用LPS能诱导RAW264.7的分化并且抑制RAW264.7的增殖[6]。为了评估丹参酮II-A对RAW 264.7细胞增殖活力的影响,我们使用不同浓度Tan IIA(0、2、5、10、15 μmol·L-1)对RAW 264.7细胞进行处理,培养24 h后,每孔加人10 μL的CCK-8试剂孵育2 h。酶标仪检测OD450值(Fig 1)。实验结果表明LPS明显抑制RAW 264.7细胞的增殖;和LPS处理组比较,Tan IIA(终浓度10 μmol·L-1)处理24 h对可明显逆转LPS对RAW 264.7增殖的抑制作用(P<0.05)。因此我们选择10 μmol·L-1Tan IIA用于后续实验。
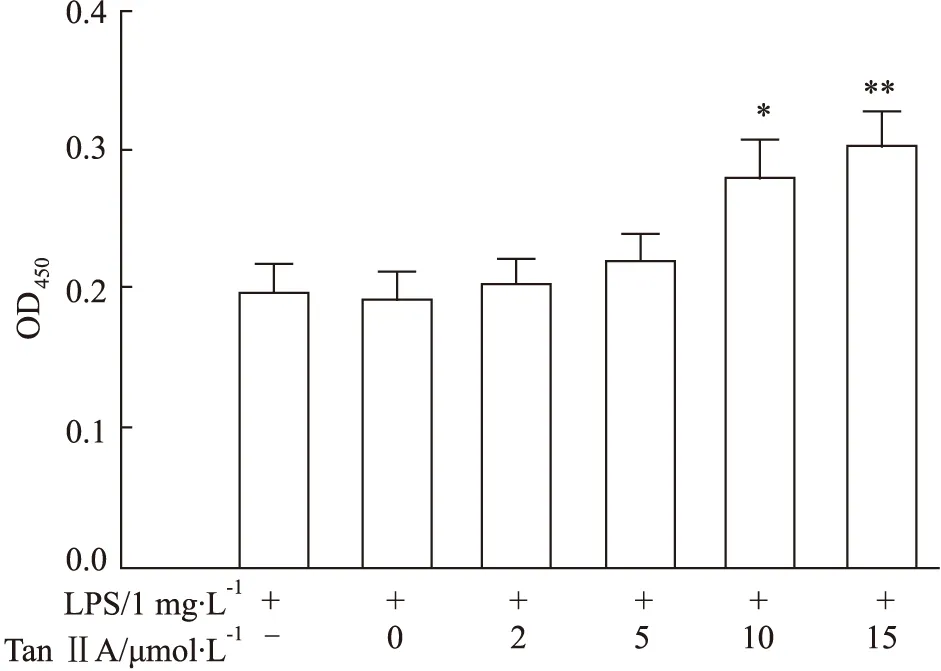
Fig 1 Effects of different concentrations of Tan IIA on RAW264.7 cell viability (,n=6)*P<0.05,**P<0.01 vs LPS group.
3.2 Tan IIA对LPS处理的RAW264.7细胞迁移的作用我们使用细胞迁移实验检测Tan IIA对LPS诱导的RAW264.7细胞迁移的作用(Fig 2)。实验结果表明,LPS处理明显增加了RAW 264.7细胞的迁移,和DMSO组比较,P<0.01(Fig 2A,B);Tan IIA处理可明显抑制LPS对RAW 264.7迁移的促进作用,和LPS组比较,P<0.01。
3.3 Tan IIA抑制LPS诱导的RAW264.7细胞炎症反应RAW264.7细胞培养基上清的4种主要的趋化因子和炎性因子(TNF-α、MCP-1、IL-6和IL-1β)使用ELISA方法检测(Fig 3)。结果表明,LPS诱导RAW264.7细胞炎性因子TNF-α、IL-6、IL-1β和趋化因子MCP-1明显增加,和DMSO组比较,P<0.01;Tan IIA处理可明显降低RAW 264.7细胞的炎性因子水平,和LPS组比较,P<0.01。这些结果表明,Tan IIA可以通过降低RAW264.7细胞炎性因子的产生来抑制LPS引发的炎症反应。
3.4 Tan IIA通过RAW264.7细胞炎性通路相关蛋白表达的影响我们使用Western blot方法检测Tan IIA对RAW264.7细胞炎性相关通路蛋白的表达(Fig 4A)。结果表明,与DMSO组比较,LPS诱导MMP-2和MMP-9的明显升高(P<0.05和P<0.01。而和LPS组比较,Tan IIA明显抑制LPS诱导的MMP-2和MMP-9的升高(P<0.05 和P<0.01)。各组细胞间NFκB和IκB的表达差异无显著性。LPS诱导p-NFκB、TLR4和p-IκB的明显提高,和DMSO组比较,P<0.01。Tan IIA明显抑制LPS诱导的p-NFκB、TLR4和p-IκB的升高,和LPS组比较,P<0.01。
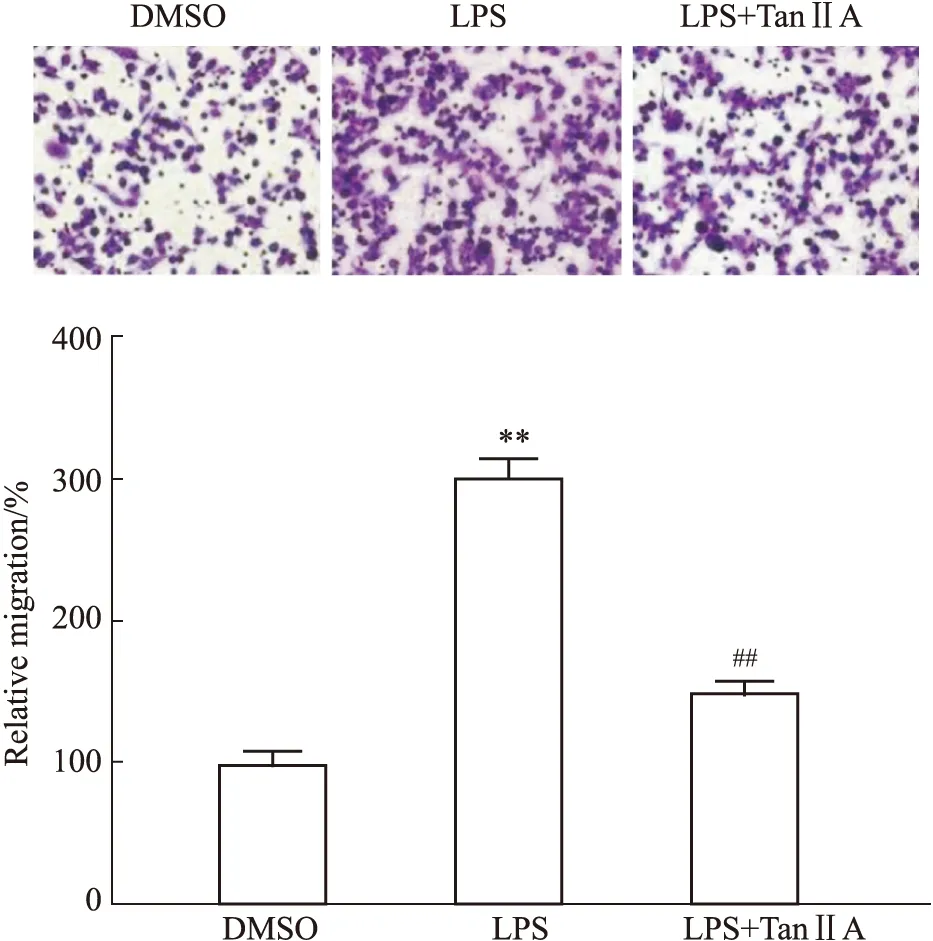
Fig 2 Tan IIA restored migration capacity of LPS-stimulated RAW264.7 cells (,n=6)**P<0.01 vs DMSO group;##P<0.01 vs LPS group.

Fig 3 Tan IIA treatment ameliorated inflammatory cytokine up-regulation in LPS-stimulated RAW264.7 cells(,n=6)The concentration of four inflammatory cytokines IL-1β (A),TNF-α (B),IL-6 (C) and MCP-1 (D) in RAW264.7 cells was examined by ELISA.**P<0.01 vs DMSO group;##P<0.01 vs LPS group.

Fig 4 Tan IIA inhibited protein expression of TLR4/IκBα/NFκB pathway and MMP-2,MMP-9 expression in LPS-stimulated RAW264.7 cells (,n=6)A:Western blot analysis of protein levels in DMSO,LPS or Tan IIA +LPS treated RAW264.7 cells;B:Data are shown as .*P<0.05,**P<0.01 vs DMSO group;#P<0.05,##P<0.01 vs LPS group.
4 讨论
小鼠巨噬细胞细胞系RAW264.7被认为是检测感染相关的促炎性介质最敏感和有效的模型[6]。它可以被LPS触发,作为研究炎症反应的经典模型。循环血单核细胞来源的巨噬细胞可参与炎症反应[11]。RAW264.7细胞是Abelson小鼠白血病病毒转化的巨噬细胞,是最常用的巨噬细胞实验模型,在巨噬细胞相关炎症信号通路的研究中发挥重要作用[3]。近年来,LPS诱导的RAW264.7细胞被广泛用于筛选有效的抗炎药物。因此,我们选择这一典型模型,探讨Tan IIA对LPS诱导的RAW264.7炎症反应的作用和机制。
Tan IIA是丹参的主要脂溶性成分之一,是一种众所周知的黄酮类化合物,对炎症反应有较强的抑制作用[12]。Tan IIA对动脉粥样硬化和相关炎症反应具有明显疗效[13]。此外,研究显示,Tan IIA能有效抑制大鼠脑缺血/再灌注损伤模型中促炎性细胞因子,包括TNF-α和IL-6等的释放[10]。最近的研究表明,Tan IIA可以减少博莱霉素和LPS诱导的大、小鼠肺的炎症细胞浸润、促炎性细胞因子释放和胶原沉积[14]。因此,Tan IIA被认为是一种很有前景的抗炎药物。在本研究中,Tan IIA能有效抑制LPS诱导的RAW264.7细胞活力的下降、细胞迁移和TNF-α、IL-6、MCP-1、MCP-9等炎性因子的释放和表达。
为了探究Tan IIA抗炎性作用的具体机制,本研究检测了RAW264.7细胞炎性相关蛋白的表达。Tan IIA 能抑制LPS诱导的MMP-2和MMP-9的高表达。单核细胞趋化蛋白酶(MMPs)可特异的降解细胞外基质的主要成分Ⅳ型胶原,对细胞的迁移、侵袭、活化及血管重塑等均起着重要作用[15]。MMP-2和MMP-9增多可使细胞基质膜成分降解,介导单核细胞等穿过血管,在降解的细胞外基质中游走,向靶器官浸润,促进炎症反应及组织损伤[16]。MMP对细胞的迁移、侵袭、活化及血管重塑等均起着重要作用。有研究显示,MMP-2和MMP-9高表达与卵巢癌的生长和侵袭转移密切相关。因此,本研究表明Tan IIA可通过抑制MMPs的表达来发挥抑制巨噬细胞RAW264.7细胞炎性的作用。
此外,LPS还诱导TRL4、p-NFκB和p-IκB的高表达,而这些可以通过Tan IIA治疗逆转。因此,我们可以推断Tan IIA通过抑制TRL4/IκB/NFκB信号通路发挥抗炎性作用。这表明,抑制RAW 264.7巨噬细胞IκB活化从而抑制NFκB信号通路,可调节LPS对炎症介质和细胞因子的诱导作用。研究表明,抑制NFκB活性,可改善类风湿性滑膜的炎症反应和组织破坏[2]。在结肠炎模型中,对NFκB的抑制可通过下调NFκB介导的促炎性细胞因子改善结肠炎症损伤[17]。TLR4是Toll样受体,是一种能够识别LPS与细胞表面的髓样分化因子2(MD2)的模式识别受体。TRL4被LPS激活后可磷酸化IκB-α,然后使NFκB磷酸化,从而使NFκB进入细胞核[18]。IκB-α磷酸化导致其降解并允许NFκB进入细胞核。NFκB的启动子活性主要是由核移位和NFκB磷酸化引起的。NFκB磷酸化激活导致细胞因子和炎症介质,如TNF-α、IL-1β、IL-6,MCP-1、MMP-9等的释放。
综上所述,本研究阐明Tan IIA可以通过调控TLR4/IκB-α/NFκB 炎症信号通路,抑制LPS诱导的炎症因子IL-6、IL-1β、TNF-α 和MMPs的表达来发挥抗炎活性,为抗炎性药物筛选提供了实验依据。
