MicroRNAs在肝纤维化进展中的作用
2021-02-07尤鸿美卜芳田孟宏武潘雪银张亚飞
尤鸿美,王 凌,卜芳田,孟宏武,潘雪银,张亚飞,王 傲,黄 成,李 俊
(安徽医科大学药学院,炎症免疫性疾病安徽省实验室,安徽 合肥 230032)
1 研究背景
肝纤维化是指当肝脏受到持续性慢性刺激后,以Ⅰ型胶原占据主导的肝脏细胞外基质(extracellular matrix,ECM)过度沉积在肝实质,最终导致肝脏结构紊乱的可逆性瘢痕修复过程[1]。病毒性和自身免疫性肝炎、饮酒、非酒精性脂肪性肝炎,导致铜或铁超载的代谢性疾病,毒素和胆道阻塞等是致使肝纤维化发生的常见病因。在肝脏中,活化的肝星状细胞(hepatic stellate cells,HSCs)、门脉成纤维细胞、骨髓来源的肌成纤维细胞前体以及上皮间质转化后的肝细胞等均是细胞外基质的生产细胞,其中活化的HSCs是生产细胞外基质的主要驱动力[2]。在正常生理条件下,HSCs处于静息状态,仅占肝脏总细胞数的5%-8%,存在于窦周间隙中并储存大量脂滴和维生素A,而当肝脏受到持续性慢性刺激时,损伤的肝细胞和定居在肝脏内的枯否细胞释放炎症因子诱导HSCs活化并分化为α-SMA阳性的肌成纤维样细胞。激活的HSCs会产生包括Ⅰ型和Ⅲ型胶原、纤连蛋白以及层黏连蛋白在内的细胞外基质成分,最终沉积在局部组织损伤部位。其中,窦周间隙过量的ECM会形成肝细胞与肝窦腔之间的一道物理屏障,导致肝细胞血流量减少,肝功能下降,进一步发展成为肝硬化,而目前肝脏移植手术是针对肝硬化的唯一治疗手段,却又局限于其并发症以及供体的缺乏。因此,现阶段,在肝纤维化尚未发展致肝硬化之前采取有效措施来逆转肝纤维化是唯一可靠的治疗方案。
MicroRNAs(miRNAs)是一类长度约22-25个核苷酸的单链RNA,由内源性发夹状转录本产生[3]。MiRNAs主要通过靶向mRNA的3′-非编码区(3′-UTR)来抑制mRNA翻译或促进其降解从而发挥调控生理和发育过程等作用[4],因此其自身的表达必须要受到严格精密的调控才能保证正常的细胞功能。MiRNAs表达谱的变化对多个生物过程有较大影响,如细胞分化、凋亡、代谢、以及内分泌等。而且miRNAs的异常表达常伴随有癌症、心脏疾病、肝脏疾病、肾脏疾病等病理的过程发生及发展。因此,miRNAs作为预后指标以及诊断标志物的潜在作用已被越来越多的研究和认识。本篇综述主要意在总结目前关于miRNAs调控HSCs活化与增殖在肝纤维化发生发展中的作用及其作为治疗靶点和生物标志物的潜在作用。
2 肝纤维化的发病机理
肝纤维化是一种由各种损伤因素持续作用在肝脏所引发的可逆转的瘢痕修复反应,其主要特征为ECM的过度沉积。如果患者没有得到及时有效的治疗,肝纤维化会进一步发展成为肝硬化,并伴随有一系列并发症,如肝功能丧失、门静脉高压、腹水、肝性脑病甚至肝细胞癌,因此肝纤维化已经成为全球重大卫生负担之一[5]。当明确致病因素时,一些抗病毒药物或免疫抑制剂可预防或减轻部分患者的肝纤维化,然而多数患者缺乏有效的治疗方法,最终导致肝硬化以及预后不良。肝纤维化的进展与细胞外基质的数量和成分密切相关,在正常肝脏中,细胞外基质的产量在合成与降解之间有着精密的调节,处于高度动态平衡状态,而在慢性肝损伤的过程中,合成的细胞外基质远远超过降解部分,并且其成分的改变也直接导致了肝纤维化的产生。健康肝脏中,ECM仅占肝脏组织切片相对面积的3%以及大约0.5%湿重,纤维化晚期阶段的肝脏含有比正常健康肝脏多6倍的细胞外基质,主要成分包括Ⅰ型胶原、Ⅲ型胶原、Ⅳ型胶原、纤维连接蛋白、波状蛋白、层粘连蛋白、弹性蛋白等。而增生性的肌成纤维细胞是过量ECM的主要细胞来源[6],例如,在肝、肾、肺等器官的慢性纤维增生性疾病中,肌成纤维细胞的存在是这类疾病重要的共同特征,它是一种收缩性极强的纤维母细胞样细胞,通常由间充质细胞系转分化而产生,这一过程成为“活化”。血小板衍生生长因子(PDGF),转化生长因子β(transforming growth factor-β,TGF-β)等旁分泌因子和别的一些生长因子、细胞因子、趋化因子等均会激活细胞增殖、迁移、细胞外基质蛋白分泌的信号通路,促进间充质细胞向肌成纤维细胞的转分化“活化”。已有研究发现,一些细胞群,如组织定居或骨髓来源的成纤维细胞、周细胞、上皮细胞等均可以转分化为肌成纤维细胞,在四氯化碳(CCl4)诱导的肝纤维化及胆管结扎导致的小鼠肝纤维化模型中,82%-96%的肌成纤维细胞均来自于HSCs的活化[7],也就是说活化的HSCs是肝内ECM的主要生产细胞。因此抑制HSCs的活化并诱导凋亡是治疗肝纤维化的关键[8]。20世纪70年代的早期临床报告表明晚期的肝纤维化也是可逆的,之后的大量研究进一步证实了该结论,并且发现肝纤维化的消退伴随有HSCs的凋亡、老化或转分化为失活态以及细胞外基质的降解。综上所述,在肝纤维化的治疗过程中,将HSCs作为治疗靶标,抑制其活化增殖,促进活化HSCs凋亡及衰老或诱导其转化为失活的状态来减少活化HSCs数量和ECMs的沉积量是治疗肝纤维化的重要手段。
3 MiRNAs的生物合成与作用机制
MiRNAs 是一类内生的,由19-24个核苷酸组成的短序列非编码RNA分子,保守性较高。MiRNA 的生物合成过程需要较多步骤的加工程序,首先RNA聚合酶Ⅱ在基因组的不同区域转录的初级转录物为几百个核苷酸分子长度的原始miRNAs (pri-miRNAs),pri-miRNAs又在RNaseⅢ家族酶-Drosha的作用下被加工成70nt含发夹结构的前体miRNAs (pre-miRNAs),其中发夹结构的3′端向外突出两个核苷酸,一个为5′磷酸,另一个为3′羟基,这是RNaseⅢ的经典产物,随后输出蛋白-5识别到发夹二核苷酸突出信号,并将pre-miRNAs转运到细胞质。在细胞质中,pre-miRNAs的5′磷酸、3′突出以及茎环部位被RNaseⅢ家族酶-Dicer酶识别并结合,Dicer是一种“分子标尺”,可以将pre-miRNAs裂解为特定长度的双链miRNA,其中一条链最终形成成熟的miRNAs,并与RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)结合形成miRNAs核酸蛋白复合体发挥作用,另一条链则被降解。MiRNAs指导RISC于转录后水平下调目的基因的表达有两种沉默机制:若mRNA与miRNA可以完全互补,那么该mRNA则会被RISC特异性降解掉;若两者不能完全互补,那么mRNA就不会被降解,RISC则会阻止mRNA作为翻译模板从而抑制蛋白质的生物合成[9]。
4 MiRNAs在肝纤维化中作用的最新研究
多年研究表明,大量miRNAs通过调节HSCs的活化,增殖,凋亡以及衰老等过程而参与肝纤维化的发生发展阶段,因此通过调节miRNAs的表达水平进而调控HSCs的活化状态最终实现对肝纤维化的治疗作用将为肝纤维化的治疗提供新的潜在治疗方案。
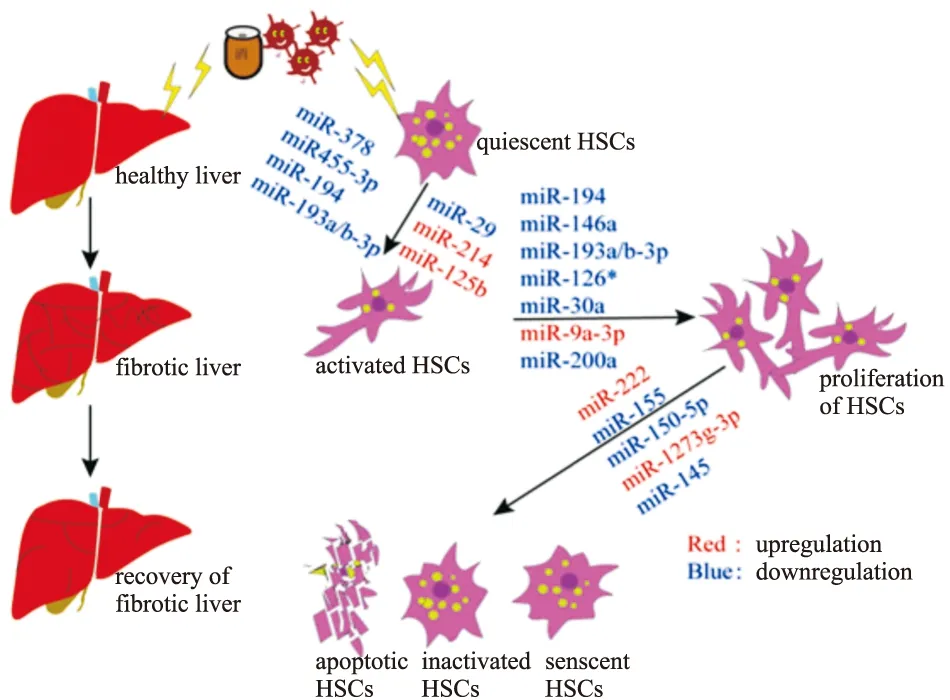
Fig 1 The regulatory effects of miRNAs on HSCs in progression and reversal of liver fibrosis
4.1 MiRNAs对HSCs活化及相关信号通路的调节正常的健康肝脏中,HSCs处于静息状态,当炎症或慢性刺激损伤肝脏时,TGF-β及PDGF等炎性细胞因子会以自分泌或旁分泌的形式作用于HSCs,进而诱导其活化。而HSCs的活化是早期肝纤维化发生发展的中心事件,因此,抑制HSCs的活化有利于肝纤维化的逆转恢复。近期,关于肝纤维化进展中HSCs与miRNAs之间的相互作用相继被报道。
大量文献已经报道miRNAs与HSCs的活化增殖及相关通路相关,Hyun等[10]研究发现miR-378家族(miR-378a-3p,miR-378b以及miR-378d等)在CCl4诱导的小鼠肝纤维化模型以及TGF-β诱导激活的HSCs中表达量显著下降,并且能够通过靶向转录因子Gli3抑制HSCs的活化,过表达miR-378a-3p可减少Gli3和其他促纤维化基因的含量但是HSCs失活指标胶质纤维酸性蛋白的表达显著增加。Wei等[11]通过微阵列分析发现,miR-455-3p在TGF-β诱导的HSCs活化过程中表达下调,并且在CCl4,高脂喂养以及胆管结扎所致的3种小鼠肝纤维化模型中,miR-455-3p表达水平也明显降低,进一步的功能学探究发现miR-455-3p可通过与热休克蛋白1(Hsp1)的mRNA3′-UTR结合,抑制Hsp47/TGF-β/smad4信号通路最终抑制HSCs的活化。Wu等[12]报道miR-194在人肝纤维化组织及激活态HSCs中表达含量下降,高水平的miR-194可通过靶向蛋白激酶AKT2来减少HSCs中α-SMA、COL1α1表达从而致使HSCs失活,以及通过阻滞细胞周期从而抑制HSCs增殖,减缓肝纤维化进程。此外,研究者发现miR-193a/b-3p在con-A诱导的小鼠肝纤维化中表达下降,用慢病毒载体系统过表达miR-193a/b-3p后,小鼠肝纤维化症状明显减轻[13]。MiR-29已被报道也是在肝纤维化中呈现下调状态并具有抗纤维化功能的小RNA,TGF-β则能通过下调miR-29并激活HSCs以及促进ECM的沉积加重肝纤维化症状[14]。Kwiencinski等[15]发现在活化的HSCs中敲低miR-29可增加血小板衍生生长因子-B、胰岛素样生长因子-Ⅰ等促纤维化基因的表达。
近几年,逐渐增多的研究表明,异常表达的miRNAs水平可能预示着肝纤维的不良预后。Ma等[16]通过对静息态和活化态HSCs进行芯片分析,发现miR-214在活化HSCs中表达明显上调,并且体外过表达miR-214后发现HSCs活化增多并且促纤维化基因和ECM等明显增加,而miR-214发挥这一效应可能是通过抑制Hedgehog信号通路的负性调节因子Sufu的表达。为了深入探究其临床功能,miR-214拮抗剂被注射进肝纤维化小鼠中,研究结果发现miR-214敲除组小鼠体内Sufu表达增加,肝纤维化症状也显著减轻。You等[17]发现,miR-125b在肝纤维化进展期其含量在活化HSCs而非肝细胞中明显上调,体内外抑制miR-125b后,导致HSCs活化被抑制,肝纤维化进程也被显著延缓,深入进行机制研究发现,miR-125b可能是通过直接靶向Stard13来增强RhoA的活性,最终增加α-SMA表达水平和HSCs收缩性能。
4.2 MiRNAs对HSCs增殖及相关信号通路的调节研究发现HSCs增殖与miRNAs之间有着密不可分的关系,何等[18]报道miR-146a的表达在不同浓度TGF-β刺激的HSCs中呈现剂量依赖性下调,而当向HSCs中转染miR-146a模拟物后,TGF-β诱导的HSCs的增殖则被明显抑制。Du等[19]报道Wnt1和Wnt5a是miR-146a-5p的直接靶点,miR-146a-5p可能通过Wnt/β-catenin信号通路抑制HSCs增殖和胶原沉积等。Ju等[13]研究发现,在con-A诱导的肝纤维化模型中miR-193a/b-3p表达下调,相关的机制研究表明miR-193a/b-3p可以通过直接靶向CAPRIN1和TGF-β2,抑制细胞周期相关蛋白Cyclin D1及Cyclin E1的表达,从而抑制HSCs的增殖,肝纤维化症状减轻。MiR-126*在活化的HSCs中含量明显下降,过表达miR-126*后,可明显抑制TGF-β诱导的HSCs增殖并伴随血管内皮因子的表达下调[20]。在CCl4诱导的大鼠肝纤维化模型中,miR-30a在原代HSCs中表达明显下降,过表达miR-30a则可通过抑制上皮间质转化过程,使HSCs活化和增殖减少,α-SMA、COL1α1表达下降。Qi等[21]报道,miR-9a-3p在HSCs中过表达可明显降低其潜在靶基因Sirt1的表达,上调miR-9a-3p可促进HSCs的增殖,迁移以及活化。Sun等[22]报道在TGF-β1诱导的活化HSCs以及CCl4诱导的小鼠纤维化肝脏中,miR-200a表达水平下调。进一步的研究表明miR-200a,可通过靶向TGF-β2和β-catenin,来抑制TGF-β和wnt/β-catenin信号通路,从而抑制HSCs增殖,减缓肝纤维化进程。
4.3 MiRNAs对HSCs凋亡及相关信号通路的调节HSCs凋亡常常发生在肝纤维化逆转阶段,因此促进HSCs的凋亡将有助于肝纤维化病理的恢复。Ogawa等[23]报道miR-222在人类肝纤维化进程中表达量增加,并且在LX-2细胞中,miR-222的表达与α-SMA,COL1α1呈现相同趋势,进一步研究发现,miR-222可以与细胞周期蛋白依赖性激酶抑制剂-1B(CDKN1B)的3′UTR区结合,抑制下游靶蛋白,促进表达NF-κB,最终抑制HSCs的凋亡。Dai等[24]报道miR-155在肝硬化患者的血清和肝脏组织以及活化HSCs中含量下调,在体外实验中,增加miR-155含量后可显著抑制上皮间质转化过程及细胞外调节蛋白激酶1信号通路并诱导HSCs凋亡。Chen等[25]报道在肝纤维化进展中,miR-150-5p呈现出细胞特异性表达模式,即在肝细胞中表达升高,但是在HSCs中表达下降。过表达miR-150-5p可促进HSCs凋亡,而干扰素信号通路的介入可能是miR-150-5p诱导HSCs凋亡的机制之一。
在HSCs内促凋亡基因BAX和抗凋亡基因BCL2表达量的失衡,是致使HSCs凋亡的重要因素。Niu等[26]报道miR-1273g-3p在丙型肝炎病毒导致的肝纤维化病人的血清及肝组织中含量显著升高,当向LX-2中转染miR-1273g-3p模拟物时,细胞凋亡被明显抑制,同时细胞增殖也明显增加,而当miR-1273g-3p被抑制时,促凋亡基因BAX,BAD,cl-caspases3,cl-caspases9等表达水平升高,但是抗凋亡基因BCL-2表达水平下降,结果表明抑制miR-1273g-3p可促进HSCs凋亡进而阻止或逆转肝纤维化进程。进一步的下游靶标探究发现miR-1273g-3p可能是通过PTEN/AKT信号通路来发挥抗纤维化作用,这一研究为肝纤维化的治疗提供了新的途径。
4.4 MiRNAs对HSCs衰老及相关信号通路的调节生物体内的多数细胞都要经历分化、去分化、衰老、死亡等过程,其中衰老是多种刺激因素引起的细胞反应。当细胞进入衰老状态时,其形态会发生较大变化,失去进入细胞周期的能力,并停滞再G0/G1期,增殖能力显著降低,最终导致细胞永久性生长停滞[27],而当活化的HSCs停止增殖进入衰老状态以后,ECM分泌明显减少并且ECM降解酶的水平显著增加。Kong等[28]研究表明,通过诱导HSCs衰老,肝纤维化病理进程明显缓解。杨俊发等[29]在实验中探究发现miR-145在小鼠肝纤维化组织以及活化的HSCs中表达均表现为下调趋势,p53作为经典的细胞衰老调控基因,当其缺失时,HSCs衰老减少,最终导致肝纤维化恶化情况,而p53启动子可以被ZEB1/2调节,因此杨等[29]研究发现miR-145可通过靶向ZEB2以p53依赖性方式促进活化的HSCs衰老,最终减轻肝纤维化进程,该发现可能为临床肝纤维化的治疗提供一种新的治疗方案。
5 结论及展望
慢性病毒和代谢紊乱、酒精滥用等因素引起的进行性肝纤维化疾病平均每年可导致100万人死于肝硬化,但针对抗纤维化的药物迄今为止尚未被研究出世。活化的HSCs是分泌细胞外基质的肌成纤维细胞的主要细胞来源,而HSCs的活化、增殖和凋亡以及老化是肝纤维化发生和缓解的关键环节。因此,对HSCs进行细胞靶向药物治疗将成为治疗肝纤维化的重要手段。大量miRNAs对HSCs的生物学功能调控的研究证实,部分miRNAs表达谱对HSCs的活化、增殖和凋亡及衰老等具有靶向调控作用,从而促进或减缓肝纤维化进程,表明miRNAs对于肝纤维化的预防、诊断、治疗及预后等具有较大的潜力,并可能作为未来药物治疗的靶点,具有非常广阔的研究前景。
