海蓬子皂苷甲调控SHP/STAT信号通路抗肝癌的研究
2021-02-07管福琴王奇志李林蔚佟海英
管福琴,单 宇,陈 雨,王奇志,李林蔚,佟海英,冯 煦,
(1.江苏省中国科学院植物研究所/中山植物园,江苏省植物资源研究与利用重点实验室,2.江苏省中国科学院植物研究所/中山植物园,江苏省农业种质资源保护与利用平台,江苏 南京 210014)
自2000年以来,肝癌的发病率和致死率出现明显的上升态势,成为威胁人类健康的重要因素[1]。信号传导与转录激活因子(signal transducer and activator of transcription,STAT)参与调控肿瘤的细胞凋亡、增殖分化、血管新生、侵袭转移和免疫逃避,其中STAT3和STAT5的研究最多[2]。临床研究发现,60%左右的肝癌组织中存在p-STAT3高表达,且其与肝癌的病理分级和临床分期相关[3]。含 SH2结构域的蛋白酪氨酸磷酸酶(SH2-containing protein tyrosine phosphatase,SHP)属于非受体蛋白酪氨酸磷酸酶家族,是许多信号通路的负性调节因子。已有研究证实,SHP-1和SHP-2可使STAT3蛋白705位酪氨酸残基去磷酸化从而抑制STAT3信号传导,并在多种肿瘤中发挥作用[4]。在抗肿瘤药物研究中,天然产物取得了显著的疗效。海蓬子皂苷甲(bigelovii A,BA)是一种30-降齐墩果烷型五环三萜皂苷,该化合物是本课题组前期从海蓬子中分离并鉴定得到的[5]。研究结果表明,BA能够促使人乳腺癌细胞MCF7和人白血病细胞HL-60发生细胞凋亡[6-7],诱导MCF7细胞发生保护性自噬[8],同时BA还具有治疗脂多糖引起的急性肺损伤的潜力[9]。本研究以人肝癌HepG2细胞为研究对象,探讨BA抑制肿瘤细胞增殖、诱导细胞凋亡的作用,及其对STAT和SHP信号通路的影响,为开发利用海蓬子奠定理论基础。
1 材料
1.1 细胞人肝癌HepG2细胞,购于中国科学院典型培养物保藏委员会细胞库。
1.2 试剂BA,纯度>98%,由本课题组分离得到;胎牛血清,兰州荣晔生物科技有限责任公司;DMEM培养基和蛋白酶抑制剂,Thermo Fisher Scientific公司;胰蛋白酶、噻唑蓝四唑蓝(Thiazolyl blue tetrazolium bromide,MTT)、放射免疫沉淀法(Radio immunoprecipitation assay,RIPA)裂解液、预染蛋白Marker等均购自碧云天公司;白介素6(interleukin-6,IL-6),Peprotech公司;过钒酸钠Sigma公司;碘化丙啶(propidium iodide,PI)染色试剂盒,美国BD公司;抗体和ECL发光液,美国Cell Signaling公司。
1.3 仪器二氧化碳培养箱(Thermo 6500,美国Thermo公司)、生物安全柜(NapFLOW 1200,美国Thermo公司);离心机(5804R,德国Eppendorf公司);荧光倒置显微镜(IX51,日本Olympus公司);酶标仪(Infinite M200,美国Tecan公司);流式细胞仪(Accuri C6,美国BD公司);化学发光仪(5200Multi,天能)。
2 方法
2.1 细胞培养HepG2细胞置于含10%胎牛血清的DMEM培养基中,在37 ℃、5% CO2的培养箱中培养。
2.2 细胞存活率测定将处于对数生长期的HepG2细胞以5×107个·L-1密度接种于96孔培养板,每个孔100 μL。然后用BA(5、10、20、40 μmol·L-1)处理,每组设置3次重复。24、48、72 h后,向各孔中加10 μL MTT(5 g·L-1),培养箱中孵育4 h后弃去上清,加入DMSO振摇10 min,用酶标仪测定OD570。
通过细胞增殖抑制率公式,计算出细胞增殖抑制率:
细胞生长抑制率/% =(1-实验组OD值/细胞对照组OD值)×100%
2.3 PI单染法定量检测细胞凋亡取对数生长期细胞6×105个接种于6孔板,用BA(10、20、40 μmol·L-1)处理细胞24 h,并用PBS洗涤。随后收集细胞,然后边振摇边滴加70%预冷乙醇,共1 mL,4 ℃固定过夜。3 000 r·min-1、5 min,离心收集细胞。加500 μL PI重新悬浮细胞,37 ℃ 培养箱避光染色15 min,流式细胞仪检测、分析。
2.4 Western blot法检测STAT和SHP信号通路蛋白的表达取对数生长期细胞按照5×105个/孔接种于6孔板,CO2培养箱中过夜培养。检测STAT3和STAT5蛋白表达时,次日用IL-6刺激细胞15 min,加入不同浓度的BA(10、20、40 μmol·L-1)处理5 h或用20 μmol·L-1BA处理1、2、4、6、8 h。检测是否有磷酸酶参与时,次日用过钒酸钠(25、50、100 μmol·L-1)和20 μmol·L-1BA同时处理HepG2细胞5 h,再用IL-6刺激细胞15 min。检测SHP-1和SHP-2蛋白表达时,次日用20 μmol·L-1BA处理0.5、1、2、4、6 h。然后均提取细胞总蛋白并检测蛋白浓度,SDS-PAGE电泳后将蛋白转移到PVDF膜上,封闭液封闭1 h,一抗4 ℃ 孵育过夜,二抗室温孵育1 h后,ECL发光液显色,于化学发光仪中扫描。
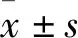
3 结果
3.1 BA诱导HepG2细胞凋亡以HepG2细胞作为人肝癌细胞的模型,研究不同浓度的BA(5-40 μmol·L-1)作用不同时间(24、48、72 h)对HepG2的细胞毒作用。结果显示,随着BA浓度的增加,细胞抑制率逐渐上升,且呈现很好的时间依赖关系(Fig 1)。PI单染检测结果显示(Fig 2),20和40 μmol·L-1BA作用HepG2细胞24 h,sub-G1峰的比例升高,与对照组相比,有明显差异,表明细胞产生了凋亡。
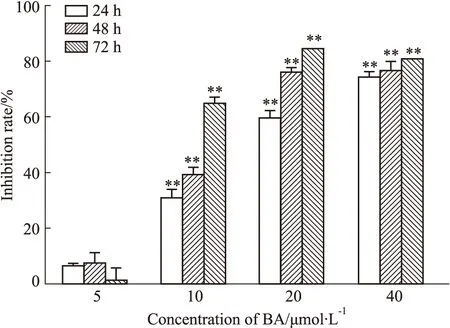
Fig 1 Cell growth of HepG2 cells inhibited by BAHepG2 cells were treated with 5,10,20 and 40 μmol·L-1 BA for 24,48 and 72 h,and then subjected to MTT assay.**P<0.01 vs control.
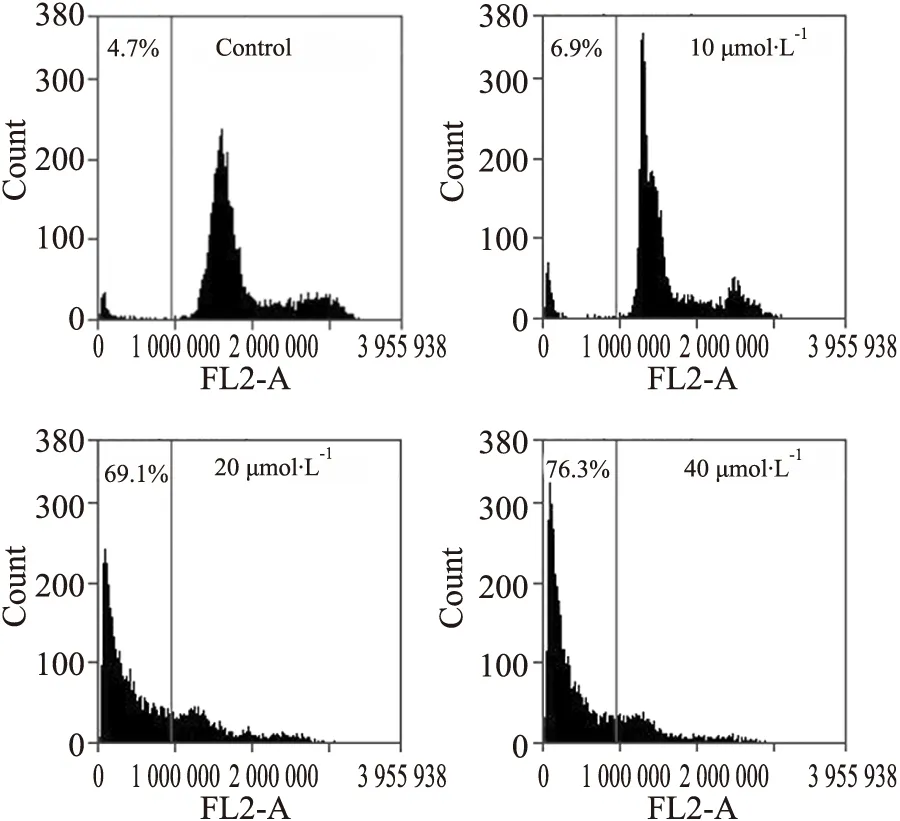
Fig 2 Apoptosis of HepG2 cells induced by BAHepG2 cells were treated with 10,20 and 40 μmol·L-1 BA for 24 h,after which the cells were analyzed for DNA content by flow cytometry.
3.2 BA抑制STAT3和STAT5磷酸化激活IL-6是一种细胞生长因子,能使细胞中STAT3和STAT5磷酸化激活。如Fig 3所示,25 μg·L-1的IL-6刺激HepG2细胞15 min,可诱导p-STAT3 和p-STAT5表达,其中p-STAT3表达更高;采用10、20、40 μmol·L-1BA作用5 h后,BA可同时抑制IL-6诱导的STAT3和STAT5的磷酸化;而采用20 μmol·L-1BA作用1、2、4、6、8 h后,BA时间依赖性地抑制了IL-6诱导的STAT3和STAT5磷酸化。对于STAT3的磷酸化,BA作用6 h后效果明显;对于STAT5的磷酸化,仅作用1 h即可抑制,作用6 h几乎完全抑制。

Fig 3 IL-6-induced activation of STAT3 and STAT5 suppressed by BA A and C:HepG2 cells were treated with 10,20 and 40 μmol·L-1 BA for 5 h.B and D:HepG2 cells were treated with 20 μmol·L-1 BA for various lengths of time.After induced by IL-6 for 15 min,whole-cell extracts were processed for Western blot analysis.
3.3 BA抑制SHP-1和SHP-2BA单独作用HepG2细胞显著抑制了IL-6诱导的STAT3的磷酸化,但当BA与酪氨酸磷酸酶抑制剂过钒酸钠同时作用HepG2细胞后,BA对STAT3磷酸化的抑制作用被过钒酸钠逆转(Fig 4A)。以上结果提示BA可能激活了酪氨酸磷酸酶,从而抑制STAT3的磷酸化。SHP-1和SHP-2是酪氨酸磷酸酶,参与调控STAT3蛋白去磷酸化。Fig 4B结果表明,20 μmol·L-1的BA作用HepG2细胞0.5 h,即可激活SHP-1和SHP-2的表达,且SHP-2的激活时间能够持续4 h。该结果表明BA通过激活SHP-1和SHP-2,从而使p-STAT3表达下降。
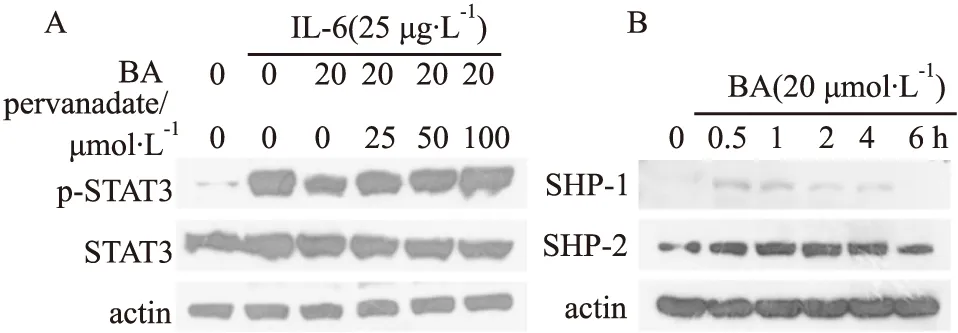
Fig 4 SHP-1 and SHP-2 in HepG2 cells activated by BA A:HepG2 cells were pretreated with 25,50,100 μmol·L-1 sodium pervanadate and 20 μmol·L-1 BA for 5 h,then induced by IL-6 for 15 min,after which whole-cell extracts were processed for Western blot analysis.B:HepG2 cells were pretreated with 20 μmol·L-1 BA for various lengths of time,after which whole-cell extracts were prepared and analyzed for SHP-1 and SHP-2.
4 讨论
五环三萜皂苷在自然界种类繁多,分布广泛,资源丰富。近年来研究发现,一些五环三萜皂苷具有很好的抗肿瘤作用,呈现多部位、多环节、多靶点的特点[10]。本研究以人肝癌 HepG2 细胞为研究对象,探讨五环三萜化合物BA抑制细胞增殖、诱导细胞凋亡的抗肿瘤效应。MTT 实验结果表明,BA对人肝癌 HepG2 细胞增殖有显著的抑制作用;流式单染凋亡检测发现BA能够诱导HepG2 细胞出现亚二倍体峰,具有剂量依赖性。上述结果表明,BA通过诱导细胞凋亡发挥抗肿瘤效应。
STAT 活化表达于肝脏肿瘤细胞中,参与调控肝脏肿瘤的形成、增殖、侵袭、转移等诸多环节,是若干致癌信号转导过程的汇合点,与恶性肿瘤的发生及发展密切相关[2]。白介素6(IL-6)是一种细胞生长因子,可诱导STAT3信号通路的激活,促进细胞的恶性转化[11]。一些已知的植物来源的天然化合物可有效抑制STAT3的激活,如熊果酸[12]、吴茱萸碱[13]、牛蒡子苷元[14]。本研究结果显示,随着BA浓度增高,IL-6活化的p-STAT3、p-STAT5 蛋白的表达量明显减少,说明BA可能是通过下调STAT 信号通路中 STAT3、STAT5的表达,诱导肝癌细胞凋亡的。
我们进一步发现,BA抑制STAT3和STAT5的作用涉及蛋白酪氨酸磷酸酶(PTP)。许多PTPs与STAT信号相关,包括SHP-1、SHP-2、T-cell PTP、PTEN、PTP-1D、CD45、PTPe[15]。SHP-1和SHP-2可以负调控JAK/STAT信号通路[16]。本研究发现,BA刺激SHP-1和SHP-2蛋白表达增加与STAT3、STAT5磷酸化下调相关。除了蛋白酪氨酸磷酸酶,STAT3激活负调控也通过其他机制,这些机制包括SOCS、PIAS、泛素依赖的蛋白酶体降解和Smad4[17]。这些抑制蛋白是否参与BA诱导的STAT3去磷酸化需要进一步研究。
综上所述,BA通过激活SHP-1/SHP-2,下调STAT3/STAT5信号传导途径,从而诱导肝癌细胞凋亡。另外,SHP-1/SHP-2 和STAT3/STAT5轴参与调节肝癌细胞凋亡这一项发现,完善了对肝癌发病机制的理解,提供了肝癌治疗的潜在靶点。
