金刚藤对人肝癌SMMC-7721细胞自噬相关蛋白LC3的影响
2020-11-13周芬敏文一惠凌江红郭锦荣陈珺明
周芬敏,文一惠,凌江红,3,郭锦荣,陈珺明
(1.上海健康医学院附属周浦医院,上海 200021;2.广西医科大学第一附属医院,广西 南宁 530021;3.上海中医药大学附属曙光医院,上海 200021)
金刚藤为百合科植物菝葜Smilax chinaL.的块茎,具有利湿去浊、祛风除痹、解毒散瘀的功效,临床上常用于治疗盆腔炎、类风湿关节炎、腰腿痛等疾病。近年来,药理学研究证实金刚藤具有抗多种肿瘤的作用[1-2]。本课题组前期研究表明,金刚藤能够促进肝癌细胞凋亡,从而发挥抗肝癌的作用[3]。自噬是细胞为维持自身稳态的一种通过细胞内溶酶体途径降解的过程,通过自身降解受损的细胞器或错误折叠蛋白,为细胞提供能量。自噬与肿瘤细胞关系密切,适当自噬能够为肿瘤细胞提高能量,促进细胞生长及增殖,而过度自噬则会启动细胞自噬性死亡[4],微管相关蛋白轻链3(LC3)参与了自噬体的形成[5]。本研究通过观察金刚藤对自噬相关蛋白LC3 的影响,初步探讨金刚藤对肝癌细胞自噬的影响,为金刚藤的抗肿瘤机制提供新的科学依据。
1 实验材料
1.1 药材 金刚藤(产自广西,批号:161201),由桂林鼎康中药饮片有限公司提供。
1.2 动物及细胞株 SPF级SD雄性大鼠16只,鼠龄8~10 W,体质量160~200 g,购自上海十指生物科技有限公司,动物合格证号:SCXK(沪)2018-0004。大鼠适应性喂养7 d后用于实验,喂养期间大鼠自由进食及饮水。人肝癌SMMC-7721细胞株由上海中科院细胞库提供。
1.3 主要试剂 DMEM 培养基、青链霉素双抗混合液(美国GIBCO 公司);胎牛血清(美国GIBCO 公司);Apoptosis Detection Kit(上海翊圣生物科技有限公司)。
1.4 仪器设备 二氧化碳培养箱(美国Thermo 公司);高速低温离心机(美国Sigma 公司);蛋白电泳仪(美国Bio-Rad公司)。
2 方 法
2.1 金刚藤水煎液的制备 取金刚藤饮片200 g,加入水至高出药面2~3 cm,浸泡2 h,武火煮沸后,改用文火煎煮30 min,冷却后,过滤取药液,滤渣如上法再煎2 次,混合3 次药液,浓缩成100 ml,即药物浓度为2 g/ml,置于4 ℃备用。
2.2 含药血清的制备 将16 只大鼠随机分为空白对照组、金刚藤低剂量组(JGT-L 组)、金刚藤中剂量组(JGT-M 组)和金刚藤高剂量组(JGT-H 组),每组4只。金刚藤低、中、高剂量组大鼠分别以金刚藤水煎液 0.5 g/ml、1 g/ml、2 g/ml 灌胃,每次 4 ml;空白对照组大鼠每天给予等量生理盐水灌胃;各组均每天灌胃2 次,间隔 12 h,连续给药 3 d。末次给药 1 h 后,大鼠予CO2窒息处死,心脏取血,静置,离心15 min取血清,过滤、灭活除菌,-80 ℃冻存备用。
2.3 细胞培养 将复苏存活下来的SMMC-7721细胞置于10 cm 细胞培养皿中,细胞接种106个/板,培养基为DMEM+10%FBS+1%双抗,于37 ℃、5%CO2恒温恒湿的细胞培养箱中培养。1~2 d 换液传代1 次,待细胞进入对数生长期后进行实验。
2.4 CCK-8 法检测各组细胞增殖的抑制率 取对数生长期SMMC-7721 细胞,用DMEM 培养液调整细胞浓度为 1×105个/ml,加入 96 孔培养板,每孔 0.1 ml,37 ℃、5%CO2培养箱中过夜,待细胞贴壁约70%~80%时,弃去细胞培养液,按上述实验分组方法分别加入相应含药血清,空白对照组及金刚藤低、中、高剂量组分别给予空白血清、金刚藤含药血清(0.5 g/ml、1 g/ml、2 g/ml)0.2 ml,培养48 h后行CCK-8实验,每组重复 6 个副孔,每孔分别加入 10 μl 的 CCK-8 溶液,继续再置于37 ℃、5%CO2培养箱中孵育3 h。用酶标仪在450 nm 波长处测定各孔的光密度值(OD 值)。按以下公式计算细胞增殖抑制率(IR):IR=(1-实验组OD值均数/对照组OD值均数)×100%。
2.5 Western Blot检测各组LC3-Ⅰ、LC3-Ⅱ的表达 金刚藤含药血清培养SMMC-7721 细胞48 h,PBS 漂洗,分别提取细胞总蛋白定量后,取20 μg的等量蛋白样品,12%SDS-PAGE进行凝胶电泳,后将蛋白转移至醋酸纤维膜上。5%脱脂牛奶室温封闭1 h,PBST洗膜3次,每次5 min,加入一抗LC3-Ⅰ、LC3-Ⅱ(均1∶1 000),4 ℃孵育过夜。TBST 洗膜3 次,每次5 min,加入羊抗鼠IgG(1∶50 000)37 ℃孵育2 h,PBST 洗膜3 次,每次 5 min。采用Oddsey 扫描仪扫描保存图片,用Image J软件对目的条带进行灰度值计算。以目的条带(LC3-Ⅰ、LC3-Ⅱ)与内参条带(β-actin)的总灰度值之比为标准评价结果,即目的蛋白的相对表达量=目的蛋白灰度值/内参灰度值。
2.6 统计学处理 采用SPSS 21.0 统计软件进行分析,计量资料以均数±标准差(±s)表示,采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结 果
3.1 各组细胞增殖抑制率比较 见表1。
表1 各组细胞增殖抑制率比较 (±s)
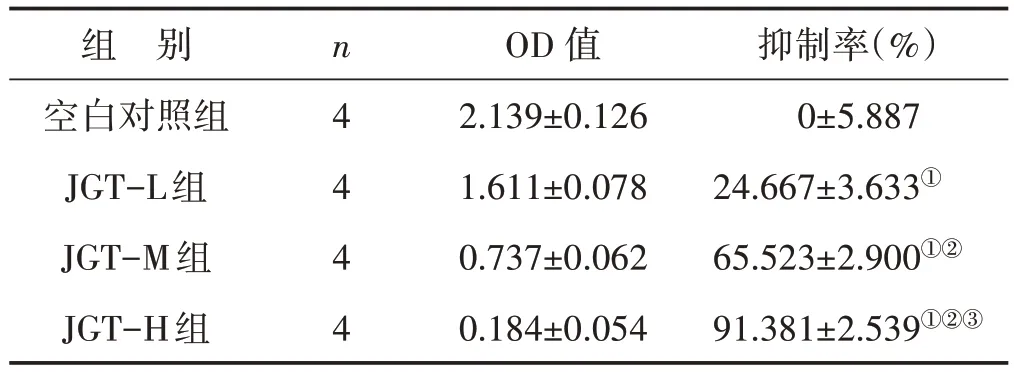
表1 各组细胞增殖抑制率比较 (±s)
注:与空白对照组比较,①P<0.05;与JGT-L 组比较,②P<0.05;与JGT-M组比较,③P<0.05
组 别空白对照组JGT-L组JGT-M组JGT-H组n 4 4 4 4 OD 值2.139±0.126 1.611±0.078 0.737±0.062 0.184±0.054抑制率(%)0±5.887 24.667±3.633①65.523±2.900①②91.381±2.539①②③
表1结果显示,与空白对照组比较,金刚藤各剂量组对人肝癌SMMC-7721 细胞株的抑制率均显著增加(均P<0.05);与JGT-L 组比较,JGT-M、JGT-H 组对人肝癌SMMC-7721 细胞株的抑制率均显著增加(均P<0.05);与 JGT-M 组 比 较 ,JGT-H 组 对 人 肝 癌SMMC-7721 细胞株的抑制率显著增加(P<0.05)。显示金刚藤高剂量组抑制率最高,抑制作用与浓度呈正相关。
3.2 各组细胞LC3-Ⅰ、LC3-Ⅱ、LC3-Ⅱ/LC3-Ⅰ相对表达量比较 与空白对照组比较,金刚藤各剂量组LC3-Ⅰ蛋白相对表达量无显著性差异,金刚藤各剂量组LC3-Ⅱ蛋白相对表达量均显著升高(均P<0.05),LC3-Ⅱ/LC3-Ⅰ比值均显著升高(均P<0.05)。结果见表2及图1。
表2 各组细胞LC3-Ⅰ、LC3-Ⅱ、LC3-Ⅱ/LC3-Ⅰ相对表达量比较 (±s)
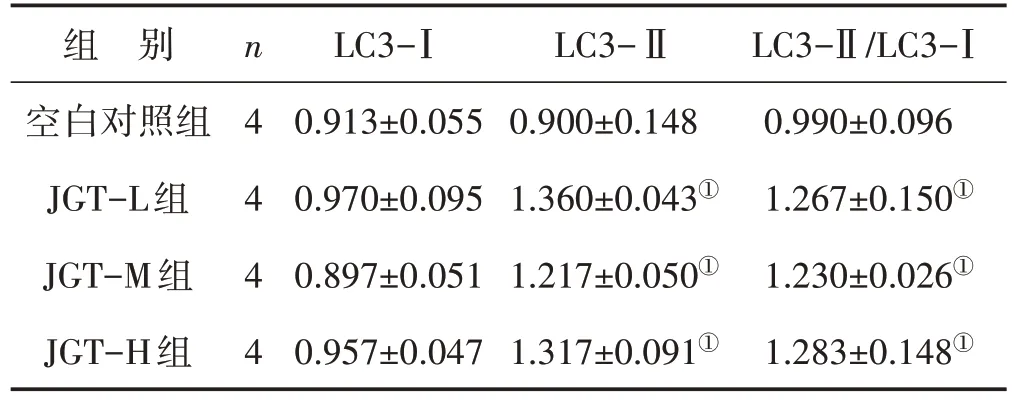
表2 各组细胞LC3-Ⅰ、LC3-Ⅱ、LC3-Ⅱ/LC3-Ⅰ相对表达量比较 (±s)
注:与空白对照组比较,①P<0.05
组 别空白对照组JGT-L组JGT-M组JGT-H组n 4 4 4 4 LC3-Ⅰ0.913±0.055 0.970±0.095 0.897±0.051 0.957±0.047 LC3-Ⅱ0.900±0.148 1.360±0.043①1.217±0.050①1.317±0.091①LC3-Ⅱ/LC3-Ⅰ0.990±0.096 1.267±0.150①1.230±0.026①1.283±0.148①
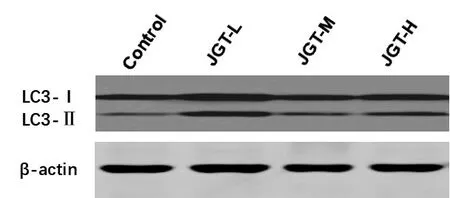
图1 各组细胞内LC3蛋白的表达
4 讨 论
多项研究发现金刚藤可抑制肿瘤细胞的增殖。于丽秀等[6]研究表明,菝葜提取物可以抑制A2780、HO8910PM 卵巢癌细胞的增殖,抑制作用呈剂量及时间依赖性。HU 等[2]研究表明,金刚藤可以促进卵巢癌A2780 细胞对顺铂和阿霉素的化学敏感性,提示金刚藤抗卵巢癌细胞不仅与其抑制卵巢癌细胞的增殖有关,还与其降低卵巢癌细胞对顺铂和阿霉素的耐药性有关。吴先闯等[7]通过体外研究发现,金刚藤乙醇粗提物、石油醚部位、乙酸乙酯部位、正丁醇部位能够抑制肝癌细胞H22、HepG-2、BEL-7402 的增殖,且呈现剂量依赖性。本课题组前期观察到金刚藤具有较好的抑制肝癌细胞生长及增殖的作用[8]。本实验选用CCK-8 法检测金刚藤对SMMC-7721 细胞增殖抑制率的影响,结果表明,金刚藤对SMMC-7721细胞增殖有明显的抑制作用,且其抑制作用随着金刚藤浓度的升高而增大,具有浓度依赖性,金刚藤高剂量组对细胞的作用最强,表明了金刚藤具有抗肝癌作用。
现代药理学研究表明,金刚藤抗肿瘤作用机制可能与增强免疫功能[9]、抑制肿瘤细胞增殖[6-7]、诱导肿瘤细胞凋亡[1、10]、抑制肿瘤细胞转移[11]等作用有关。本课题组前期研究发现,金刚藤具有诱导肝癌细胞SMMC-7721 凋亡的作用,可能与下调POLD1 基因的表达有关[3]。细胞自噬是一个涉及多个自噬相关蛋白相互作用的动态过程,细胞在自噬形成的过程中产生双层膜构造,将细胞质内物质包裹起来,形成细胞自噬体,进而与溶酶体结合成自噬溶酶体,分解其包裹的物质,降解自身受损的结构,为细胞提供必需的营养物质,维持细胞的正常生长,并且能够对肿瘤细胞的生长起着保护的作用[12];另一方面,过度自噬则可以引起细胞自噬性死亡,亦称Ⅱ型程序化细胞死亡,能够主动诱导肿瘤细胞凋亡[13]。研究表明,枸杞多糖诱导的肝癌细胞自噬,对肝癌细胞的生长起着保护作用,促进肝癌细胞的增殖,在和自噬抑制剂联合应用后,细胞的凋亡率增高,表明枸杞多糖诱导的是保护性自噬[14]。南蛇藤素可诱导肝癌细胞发生自噬,细胞增殖活力降低,但和自噬抑制剂联合应用后,细胞增殖活力增强,表明南蛇藤素诱导的是杀伤性自噬[15]。肿瘤坏死因子-α(TNF-α)可通过激活内质网应激通路诱导肝癌细胞自噬,从而促进肝癌细胞增殖[16]。这些研究说明自噬在肿瘤病理机制中的复杂性。
自噬相关蛋白LC3 参与了自噬的过程,LC3 一般以可溶性胞浆型LC3-Ⅰ的形式存在,细胞自噬时,LC3-Ⅰ酶解掉一小段多肽,转变为脂溶性的LC3-Ⅱ[17],LC3-Ⅱ是自噬体膜上的标志性蛋白,能反映细胞自噬体的数量,而LC3-Ⅱ/ LC3-Ⅰ比值可以评价自噬体的形成[5]。自噬体的数量与其生成及降解的多少有关[18]。韩志伟等[19]研究发现,健脾消积方(太子参、黄芪、白花蛇舌草等药物组成)能够抑制SMMC-7721 细胞增殖,并且能够上调LC3-Ⅱ和p62 的表达,提示其抗SMMC-7721 细胞可能是使自噬体的生成增多,抑制自噬体的溶解,细胞内大量堆积自噬体而导致细胞死亡。龚永昌等[20]研究发现姜黄素能够抑制人胃癌AGS 细胞的增殖,上调LC3-Ⅱ和SQSTM1/p62 的表达,姜黄素联合自噬抑制剂氯喹进一步增强LC3-Ⅱ和SQSTM1/p62 的表达,提示姜黄素抗AGS 细胞可能与其抑制细胞自噬流、自噬体降解,使自噬体大量堆积促进细胞死亡有关。本实验中,经不同浓度的金刚藤含药血清作用 48 h 后,通过 Western Blot 法观察 LC3 的变化,结果发现金刚藤可使SMMC-7721 细胞中LC3-Ⅱ的蛋白表达、LC3-Ⅱ/LC3-Ⅰ比值增高,LC3-Ⅰ表达未见减少,并未出现LC3-Ⅰ向LC3-Ⅱ的转变,提示自噬体数量增多,并且自噬体的增多可能与其降解减少有关。综合上述实验结果,我们认为金刚藤可抑制人肝癌细胞增殖,可能与其抑制肝癌细胞自噬体降解有关。
