脆弱拟杆菌耐药性及耐药机制研究进展
2020-03-19曹钰然胡佳丽
曹钰然, 胡佳丽, 张 菁
脆弱拟杆菌 (Bacteroides fragilis)系革兰阴性厌氧菌,由于其具有黏附性、血细胞凝集素、多糖胶囊、菌毛等多种毒力因素,在拟杆菌属中致病性最强。在人的结肠中,脆弱拟杆菌只占正常菌群的1%左右,其所致感染占全部厌氧菌感染的60%~90%。常见者有腹腔感染、术后伤口感染、糖尿病足感染、菌血症等[1-2]。一直以来,克林霉素、头孢菌素类、β内酰胺类-β内酰胺酶抑制剂复合制剂、第四代喹诺酮类、甲硝唑和碳青霉烯类抗生素为临床治疗脆弱拟杆菌感染的常用药物。然而,近年来脆弱拟杆菌对这些抗菌药物耐药的报道日益增多,其耐药率也呈升高趋势,并且在欧洲[3-6]、美国[7-9]和日本[10]已经检出了多重耐药(MDR)的菌株,给临床治疗带来了极大的挑战。本文将脆弱拟杆菌对常用抗菌药物的耐药性及耐药机制作一综述。
1 脆弱拟杆菌对常用抗菌药物的耐药性
1966年,Keusch等[11]首次报道脆弱拟杆菌对青霉素耐药,随后该菌对不同抗菌药物的耐药菌株逐渐被检出:1972年检出四环素耐药株[12],1976年检出克林霉素耐药株[13], 1978年检出甲硝唑耐药株[14],1983年检出头孢西丁和亚胺培南高水平耐药株[15-17]。
目前脆弱拟杆菌对几乎所有常用的抗菌药物出现了不同程度的耐药(表1)。虽然绝大多数的脆弱拟杆菌对甲硝唑仍呈敏感,但已有对甲硝唑敏感性下降甚至耐药的报道[18-20],并有耐药率呈不断上升的趋势:法国1996-2003年监测到的耐药率由0.8%升至2.2%[21]、南非1998-2011年监测到的耐药率由0升高至8%[22]。碳青霉烯类是除了甲硝唑外最有效的治疗脆弱拟杆菌感染的药物。大多数国家和地区报道脆弱拟杆菌对亚胺培南的耐药率均不超过4%[23-24],部分地区尚未检出耐药菌株[25-26]。脆弱拟杆菌对头孢西丁和β内酰胺类-β内酰胺酶抑制剂复合制剂耐药率低,目前报道的耐药率基本上均低于10%[27-29],对氨苄西林几乎100%耐药[30]。目前大多数国家和地区报道脆弱拟杆菌对莫西沙星的耐药率均已超过10%[1,31-32],并且耐药率不断升高[33]:韩国报道的耐药率从2015年的8%[23]升高至2019年的20%[34]。脆弱拟杆菌对克林霉素的耐药率在不同国家地区间差异较大:罗马尼亚的一项研究结果显示其对克林霉素的耐药率为2.8%[35],阿根廷报道的耐药率为22.7%[36];中国台湾[37]和韩国[38]报道的耐药率分别为48.9%和51%。脆弱拟杆菌对四环素的耐药率在不同国家地区间差异更大:西班牙的一项研究结果显示其对四环素的耐药率仅为9.7%[39],而中国报道的耐药率为84.62%[19]。
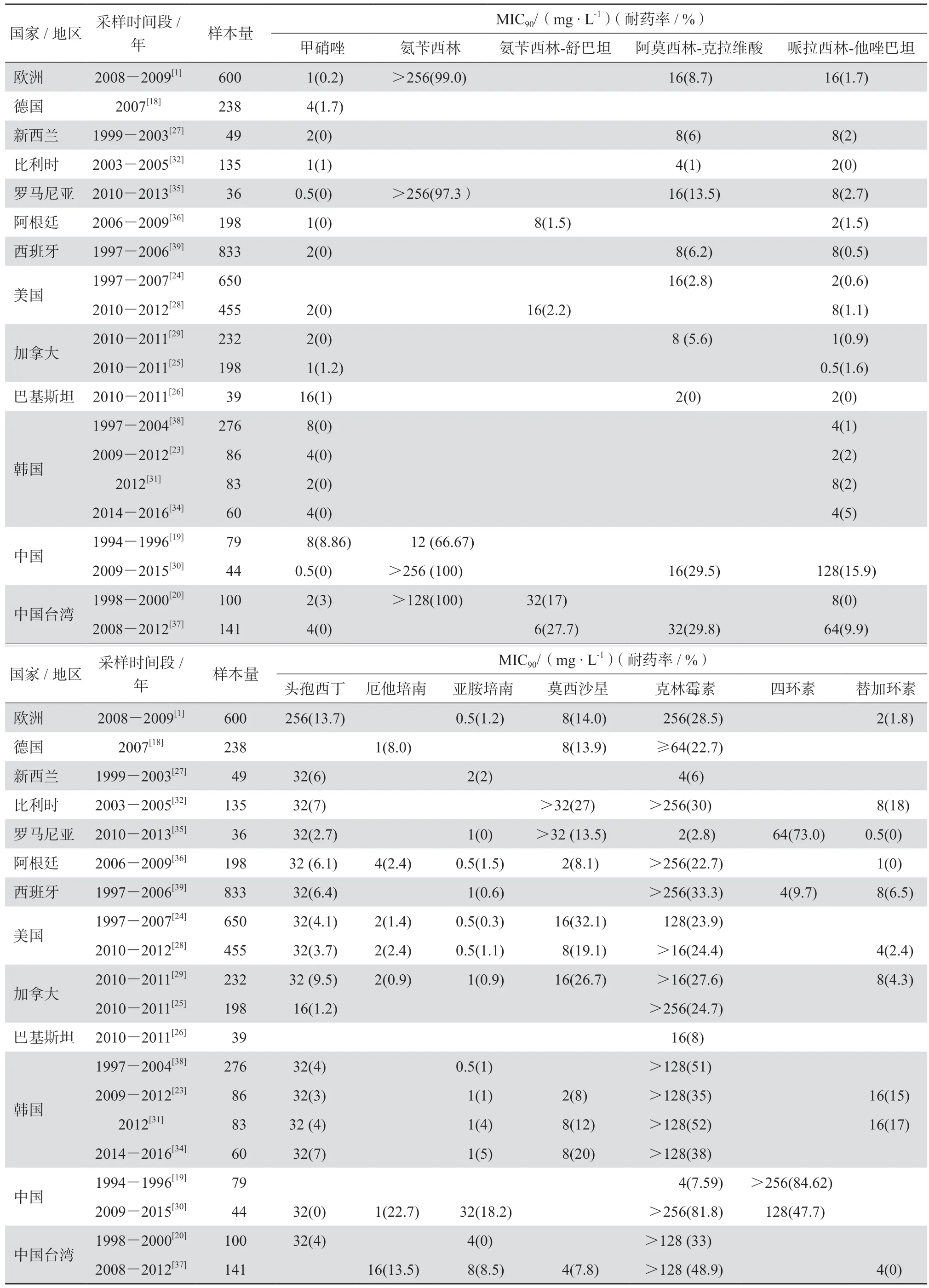
表1 不同国家/地区脆弱拟杆菌对临床常用抗菌药物的MIC90 值和耐药率
2 脆弱拟杆菌对常用抗菌药物的耐药机制
2.1 甲硝唑
一直以来,5-硝基咪唑类抗菌药物甲硝唑是治疗脆弱拟杆菌感染的一线药物,然而目前已有越来越多的国家检出了对甲硝唑耐药的脆弱拟杆菌菌株。甲硝唑的杀菌作用机制尚未完全阐明,可能为分子中的硝基还原成有毒的亚硝基自由基中间体后,与厌氧菌DNA结合,使DNA的单链及双链结构遭到破坏所致。
目前报道的脆弱拟杆菌对甲硝唑的耐药机制主要集中在nim基因上,nim基因最早报道为甲硝唑耐药的决定因素[40],它们可以由染色体或质粒携带,通常与插入序列(insertion sequence,IS)相关,可通过共轭过程转移。nim蛋白的作用机制目前尚未得到充分解释,但人们普遍认为它们是一种硝基还原酶,将硝基咪唑类药物的硝基还原为几乎没有活性的氨基,从而降低甲硝唑的杀菌作用。关于nim基因诱导耐药的报道很多,Löfmark等[41]研究发现nim阳性菌株更容易被诱导为高水平甲硝唑耐药株,Leitsch等[42]的研究结果显示nim基因表达水平与其耐药水平无直接相关性。迄今,已有报道的脆弱拟杆菌nim基因共有9个(nimA-H、nimJ)[7],并且每种基因型与IS元素具有高度特异性:nimA pIP417 IS1186,nimB染色体IS1186,nimC pIP419 IS1170,nimD pIP421 IS1169,nimE ISBf[43]。除了nim基因介导耐药外,已有报道的其他耐药机制有甲硝唑的外排、RecA蛋白过表达、亚铁转运蛋白FeoAB不足[44]和其他生物体的修饰[45-46]。
2.2 β内酰胺类
β内酰胺类药物广泛用于厌氧菌感染的治疗,该类药物主要抑制胞壁黏肽合成酶,即青霉素结合蛋白(PBP),从而阻碍细胞壁黏肽合成,使细菌胞壁缺损,菌体膨胀致使细菌胞质渗透压改变和细胞溶解而杀灭细菌。脆弱拟杆菌对其耐药可能与β内酰胺酶的产生、PBP的改变或通过细菌外膜减少药物的渗透有关。
目前脆弱拟杆菌对碳青霉烯类耐药的主要决定因素是B类金属-β内酰胺酶的生成,该酶由cfiA基因(也称为ccrA基因)编码,可降解碳青霉烯类化合物,从而使细菌对这类药物耐药。Sóki等[47]研究发现,当特定IS元件(IS613、IS614B、IS1186和IS1187)插入cfiA基因上游区域时,可激活cfiA基因并产生高度耐药性(对亚胺培南和美罗培南的MIC分别高达≥32 mg/L和≥64 mg/L)。已有报道的其他可使cfiA耐药基因高水平转录的IS元件还有IS942和IS1188[48]等。cfiA基因也可由其自身启动子激活从而使细菌对碳青霉烯类敏感性下降[49]。Ayala等[50]的研究结果显示,与亚胺培南结合的PBP2Bfr亲和力的改变也可与该菌株对亚胺培南的耐药有关。
Sóki等[51]的研究结果推断PBP在脆弱拟杆菌对头孢西丁耐药中起主要作用,而CfxA头孢西丁酶的产生只是一个次要因素,并且这两种机制可相互作用。但这种相互作用的确切性质仍有待确定,这种相互作用可能只是简单的相加,但也可能以更复杂的方式进行调控。
2.3 喹诺酮类
喹诺酮类药物通过干扰DNA旋转酶和拓扑异构酶Ⅳ发挥作用,导致酶-DNA复合物的断裂,抑制细菌DNA合成而杀菌。脆弱拟杆菌对喹诺酮类药物耐药主要与活性药物外排和喹诺酮类药物耐药决定区(quinolone resistance determining region,QRDR)DNA旋转酶亚单位gyrA的突变有关。Oh等[52]研究发现31株对所有喹诺酮类药物耐药的脆弱拟杆菌中,15株的gyrA发生突变,突变位点主要为Ser82Leu,16株高耐药菌株缺乏gyrA的突变,说明存在其他耐药机制。而Ricci等[53]在1个实验室突变菌株和2个临床分离株中检测到另一个突变的gyrB。目前尚没有关于拓扑异构酶Ⅳ基因突变的报道。
2.4 克林霉素
作为大环内酯类-林可霉素类-链阳菌素B(macrolide-lincosamide-streptogramin B,MLSB)家族的成员,克林霉素通过作用于敏感细菌的50S核糖体亚基,抑制肽链延长而影响细菌蛋白质的合成发挥抑菌作用。厌氧菌对克林霉素耐药的机制包括核糖体靶点改变、主动外排和红霉素耐药甲基化酶(erm)的产生。脆弱拟杆菌对克林霉素耐药的erm基因主要为ermF、ermG和ermB[54-55],erm基因通常携带在可传播的元件上,如接合转座子和质粒,这些元件有助于erm的传播。
2.5 替加环素
四环素类主要与核糖体30S亚单位结合,阻止氨酰化tRNA分子进入核糖体A位,从而抑制细菌蛋白质合成,达到抑菌作用。四环素的耐药机制分为核糖体保护机制、外排泵活性机制和酶失活机制。替加环素为二甲胺四环素的衍生物,经过修饰以克服四环素的耐药性。脆弱拟杆菌对替加环素的耐药机制主要与核糖体保护蛋白(tetX)的产生有关。Moore等[56]研究发现tetX修饰替加环素后形成11a-羟基替加环素,与替加环素相比,其抑制蛋白翻译的能力较弱。匈牙利的一项研究表明,在一些表现出替加环素 MIC升高的菌株中存在tetX和tetX1基因,这可能是耐药的原因[57]。
3 总结
绝大多数的脆弱拟杆菌对甲硝唑仍呈敏感,但已有对甲硝唑敏感性下降甚至耐药的报道;对碳青霉烯类、头孢西丁和β内酰胺类-β内酰胺酶抑制剂复合制剂的耐药率较低;对莫西沙星的耐药率均已超过10%;对克林霉素和四环素的耐药率在不同国家地区间差异较大。脆弱拟杆菌对甲硝唑的耐药机制主要由nim基因介导,对碳青霉烯类耐药主要与B类金属-β内酰胺酶(由cfiA基因编码)的生成有关,对莫西沙星耐药主要与活性药物外排和QRDR DNA旋转酶亚单位gyrA的突变有关,对克林霉素和四环素类耐药主要与作用靶点改变有关。临床上应加强对脆弱拟杆菌耐药性的监测,避免盲目大量使用广谱抗菌药物,有助于降低耐药脆弱拟杆菌感染的发生和传播。此外,在脆弱拟杆菌对甲硝唑、碳青霉烯类等药物耐药机制方面的进一步深入研究也将会为新型抗菌药物的研发提供思 路。
