解淀粉芽孢杆菌施用方式对烟株根际土壤真菌群落的影响
2020-01-08黎妍妍王林彭五星陈守文杨勇李锡宏
黎妍妍 王林 彭五星 陈守文 杨勇 李锡宏

摘 要:通过大田试验和ITS扩增子测序技术,研究了解淀粉芽孢杆菌不同施用方式[兌水灌根(DS)、拌土围根(BT)、米糠+拌土围根(MK+BT)]对烟株根际土壤真菌群落的影响,旨在为解淀粉芽孢杆菌的科学施用提供理论基础。结果表明,BT和MK+BT均可显著提高烟株根际土壤真菌群落OTU数量及Sobs、Shannon、Chao1指数,对烟株根际土壤真菌群落结构具有显著影响,提高了土壤中子囊菌门和担子菌门的相对丰度,促使土壤中毛壳属(Chaetomium)、木霉属(Trichoderma)和赤霉菌属(Gibberella)等一些有益微生物比例上升。综合来看,在改善根际土壤真菌群落的作用中,MK+BT>BT>DS。
关键词:解淀粉芽孢杆菌;施用方式;真菌群落;多样性
Abstract: The research aims to provide a theoretical basis for the reasonable application of Bacillus. amyloliquefaciens. Field experiments and ITS amplicon sequencing were conducted to explore the effects of three application methods of B. amyloliquefaciens on improving the fungal community in tobacco rhizosphere soil. The three application methods included the followings: (1)diluted with water and then irrigated into tobacco rhizosphere (DS), (2)mixed with soil and then applied around tobacco rhizosphere (BT), (3) mixed with rice bran and soil, then applied around tobacco rhizosphere (MK+BT). Results showed that the treatment of BT and MK+BT could significantly improve the OTU number and the Sobs, Shannon, Chao 1 indexes of soil fungal community. Meanwhile, BT and MK+BT can also significantly promote the structure of soil fungal community, improve the relative abundance of fungal phyla (Ascomycota, Basidiomycota), and increase the proportion of beneficial fungal genera (Chaetomium, Trichoderma, Gibberella). In conclusion, the promotion tendency of three application methods of B. amyloliquefaciens on fungal community in tobacco rhizosphere soil was shown as MK+BT>BT>DS.
Keywords: Bacillus amyloliquefaciens; application methods; fungal community; diversity
植物根际促生菌(plant growth promoting rhizobacteria,PGPR)是一类在植物根际稳定存活,且可促进植物生长及其对矿质营养的吸收和利用,并能抑制有害生物的有益菌类[1]。相较于传统的化肥施用,PGPR对环境友好,且可持续净化和修复土壤、防控土传病害等。因此,PGPR作为一种微生物肥料越来越受到人们关注[2]。在目前研究较多的PGPR中,芽孢杆菌属(Bacillus)是重要的一类,其中解淀粉芽孢杆菌(Bacillus amyloliquefaciens)通过产生细菌素[3]、伊草枯菌素[4]、寡肽[5]等次级代谢产物和生长素、细胞分裂素、赤霉素、脱落酸和亚精胺等多种生理活性物质[6],促进番茄[6]、水稻[7]、茶叶[8]、烟叶[9]等作物生长,修复土壤生态环境,提高作物抗病抗逆性。然而,由于土壤环境的复杂性,外源微生物通常很难在土壤中定殖并发挥促生作用。因此,研究认为在PGPR的使用上加以改进是有效发挥其作用的方法之一[10]。然而,目前关于解淀粉芽孢杆菌施用方式的报道甚少,尤其是在植烟土壤的施用方式上报道尚为空白。
土壤微生物群落结构反映土壤质量[11]。在土壤微生物中,真菌对土壤环境的变化比细菌更敏感[12],它参与土壤物质转化、养分循环和能量转化过程,促进土壤团聚体形成,进而改善土壤结构[13]。因此,分析土壤真菌群落结构响应外界环境的变化,对于探寻更为适宜的解淀粉芽孢杆菌施用方式具有重要意义。本研究拟通过田间小区试验和ITS扩增子测序技术,探究解淀粉芽孢杆菌的不同施用方式在改善烟株根际土壤真菌群落中的作用,旨在为进一步提升解淀粉芽孢杆菌的促生效果提供科学依据。
1 材料与方法
1.1 试验材料
所使用的解淀粉芽孢杆菌(B. amyloliquefaciens)菌株为YH-22[14],按相关工艺进行发酵,并干燥为粉剂(1.0×1010 cfu/g);米糠为市售。
1.2 试验地点及试验设置
试验于2018年在湖北省恩施州宣恩县罗圈岩开展,土壤类型为黄棕壤,基础理化性质:pH 6.25,有机质2.81%,碱解氮、有效磷和速效钾含量分别为112.43 mg/kg、22.74 mg/kg和344.51 mg/kg;烤烟品种为云烟87。
试验设置5个处理,各处理随机区组排列,3次重复,小区面积为39.6 m2、种植烤烟60株,行株距为1.2 m×0.55 m。各处理分别为:CK1,清水对照,50 mL/株;CK2(MK),米糠拌土围根,按照m米糠:m土=3∶50混匀,围根施用,100 g/株;DS(兑水灌根),按照m菌剂∶m水=1∶500混匀,灌根施用,50 mL/株;BT(拌土围根),按照m菌剂∶m土=1∶1000混匀,围根施用,100 g/株;MK+BT(米糠+拌土围根),按照m菌剂∶m米糠∶m土=1∶60∶940混匀,围根施用,100 g/株。其中MK+BT处理先将菌剂和米糠喷水均匀混合,在20~25 ℃温度条件下发酵20~25 d,然后拌土围根。各处理分别于烟株移栽时和移栽后40 d各施一次,每次施用量相同。
1.3 烟株根际土壤样品采集
烟株移栽后100 d时,在每小區中采集5株烟
株(生长发育一致)的根际土壤样品。用取样铲完整挖出烟株根系,敲落与根系结合较松的土壤后,用细刷刷落与根系结合较紧密的土壤(4 mm内)至自封袋中,即为根际土壤。将每小区5株烟株的根际土壤充分混合为一个样品。共计15个土样。土样采集后置于干冰中带回实验室,放置于–80 ℃冰箱保存,用于DNA提取。
1.4 土壤真菌群落分析
1.4.1 DNA提取及PCR扩增 按照FastDNA Spin Kit试剂盒(MP Biomedicals, USA)的说明提取土样总DNA。以ITS5-1737F(5′-GGAAGTAAAA GTCGTAACAAGG-3′)和ITS2-2043R(5′-GCTG CGTTCTTCATCGATGC-3′)为引物对真菌ITS1区进行PCR扩增。扩增体系(30 ?L)为:15 ?L Phusion Master Mix Buffer(2×),3 ?L引物(2 μmol/L),10 ?L DNA(1 ng/μL)模板,2 ?L H2O。反应程序为:98 ℃ 1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s(30个循环);72 ℃ 5 min。采用2%琼脂糖凝胶电泳检测PCR产物合格后进行文库构建,在Illumina Hiseq PE250测序平台进行上机测序(诺禾致源生物信息科技有限公司)。
1.4.2 OTU聚类与物种注释 对所有样品的Effective Tags进行聚类,以97%的一致性将序列聚类为OTUs(Operational Taxonomic Units)。对OTUs代表序列进行物种注释,用Qiime软件(Version 1.9.1)中的blast方法与Unit数据库进行真菌物种注释分析(设定阈值为E-value=10-5),获得各分类水平上的群落组成。
1.5 数据处理
利用R软件绘制真菌群落的稀释曲线图。利用Mothur软件计算α多样性指数(Sobs、Chao1丰富度指数和Shannon多样性指数)。基于加权Unifrac距离,利用Qiime软件对门分类水平上土壤真菌群落的组成进行UPGMA聚类分析。利用IBM Statistics SPSS 22.0软件中的One-way ANOVA分析真菌群落OTU数量、α多样性指数、物种相对丰度等在各处理间的差异(p<0.05水平),结果以平均值±标准误差表示。根据样品在属水平上的物种注释信息及相对丰度,对其丰度进行标准化处理(样品在该分类上的相对丰度和所有样品在该分类的平均相对丰度的差除以所有样品在该分类上的标准差所得到的值),并采用HemI软件绘制Heatmap图。
2 结 果
2.1 根际土壤测序深度评估
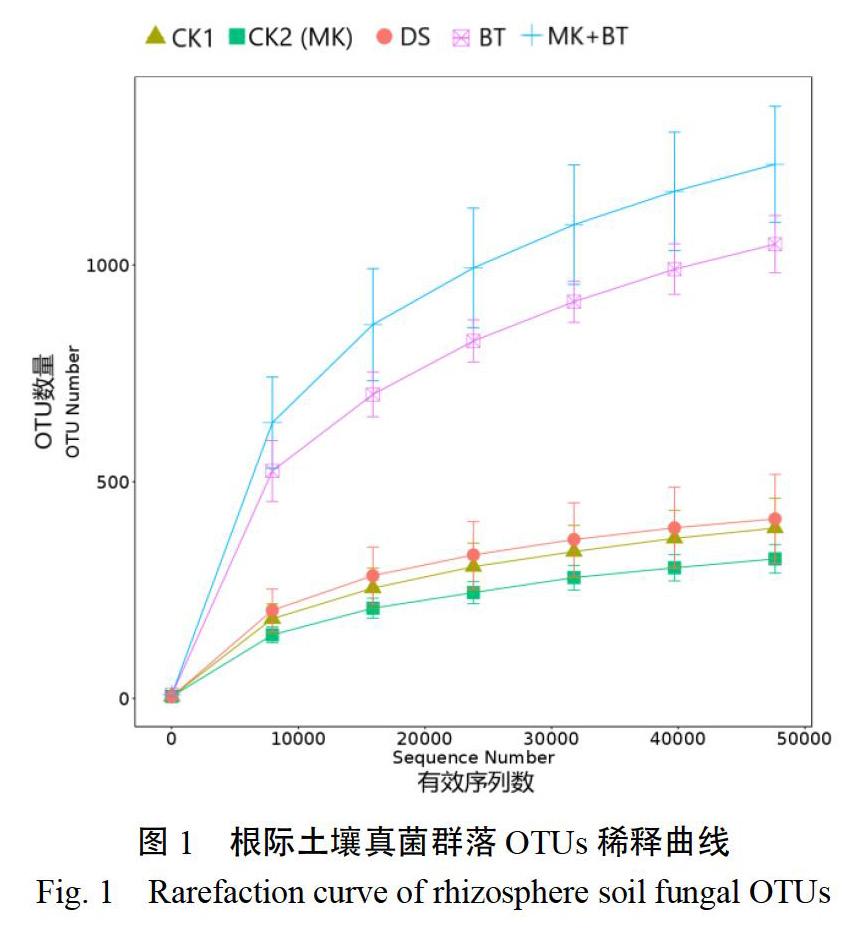
以真菌有效序列数为横坐标,以OTU数量为纵坐标绘制了土壤真菌群落稀释曲线(图1)。图1表明,在97%相似度的OTUs分类水平下,OTU数量在测序量增加的初始阶段呈现出急剧上升的趋势;随着测序量的不断增加,OTU数量趋于平缓,表明测序数量基本合理,可反映土壤真菌群落绝大多数序列信息。
2.2 土壤真菌群落多样性和丰富度分析
对根际土壤真菌群落多样性和丰富度进行了One-way ANOVA方差分析(表1)。结果表明,土壤真菌群落OTU数量、Sobs、Shannon和Chao 1指数均以MK+BT处理最高,分别较其他处理高出14.67%~249.47%、17.59%~282.71%、5.95%~142.80%和10.93%~270.76%;其中,MK+BT与BT间无显著差异,但均显著高于其他处理,表明BT和MK+BT处理可显著提升烟株根际土壤真菌群落多样性和丰富度,尤以MK+BT处理增幅明显。
2.3 门水平上土壤真菌群落组成分析
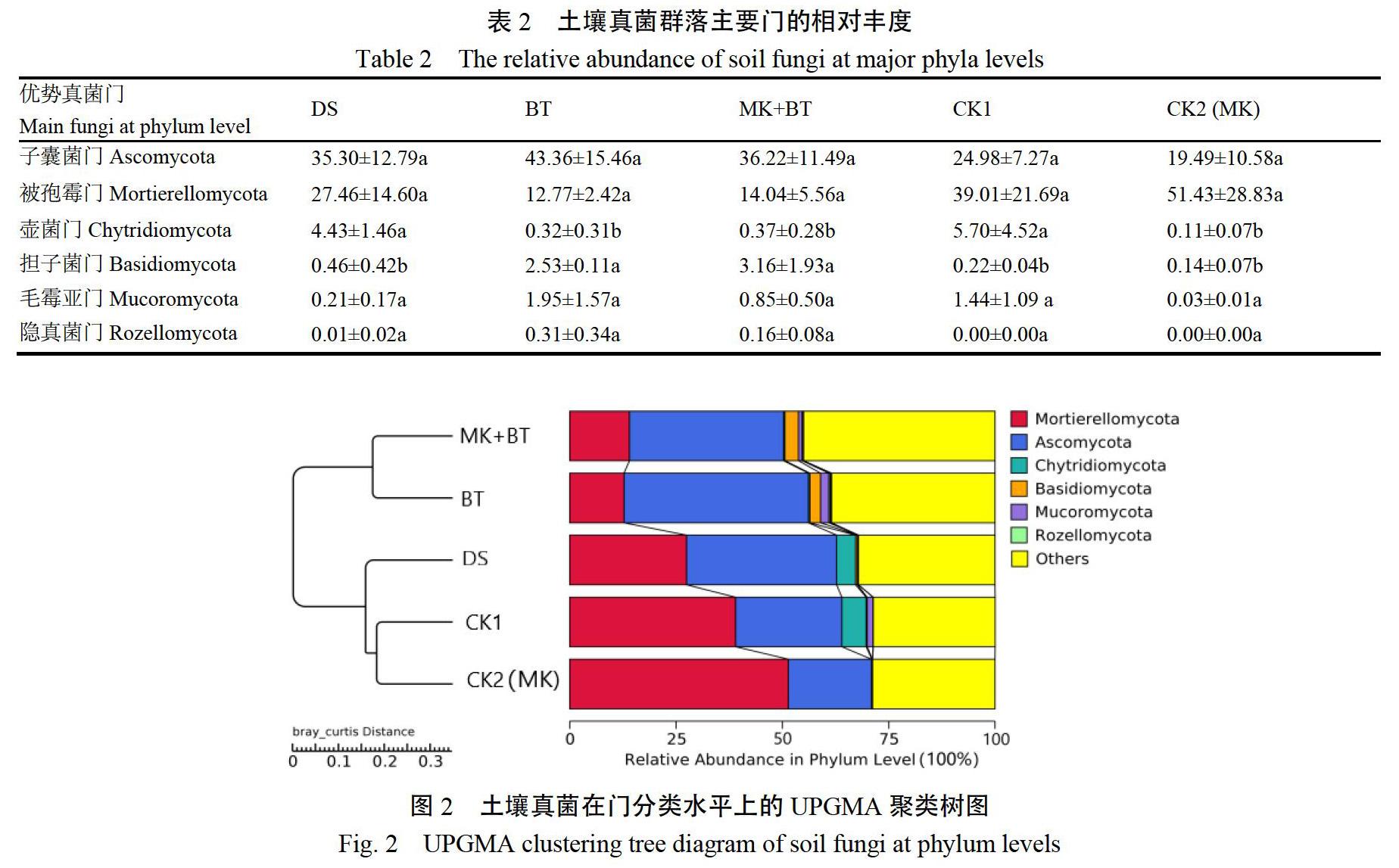
2.3.1 土壤主要真菌门相对丰度分析 对各处理土壤中主要真菌门的相对丰度进行了分析(表2)。子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)、担子菌门(Basidiomycota)、毛霉亚门(Mucoromycota)和隐真菌门(Rozellomycota)在各处理土壤中分别占19.49%~43.36%、12.77%~51.43%、0.11%~5.70%、0.14%~3.16%、0.03%~1.95%和0.00%~0.31%。CK1和CK2(MK)中被孢霉门的相对丰度最高,而DS、BT和MK+BT处理中子囊菌门的相对丰度最高。
在这6个真菌门中,壶菌门和担子菌门的相对丰度在各处理间存在显著差异。DS、BT和MK+BT处理中担子菌门的相对丰度较CK1和CK2均有所增加,其中BT和MK+BT中担子菌门相对丰度显著高于其他处理,以MK+BT处理最高;而BT和MK+BT中壶菌门的相对丰度则显著低于CK1和DS。
2.3.2 门水平上土壤真菌群落聚类分析 基于加权Unifrac距离,对各处理土壤真菌群落在门分类水平上进行了UPGMA聚类分析(图2)。BT和MK+BT处理相似性较高,聚为一类;CK1和CK2相似性较高,聚为一类;DS处理单独为一类。以上结果表明DS、BT和MK+BT处理对烟株根际土壤真菌群落组成均具有较大影响。
2.4 属水平上土壤真菌群落组成分析
根据物种注释信息和丰度信息,在属分类水平上对各处理根际土壤主要真菌属的相对丰度进行了分析(表3)。DS、BT、MK+BT和CK1、CK2中相对丰度>1%的真菌属分别有2、8、4和4、2个。方差分析结果显示,腐质霉属(Humicola)、新赤壳属(Neocosmospora)、团丝核菌属(Papulaspora)、Boothiomyces、毛壳属(Chaetomium)、弯孢属(Curvularia)、短梗蠕孢属(Trichocladium)、根霉属(Rhizopus)、毛霉菌属(Mucor)、木霉属(Trichoderma)和赤霉菌属(Gibberella)的相对丰度在各处理间存在显著差异。与CK1相比,DS处理显著降低了团丝核菌属(Papulaspora)、短梗蠕孢属(Trichocladium)和毛霉菌属(Mucor)的相对丰度,其他真菌属无显著差异;BT和MK+BT处理显著降低了团丝核菌属(Papulaspora)、Boothiomyces、短梗蠕孢属(Trichocladium)和毛霉菌属(Mucor)的相对丰度,但显著提高了土壤中新赤壳属(Neocosmospora)、毛壳属(Chaetomium)和弯孢属(Curvularia)的相对丰度;此外,BT处理也显著提高了土壤中根霉属(Rhizopus)和赤霉菌属(Gibberella)的相对丰度,MK+BT处理显著提高了土壤中木霉属(Trichoderma)的相对丰度。
对各处理土壤样本中这13个真菌属的相对丰度相似性进行了聚类分析(图3)。结果表明,BT和MK+BT处理相似性较高,聚为一类;而DS、CK1和CK2(MK)处理差异较大,分别单独为一类。
3 讨 论
微生物群落多样性与其对胁迫的响应密切相关。微生物群落多样性指数越高,其响应胁迫的修复能力也越强[15]。因此,健康烟田烟株根际土壤较土传病害发病烟田具有更高的土壤真菌群落多样性和丰富度[16]。在本研究中解淀粉芽孢杆菌的3种施用方式中,拌土围根(BT)、米糠+拌土围根(MK+BT)显著提高了烟株根际土壤真菌群落的Sobs、Shannon和Chao1等多样性和丰富度指数,其中尤以米糠+拌土围根(MK+BT)提升效果最为显著。因此,米糠+拌土围根(MK+BT)更能提高烟株根际土壤真菌群落响应胁迫的修复能力。
在真菌门水平上,解淀粉芽孢杆菌的3种施用方式和对照根际土壤具有相似的优势真菌,但其相对丰度存在一定差异。兑水灌根(DS)、拌土围根(BT)和米糠+拌土围根(MK+BT)提高了土壤中子囊菌门的相对丰度;且拌土围根(BT)和米糠+拌土圍根(MK+BT)显著提高了土壤中担子菌门的相对丰度。已有研究表明,子囊菌门和担子菌门真菌有利于分解土壤中的纤维素、木质素等,促进土壤碳循环[17-18]。
在真菌属水平上,拌土围根(BT)和米糠+拌土围根(MK+BT)具有相似的根际土壤真菌群落结构,它们提高了土壤中新赤壳属(Neocosmospora)、毛壳属(Chaetomium)、弯孢属(Curvularia)、根霉属(Rhizopus)、赤霉菌属(Gibberella)和木霉属(Trichoderma)的相对丰度。已有研究发现,毛壳属(Chaetomium)能够产生多种抗生素(毛壳素、球毛壳素等),对大豆茎秆枯腐病菌(Diaporthe phaseolorum f. sp. meridionalis)、西红柿枯萎病菌(Verticillium dahliae)等多种土传病原菌具有抑菌活性[19]。木霉属(Trichoderma)可直接与根系相互作用,通过产生生物活性物质(细胞壁降解酶以及次生代谢产物等)促进植物生长,进而抵抗生物侵染和非生物胁迫[20]。赤霉菌属(Gibberella)可分泌赤霉素,促进植物生长[9]。由此可见,拌土围根(BT)和米糠+拌土围根(MK+BT)促使土壤中Chaetomium、Trichoderma、Gibberella等有益微生物比例上升,这些微生物增强了土壤的抑病性[16,21]。然而,值得注意的是,拌土围根(BT)和米糠+拌土围根(MK+BT)同时可引起土壤中一些病原菌相对丰度的增加。据报道,新赤壳属(Neocosmospora)中的N. vasinfecta可引起花生基腐病和大豆茎枯病[22],根霉属(Rhizopus)则可引起瓜果软腐病,尽管目前并无这些病原菌侵染烟草的报道,但也应引起重视。
已有研究表明,液体接种物直接掺入土壤通常会导致外源细菌与土壤颗粒粘附,从而大大降低它们在土壤中的垂直运输及其在植物根际定殖的能力[23],本研究结果也发现这一现象,如解淀粉芽孢杆菌兑水灌根(DS)对烟株根际土壤真菌群落的改善作用较小。一些载体材料的添加则能够提高微生物的定殖能力和有效性[24-25],本研究中使用的米糠一方面作为营养介质可为解淀粉芽孢杆菌提供持续的营养,使芽孢杆菌菌群在营养上处于优势,从而充分发挥促生作用;另一方面,米糠具有良好的孔隙结构,可为外源微生物提供空间保护,并改善土壤结构,进而使土壤环境更有利于微生物定殖[25-26]。因此,与兑水灌根(DS)和拌土围根(BT)两种施用方式相比,米糠+拌土围根(MK+BT)的根际土壤真菌群落表现出了更高的多样性和丰富度。
需要指出的是,本研究仅是黄棕壤土壤类型上1年的大田试验结果,获取的拌土围根(BT)和米糠+拌土围根(MK+BT)效果的广适性和长效性还有待于进一步监测。
4 结 论
本研究结果表明,与兑水灌根相比,解淀粉芽孢杆菌拌土围根和与米糠一起发酵后再拌土围根两种施用方式均可显著提高烟株根际土壤真菌群落的多样性和丰富度;提升土壤中子囊菌门和担子菌门的相对丰度,促使土壤中毛壳属(Chaetomium)、木霉属(Trichoderma)和赤霉菌属(Gibberella)等有益微生物比例上升,对烟株根际土壤真菌群落结构具有显著的积极影响。
参考文献
[1] SIDDIQUI Z A. PGPR: prospective biocontrol agents of plant pathogens[M]//SIDDIQUI Z A. PGPR: Biocontrol and Biofertilization. Dordrecht: Springer, 2006: 111-142.
[2] BHATTACHARYYA P N, JHA D K. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture[J]. World Journal of Microbiology and Biotechnology, 2011, 28(4): 1327-1350.
[3] SUTYAK K E, WIRAWAN R E, AROUTCHEVA A A, et al. Isolation of the Bacillus subtillis antimicrobial peptide subtilosin from the dairy product-derived Bacillus amyloliquefaciens[J]. Journal of Applide Microbiology, 2008, 105(6): 1067-1074.
[4] ARREBOLA E, JACOBS R, KORSTEN L. Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens[J]. Journal of Applied Microbiology, 2009, 108(2): 386-395.
[5] CHAO S H, CHENG T H, SHAW C Y, et al. Characterization of a novel PepF-like oligopeptidase secreted by Bacillus amyloliquefaciens[J]. Applied and Environmental Microbiology, 2006, 1(72): 968-971.
[6] 杨晓云,陈志谊,蒋盼盼,等. 解淀粉芽孢杆菌B1619对番茄的促生作用[J]. 中国生物防治学报,2016,32(3):349-356.
YANG X Y, CHEN Z Y, JIANG P P, et al. Growth-promotion effect of Bacillus amyloliquefaciens B1619 on tomato plant[J]. Chinese Journal of Biological Control, 2016, 32(3): 349-356.
[7] 李晴晴,徐松,赵维,等. 根际微生物组介导的解淀粉芽孢杆菌FH-1对水稻的促生机制[J]. 微生物学报,2019,59(12):2410-2426.
LI Q Q, XU S, ZHAO W, et al. Rhizosphere microbiome mediated growth-promoting mechanisms of Bacillus amyloliquefaciens FH-1 on rice[J]. Acta Microbiologica Sinica, 2019, 59(12): 2410-2426.
[8] 林斌,黄菊青,官雪芳,等. 解淀粉芽孢杆菌液体肥在茶葉上的应用研究[J]. 福建农业学报,2019,34(10):1173-1178.
LIN B, HUANG J Q, GUAN X F, et al. Application of Bacillus amyloliquefaciens liquid fertilizer on tea bushes[J]. Fujian Journal of Agricultural Sciences, 2019, 34(10): 1173-1178.
[9] 樊祖清,芦阿虔,王海涛,等. 施用解淀粉芽孢杆菌对烟株生长和根际土壤微生物区系的影响[J]. 河南农业科学,2019,48(4):33-40.
FAN Z Q, LU A Q, WANG H T, et al. Effects of Bacillus amyloliquefaciens on the growth of tobacco and microflora in rhizosphere soil[J]. Journal of Henan Agricultural Sciences, 2019, 48(4): 33-40.
[10] 李红丽,李清飞,郭夏丽,等. 调节土壤微生态防治烟草青枯病[J]. 河南农业科学,2006(2):57-60.
LI H L, LI Q F, GUO X L, et al. Controlling tobacco bacterial wilt by adjusting soil micro-ecology[J]. Henan Agricultural Sciences, 2006(2): 57-60.
[11] VIMAL S R, SINGH J S, ARORA N K, et al. Soil-plant-microbe interactions in stressed agriculture management: a review[J]. Pedosphere, 2017, 27(2): 177-192.
[12] THORMANN M N. Diversity and function of fungi in peatlands: a carbon cycling perspective[J]. Canadian Journal of Soil Science, 2006, 86(S): 281-293.
[13] WARDLE D A, BARDGETT R D, KLIRONOMOS J N, et al. Ecological linkages between aboveground and belowground biota[J]. Science, 2004, 304(5677): 1629-1633.
[14] 楊欢,余君,王昌军,等. 烟草青枯病生防菌YH-22抗病机制的初步研究[J]. 中国烟草科学,2014,35(3):61-66.
YANG H, YU J, WANG C J, et al. Study on resistance mechanism of bio-control strain Bacillus amyloliquefaciens YH-22 against tobacco wilt[J]. Chinese Tobacco Science, 2014, 35(3): 61-66.
[15] 贺纪正,李晶,郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性,2013,21(4):411-420.
HE J Z, LI J, ZHENG Y M. Thoughts on the microbial diversity-stability relationship in soil ecosystems[J]. Biodiversity Science, 2013, 21(4): 411-420.
[16] WANG R, ZHANG H, SUN L, et al. Microbial community composition is related to soil biological and chemical properties and bacterial wilt outbreak[J]. Scientific Reports, 2017, 7: 343-352.
[17] UNTERSEHER M, PER?OH D, SCHNITTLER M. Leaf-inhabiting endophytic fungi of European Beech (Fagus sylvatica L.) co-occur in leaf litter but are rare on decaying wood of the same host[J]. Fungal Diversity, 2013, 60: 43-54.
[18] PURAHONG W, WUBET T, LENTENDU G, et al. Life in leaf litter: novel insights into community dynamics of bacteria and fungi during litter decomposition[J]. Molecular Ecology, 2016, 25: 4059-4074.
[19] 孟庆果. 内生菌球毛壳ND35在寄主植物中的侵染过程及其定殖后对植物的影响与分子检测[D]. 泰安:山东农业大学,2009.
MENG Q G. Infection process and the influence of endophytic Chaetomium globosum ND35 on host plant and its molecular detection[D]. Taian: Shandong Agricultural University, 2009.
[20] SILVA R N, MONTEIRO V N, STEINDORF A S, et al. Trichoderma/pathogen/plant interaction in pre-harvest food security[J]. Fungal Biology, 2019, 123: 565-583.
[21] PIETERSE C, ZAMIOUDIS C, BERENDSEN R L, et al. Induced systemic resistance by beneficial microbes[J]. Annu Rev Phytopathol, 2014, 52: 347-375.
[22] 潘汝谦,盖云鹏,邓铭光,等. 一种值得关注的花生新病害:花生新赤壳菌基腐病[J]. 植物保护,2012,38(3):180-183.
PAN R Q, GAI Y P, DENG M G, et al. A notable new disease: Neocosmospora foot rot of peanut[J]. Plant protection, 2012, 38(3): 180-183.
[23] SCHREITER S, SANDMANN M, SMALLA K. Soil type dependent rhizosphere competence and biocontrol of two bacterial inoculant strains and their effects on the rhizosphere microbial community of field-grown lettuce[J]. Plos One, 2014, 9(8): e103726.
[24] SAHAI P, CHANDRA R. Co-inoculation effect of liquid and carrier inoculants of Mesorhizobium ciceri and PGPR on nodulation, nutrient uptake and yields of chickpea[J]. Journal of Food Legumes, 2010, 28(5): 296-301.
[25] HALE L, LUTH M, CROWLEY D. Biochar characteristics relate to its utility as an alternative soil inoculum carrier to peat and vermiculite[J]. Soil Biology and Biochemistry, 2015, 81(81): 228-235.
[26] EL-FATTAH D A, EWEDA W E, ZAYED M S. Effect of carrier materials, sterilization method, and storage temperature on survival and biological activities of Azotobacter chroococcum inoculant[J]. Annals of Agricultural Sciences, 2013, 58(2): 111-118.
