外源碳添加对植烟土壤氮素转化及N2O排放的影响
2020-01-08李青山王德权杜传印李现道张国超王术科管恩森王慎强
李青山 王德权 杜传印 李现道 张国超 王术科 管恩森 王慎强


摘 要:为探寻有效调控烤烟生长后期植烟土壤氮素水平的措施,采用室内培养的试验方法,研究了葡萄糖、木屑及二者混合物对植烟土壤氮素转化及N2O排放的影响。试验设5个添加等量碳(纯碳3000 mg/kg)处理及1个对照:G1S0,葡萄糖:木屑=1:0 (以纯碳计,下同);G2S1,葡萄糖:木屑=2:1;G1S1,葡萄糖:木屑=1:1;G1S2,葡萄糖:木屑=1:2;G0S1,葡萄糖:木屑=0:1;CK,不添加外源碳。結果表明,在培养1 d后,与对照处理相比,G1S0、G2S1、G1S1、G1S2处理的无机氮含量分别降低了51.71、61.78、62.33、62.46 mg/kg,而G0S1处理的无机氮含量却增加了4.12 mg/kg;G1S0,G2S1,G1S1,G1S2和G0S1处理的无机氮含量分别在培养7,14,14,14和28 d后达到最小值后呈不断增大的趋势。在培养结束时,与对照处理相比,添加碳源处理的无机氮降低量为96.80~148.10 mg/kg;除G0S1外,添加碳源处理较CK处理显著增加了CO2和N2O累积排放量(p<0.05)。可见,添加葡萄糖、木屑及其混合物能够显著降低土壤中无机氮含量(p<0.05);葡萄糖与木屑混施较单施木屑可以加快微生物对氮素的固持并增强固持强度,较单施葡萄糖能够延长微生物对氮素的固持时间;添加外源碳增强了土壤微生物活性,同时也刺激了N2O排放。综合来看,葡萄糖和木屑混施降低无机氮含量的效果最好。因此,添加外源碳可作为一种调控植烟土壤氮素水平的措施。
关键词:外源碳;植烟土壤;氮素转化;N2O
Abstract: In order to explore the effective measures to regulate soil nitrogen (N) content in tobacco planting soil during the late growth stage of flue-cured tobacco. An incubation experiment was conducted to study the effects of glucose, sawdust and their mixture on N transformation and N2O emissions in tobacco planting soil. Based on the equal carbon content (3000 mg/kg) addition, the experiment included 5 treatments: G1S0, glucose: sawdust =1: 0 (Calculated by pure carbon, the same below); G2S1, glucose: sawdust=2:1; G1S1, glucose: sawdust=1:1; G1S2, glucose: sawdust=1:2; G0S1, glucose: sawdust =0:1; and no carbon added as control (CK). The results showed that the soil inorganic N content was decreased by 51.71, 61.78, 62.33 and 62.46 mg/kg in G1S0, G2S1, G1S1and G1S2 treatments respectively, but increased by 4.12 mg/kg in G0S1 treatment compared with that in CK at the first day of the incubation. The contents of soil inorganic N in G1S0, G2S1, G1S1, G1S2 and G0S1 treatments all showed increasing trends after reaching the minimum values at the 7, 14, 14, 14 and 28 days of the incubation, respectively. The soil inorganic N contents in treatments amended with exogenous carbon sources were all decreased by 96.80~148.10 mg/kg compared with that in CK at the end of the incubation. Meanwhile, the cumulative emissions of CO2 and N2O in all carbon sources amended treatments except for G0S1 were increased significantly (p<0.05) compared with those in CK, So, the addition of glucose, sawdust and their mixture could significantly decrease the content of soil inorganic N (p<0.05). Combined application of glucose and sawdust could accelerate and enhance the intensity of soil microbial immobilization of N compared with single application of sawdust. And it could also prolong the time of soil microbial immobilization of N compared with single application of glucose. In addition, the addition of exogenous carbon source could increase soil microbial activity and stimulate N2O emissions simultaneously. In general, the mixed application of glucose and sawdust had the best effect on reducing the soil inorganic N content. Therefore, application of exogenous carbon source could be a useful measure to regulate soil N content in tobacco planting soil.
Keywords: exogenous carbon; tobacco planting soil; inorganic N; N2O
烟草是我国的重要经济作物,然而与先进烤烟生产国如津巴布韦和美国相比较,我国烟叶的内外在品质仍存在差距,表现在整体香气量不足,上部烟叶烟碱含量较高和叶片过厚等方面[1]。
氮素是烤烟生产中最重要的营养元素[2],氮素不足或过量都会对烟叶的产量和品质产生不利影响。国外优质烤烟生产中的氮素管理是确保在烟株快速生长期间有足够的氮素供应,而在烟株开花打顶后土壤中的氮素储备快速耗尽[3-4]。李春俭等[1]研究表明,我国部分植烟区的烤烟在打顶后仍大量吸收氮素,与国外优质烤烟的吸氮曲线有很大差异,这是导致我国上部烟叶整体质量得不到提升的重要原因。因此,有学者认为通过合适的措施来调控烤烟生长后期土壤氮素供应是获得优质烤烟烟叶的关键所在[5-6]。
微生物同化作用在调节土壤有效氮含量方面起着重要的作用[7]。土壤中的铵态氮和硝态氮被微生物同化,成为生物体有机组成部分,称为无机氮的微生物固持,又称微生物同化作用[8]。研究表明,微生物同化作用受土壤中有效碳含量的调控,增加土壤中有效碳含量将促进微生物对无机氮的同化作用[9-11]。研究发现向土壤添加葡萄糖可显著降低土壤中无机氮含量[12]。也有研究表明,添加不同来源和不同质量的有机质对土壤中氮素转化具有不同影响[13-15],添加低C/N有机质(C/N<20)表现为氮素的净矿化[16];而添加高C/N比有机质则表现为微生物对氮素的净固持[17]。例如,巨晓棠等[18]研究发现,添加苜蓿秸秆或鸡粪(低C/N比)显著提高土壤中的无机氮量,而添加小麦秸秆(高C/N比)则显著降低土壤中的无机氮含量。
综上所述,我们设想在烤烟生长后期向土壤中添加外源碳可以作为一种调控土壤氮素水平的措施,然而有关添加外碳源对植烟土壤氮素转化的研究少有报道。因此,本文以植烟土壤为研究对象,选取葡萄糖和木屑作为外源碳,并通过添加硝酸铵模拟植烟土壤后期含有大量有效氮的情景,采用实验室静态培养的方法探究外源碳对植烟土壤氮素转化的影响。
1 材料与方法
1.1 供试土壤与材料
供试土壤取自贵州省遵义市务川县烟草科技示范园(107.40° E,28.28° N)内烟田0~20 cm表层。该地属中亚热带湿润性季风气候,山体气候特征明显。年均气温15.9 ℃,年平均无霜期280 d,年降水量1271.7 mm。土壤類型为棕黄壤。供试土壤的基本理化性质为:全氮1.63 g/kg,全碳19.20 g/kg,有机质11.10 g/kg,碳氮比11.78,pH 7.3。供试土壤多点采集混合后,挑出肉眼可见的植物残体和石块,过2 mm筛后保存于4 ℃冰箱。
外源碳包括葡萄糖和木屑。木屑的基本理化性质为:全氮1.2 g/kg,全碳470 g/kg,碳氮比461,pH 5.1。木屑用粉碎机粉碎后过100目筛备用;葡萄糖按照试验设计的添加量提前配置成不同浓度的葡萄糖溶液。
1.2 试验设计
试验共设置6个处理:CK,硝酸铵(200 mg/kg,以纯氮计,下同);G1S0,葡萄糖(3000 mg/kg,以纯碳计,下同)+硝酸铵;G2S1,葡萄糖(2000 mg/kg)+木屑(1000 mg/kg)+硝酸铵;G1S1,葡萄糖(1500 mg/kg)+木屑(1500 mg/kg)+硝酸铵;G1S2,葡萄糖(1000 mg/kg)+木屑(2000 mg/kg)+硝酸铵;G0S1,木屑(3000 mg/kg)+硝酸铵。除CK处理外,外源碳在所有处理中按等碳量(3000 mg/kg)加入,葡萄糖和木屑的实际添加量通过各自的含碳量来计算。
称取相当于20 g干土的新鲜土样于250 mL玻璃瓶中,培养开始前把土壤混匀,使其厚度均匀地平铺在瓶底,放在25 ℃室内预培养1 d。预培养结束后,按照试验设计,向每组处理的玻璃瓶中添加外源碳,其中葡萄糖用移液管添加,木屑通过与土壤充分混匀的方式添加。同时向每个玻璃瓶中加NH4NO3溶液(N 200 mg/kg),含NH4+-N和NO3?-N各100 mg/kg。用去离子水将所有处理的土壤含水量调整为最大田间持水量的67%。然后用硅胶塞将玻璃瓶密封,继续在25 ℃下恒温培养60 d,每隔2 d去塞通气0.5 h左右,每2~3天补水1 次以补充因蒸发导致的水分损失。分别在添加外源碳后的第1、3、5、7、14、28、60天结束时采集气体样品。采集气体样品之前,需要提前6 h进行换气密封。换气前用南京大学研制的704硅胶将橡胶塞与瓶口缝隙密封,待硅胶干燥之后,用真空泵抽取三角瓶中的气体3 min,接着通入新鲜空气,使三角瓶中的气体与外界的气体平衡,再次进行上述操作,如此反复3次,确保三角瓶中充满新鲜的空气。在最后一次通入空气时,采集此时的空气于20 mL的真空瓶中,作为初始气体浓度,记录采样时间。密封培养6 h之后,从每组处理中随机取出3个玻璃瓶作为重复,用注射器快速反复抽提5次以确保三角瓶内气体充分混匀,用带有三通阀的注射器立即采集20 mL的气体,注入20 mL的真空瓶中用于测定N2O和CO2的浓度[19]。
分别在培养过程中的第1、7、14、28、60天结束时,从每组处理中随机取出3个土壤样品作为重复,按水土比5:1向玻璃瓶中加入100 mL的2 mol/L KCl溶液,振荡,过滤,收集滤液于塑料瓶中,并于4 ℃下低温保存,用于测定土壤中NO3?-N和NH4+-N浓度。
1.3 测定项目与方法
土壤用KCl溶液提取后的滤液用Skalar连续流动分析仪测定NO3?-N和NH4+-N浓度,土壤pH用电位法(KCl浸提液)测定。气体样品中的N2O和CO2浓度采用气相色谱仪(Agilent Technologies 7890A)测定。
1.4 数据分析处理
净矿化速率按照公式(1)进行计算:
净矿化速率=[(NO3?-N+NH4+-N)tn?(NO3?-N+ NH4+-N)t0]/(tn-t0) (1)
式中:(NO3?-N+NH4+-N)tn和(NO3?-N+NH4+-N)t0分别为培养n d和 0 d时NO3?-N和NH4+-N含量之和(mg/kg)。
无机氮(DIN)=NO3?-N+NH4+-N (2)
CO2和N2O排放速率计算公式[19]为:
F = ρ× dc/dt× V × 273/(273+T)/m (3)
式中:F 为气体的排放速率[N2O,μg/(kg·d),以N计;CO2, mg/(kg·d),以C计];ρ为标准状况下CO2和N2O的密度(分别以纯氮和纯碳计,kg/m3);dc/dt为单位时间内三角瓶内气体浓度增加量[mg/(L·d)];V代表三角瓶中气体的有效空间体积(mL);T代表培养温度(℃),m代表干土的质量(kg)。两次排放通量测定间隔时间内的N2O和CO2排放量用两次测定的平均排放通量乘以时间间隔计算。整个培养过程中的N2O和CO2总排放量则为N2O和CO2累积排放量。
文中的pH、可溶性氮组分、N2O和CO2排放数据均为3次重复数据。采用SPSS 24.0软件对数据进行单因素方差分析,用LSD方法(p<0.05)分析处理间差异显著性,用OriginPro 2018进行作图和线性拟合。
2 结 果
2.1 培养过程中土壤可溶性氮变化
2.1.1 铵态氮(NH4+-N) 由图1A可以看出,与CK处理相比,G1S0、G2S1、G1S1、G1S2处理在培养1 d后显著降低了土壤NH4+-N含量(p<0.05);而G0S1处理则与CK处理间差异不明显。在培养7 d后,与CK处理相比,所有添加外源碳处理均显著降低了土壤NH4+-N含量(p<0.05);G1S0、G2S1、G1S1、G1S2、G0S1处理的NH4+-N含量较CK处理分别降低了60.52、56.98、41.59、44.50、44.75 mg/kg。在培养14 d后,各处理的土壤NH4+-N含量在剩余的培養时间内均极低,差异不显著。
2.1.2 硝态氮(NO3?-N) 由图1B可以看出,在培养1 d后,G1S0和G2S1处理较CK处理显著降低了土壤NO3?-N含量(p<0.05),而G0S1处理较CK处理显著提高(p<0.05)。在培养7 d后,除G0S1处理外,添加外源碳处理较CK处理均显著降低了土壤NO3?-N含量(p<0.05),其中G1S0和G2S1处理的NO3?-N含量在此时达到最低值。从培养14 d到培养结束时,所有添加外源碳处理的NO3?-N含量均显著小于CK处理(p<0.05)。在培养结束时,G1S0、G2S1、G1S1、G1S2、G0S1处理的NO3?-N含量分别比CK处理降低了136.73、145.58、17.48、121.45、97.08 mg/kg。
2.1.3 无机氮(DIN) 由图2A可以看出,与CK处理相比,G1S0、G2S1、G1S1、G1S2处理在整个培养过程中均显著降低了土壤DIN含量(p<0.05)。G1S0和G2S1处理的DIN含量均在培养7 d后达到最低值,与CK处理DIN含量的差值最大,分别为162.23和158.10 mg/kg;G1S1和G1S2处理的DIN含量均在培养14 d达到最低值,与CK处理DIN含量的差值最大,分别为177.52和100.56 mg/kg。G0S1处理的DIN含量在培养1 d后与CK处理差 异不显著,在培养7 d后开始显著低于CK,在培养 28 d后达到最小值,与CK处理的差值最大,为91.89 mg/kg。
2.1.4 净矿化速率 由图2B可以看出,所有添加外源碳处理在整个培养过程中的净矿化速率均低于CK处理,且均为负值;而CK处理在第1天内的净矿化为负值,在之后的培养过程中净矿化速率均为正值,说明添加外源碳后土壤中氮素转化表现为微生物净固持。
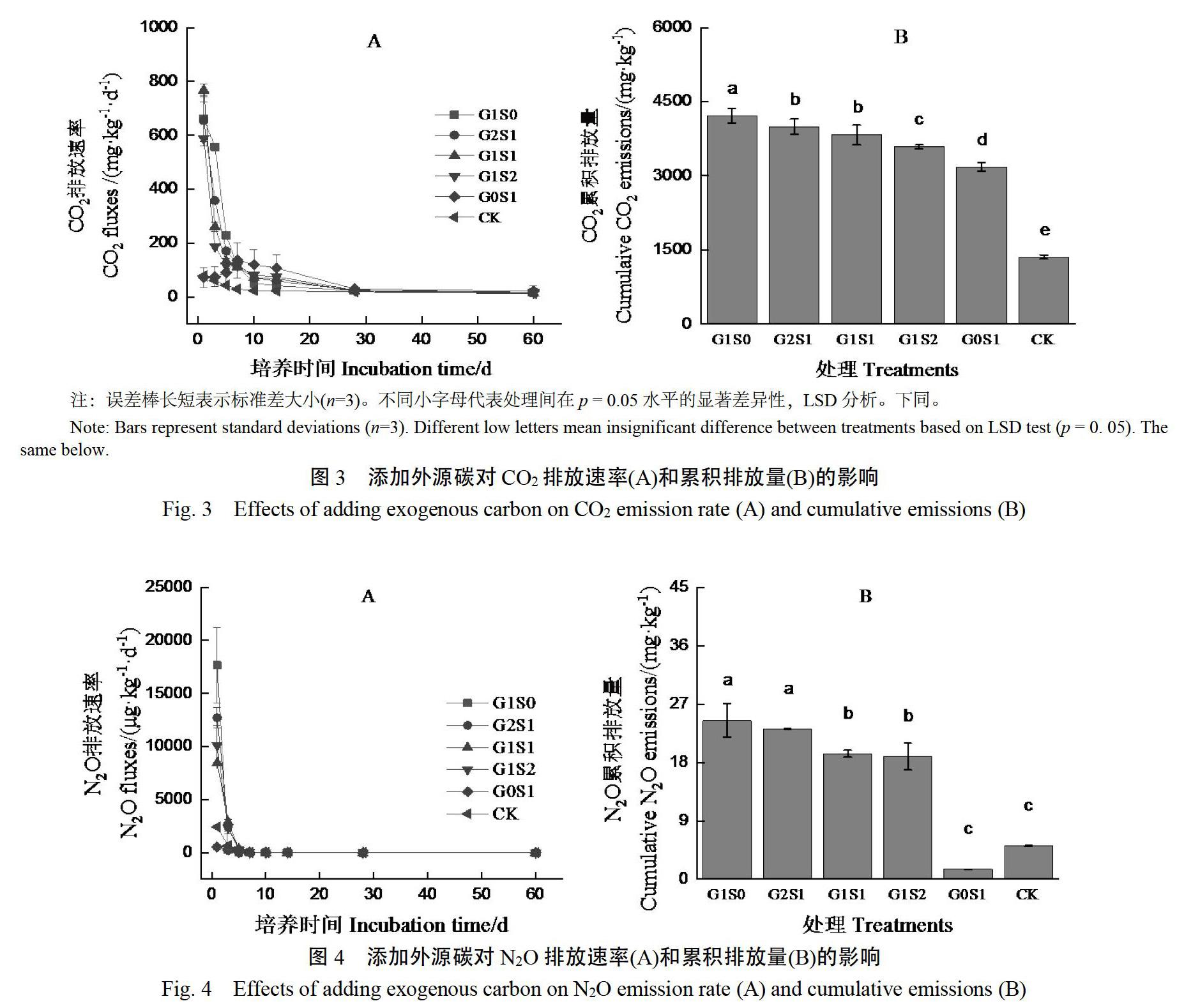
2.2 CO2排放速率和累积排放量
在室内培养实验中,CO2排放速率可表征为土壤呼吸速率。由图3A可以看出,CK、G1S0、G2S1、G1S1、G1S2处理的土壤呼吸速率随培养时间增加呈不断减小的趋势;而G0S1处理的土壤呼吸速率则呈先增大后减小的趋势,在培养7 d后达到最大值。与CK处理相比,G1S0、G2S1、G1S1、G1S2处理在培养14 d内均显著提高了土壤呼吸速率(p<0.05),G0S1处理在培养7~28 d显著提高了土壤呼吸速率。但G0S1处理的土壤呼吸速率在培养前7天内显著低于其他添加碳源处理(p<0.05)。
由图3B可以看出,与CK处理相比,添加外源碳处理显著增加了CO2累积排放量(p<0.05),以G1S0处理最大,G0S1处理最小。除G2S1与G1S1处理间差异不显著,其他添加碳源处理间差异显著(p<0.05)。
2.3 N2O排放速率和累积排放量
由图4A可以看出,各处理的土壤N2O排放速率随培养时间增加呈不断减小的趋势。与CK处理相比,G1S0、G2S1、G1S1、G1S2处理显著提高了土壤N2O排放速率(p<0.05);而G0S1处理却显著降低了土壤N2O排放速率(p<0.05)。由图4B可以看出,G1S0、G2S1、G1S1、G1S2处理较CK处理显著增加了土壤N2O累积排放量(p<0.05);G0S1处理较CK处理明显减少了N2O累积排放量,但未达显著差异。
3 讨 论
在土壤氮素转化过程中,有效碳含量显著影响着微生物同化作用。增加土壤中有效碳含量将增加微生物生长量,并增强微生物对无机氮的需求,从而导致无机氮的净固持效应[20]。张乐等[21]研究表明,外加葡萄糖明显提高了土壤微生物活性,并增强了微生物同化作用,导致土壤中无机氮含量显著降低。MA等[12]研究也发现,当葡萄糖添加量≥1000 mg/kg(以纯碳计)时,土壤中无机氮含量显著降低。巨晓棠等[18]研究发现,添加高C/N比有机物料能够显著降低土壤中的无机氮含量。REICHEL等[22]通过室内培养的方法,研究了小麦秸秆、云杉木屑和木质素作为高有机碳土壤改良剂提高农业固氮能力的潜力,结果表明添加小麦秸秆和木屑能够以微生物生物量氮的形式快速固定土壤中过量的氮素。本研究中也发现,所有添加外源碳处理在培养结束时较CK处理显著降低了土壤无机氮含量(图2A),说明葡萄糖和木屑适合作为外源碳来调控土壤中有效氮含量。
本研究中,G1S0处理(单施葡萄糖)的无机氮含量在培养1 d后较CK处理降低了51.71 mg/kg,而G0S1处理(单施木屑)与CK处理间差异并不明显,这说明微生物会首先利用能直接提供能量的葡萄糖[23],有效碳源充足促进了微生物对氮素的快速固持,而添加C/N较高、难分解的木屑时,微生物由于受有效碳的限制,对氮素的固定速度偏慢[24]。OCIO等[25]在田间试验中也发现,与葡萄糖作为碳源相比,以秸秆类物质为碳源时对无机氮的固持进程相对较慢。另有研究表明,蔗糖和木屑的混合物在降低无机氮含量的效果上更有效,这是因为蔗糖在降低無机氮含量上更快更强烈,而木屑在降低无机氮含量上可保持稳定的时间更长[26]。在本试验中,葡萄糖和木屑混施在培养1 d后较单施葡萄糖在降低无机氮含量上效果更明显(图2A),这与TOROK等的研究结果一致。我们还注意到不同碳源处理的无机氮含量在培养过程中降低到最小值的时间不同,葡萄糖和木屑混施较单施葡萄糖推迟了无机氮含量降低到最小值的时间;而葡萄糖和木屑混施较单施木屑明显增大了无机氮含量的降低幅度。此外,G1S2处理在整个培养过程中无机氮含量的浮动幅度最小。以上结果说明葡萄糖和木屑混施比单施木屑能够加快微生物固持氮素和增大微生物固持氮素的强度,而比单施葡萄糖可以延长微生物固持氮素的时间。
氮和碳是影响N2O排放的重要因素。土壤中的NH4+-N和NO3?-N是硝化和反硝化作用的直接底物,一般认为N2O产生或排放随土壤中NH4+-N和NO3?-N含量的增加而增强[27-28]。反硝化细菌绝大多数是化能异养型的,作为反硝化作用的主要作用者,反硝化细菌需要有机质提供电子供体和能源[29]。本研究中,外源碳和硝酸铵在培养初始同时加入土壤中,为N2O产生或排放提供了有利条件。单施葡萄糖及葡萄糖和木屑混施处理较CK处理显著增加了N2O排放速率和累积排放量(图4),说明添加外源碳不仅促进了微生物同化作用同时也增强了土壤微生物反硝化作用。
TILSTON等[30]研究表明,添加外源碳可以提高微生物活性,本研究中,添加外源碳处理较CK处理均显著提高了土壤呼吸速率和CO2累积排放量(图3),也说明添加碳源提高了微生物活性,增强了微生物呼吸作用。另外,微生物呼吸作用增强,加快了土壤中氧气的消耗,容易形成厌氧环境而促进反硝化作用[31],导致N2O排放量的增加。HUANG等[32]研究表明N2O累积排放量与CO2累积排放量呈显著正相关关系,本研究中除单施木屑处理外,其他添加碳源处理均较CK处理显著增加了CO2和N2O累积排放量,与之结果相同。但单施木屑处理与之不同,较CK处理明显减少了N2O排放量。而有研究表明氮肥配施木屑较单施氮肥显著增加了N2O排放量[22]。因此,本研究中添加木屑导致N2O排放量减少的缘由有待进一步探索。
综上所述,本研究表明向植烟土壤添加葡萄糖和木屑以及两者混合物能够显著降低无机氮含量,增加CO2和N2O排放,但是对于添加外源碳影响植烟土壤氮素转化的认识仍不完整。外源碳添加量与无机氮降低量之间存在何种关系?已被微生物固持的无机氮何时再矿化出来,再矿化的速率是多少?外源碳促进微生物同化作用的强度是否与其某种性质有关?这些问题有待进一步去探究和解释。此外,不容忽视的另一个问题是添加外源碳显著提高了CO2和N2O排放量,两者均为温室气体。CO2和N2O排放量的增加将给大气环境造成负面影响。因此,将添加外源碳作为调控植烟土壤氮素水平的措施时,应同时考虑其经济效益和环境成本。
另外,在种植烟草的田间条件下,烟株生长会吸收利用一部分氮素;根系分泌物也会对氮素转化产生一定影响;氮素还会发生径流、淋洗损失等。在大田环境下,土壤水分和温度也会发生不确定变化。因此,添加葡萄糖、木屑及两者混合物对氮素转化的影响可能会与室内培养试验所得结果有一定差异。所以,在大田种植烟草条件下,添加葡萄糖、木屑及两者混合物是否能够有效调控植烟土壤氮素供应需做进一步验证。
4 结 论
添加葡萄糖、木屑及二者混合物均能显著降低土壤无机氮含量。葡萄糖与木屑混施较单施木屑可以加快微生物固持氮素和提高固持强度;葡萄糖与木屑混施较单施葡萄糖可以延长微生物固持氮素的时间。添加外源碳可作为一种调控植烟土壤氮素水平的措施。但是,添加葡萄糖、葡萄糖和木屑混合物提高了微生物活性的同时也刺激了N2O排放,在实际操作中需要统筹考虑。
参考文献
[1] 李春俭,张福锁,李文卿,等. 我国烤烟生产中的氮素管理及其与烟叶品质的关系[J]. 植物营养与肥料学报,2007,13(2):331-337.
LI C J, ZHANG F S, LI W Q, et al. Nitrogen management and its relation to leaf quality in production of flue-cured tobacco in China[J]. Plant Nutrition and Fertilizer Science, 2007, 13(2): 331-337.
[2] SALEHZADEH H, GHOLIPOOR M, ABBASDOKHT H, et al. Optimizing plant traits to increase yield quality and quantity in tobacco using artificial neural network[J]. International Journal of Plant Production. 2016, 10: 97-108.
[3] FINCH C E, VANN M C, FISHER L R, et al. Lower-leaf removal and nitrogen application programs for flue-cured tobacco production[J]. Agronomy journal, 2019, 111(4): 1933-1939.
[4] HU W, TIAN S, DI Q, et al. Nitrogen mineralization simulation dynamic in tobacco soil[J]. Journal of Soil Science and Plant Nutrition, 2018, 18: 448-465.
[5] 谷海红,刘宏斌,王树会,等. 应用15N示踪研究不同来源氮素在烤烟体内的累积和分配[J]. 中国农业科学,2008,41(9):2693-2702.
GU H H, LIU H B, LI S H, et al. Study on accumulation and distribution of different sources of nitrogen in Flue-Cured tobacco plant by 15N tracer[J]. Scientia Agricultura Sinica, 2008, 41(9): 2693-2702.
[6] 劉青丽,任天志,李志宏,等. 植烟黄壤供氮特征研究[J]. 中国农业科学,2010,43(1):87-95.
LIU Q L, REN T Z, LI Z H, et al. The characteristics of nitrogen supply in Yellow soil planted with tobacco[J]. Scientia Agricultura Sinica, 2010, 43(1): 87-95.
[7] QIU S, MCCOMBA J, BELL R W, et al. Measuring microbial uptake of nitrogen in nutrient-amended sandy soils-A mass-balance based approach[J]. Soil Biology and Biochemistry, 2007, 39: 581-589.
[8] 程谊,张金波,蔡祖聪. 土壤中无机氮的微生物同化和非生物固定作用研究进展[J]. 土壤学报,2012,49(5):1030-1036.
CHENG Y, ZHANG J B, CAI Z C. A research progress on biotic and abiotic inorganic N immobilization in soils[J]. Acta Pedologica Sinica, 2012, 49(5): 1030-1036.
[9] FARREL M, PRENDERGAST-MILLER M, JONES D L, et al. Soil microbial organic nitrogen uptake is regulated by carbon availability[J]. Soil Biology and Biochemistry, 2014, 77: 261-267.
[10] PROBER S M, THIELE K R, LUNT I D, et al. Restoring ecological function in temperate grassy woodlands: manipulating soil nutrients, exotic annuals and native perennial grasses through carbon supplements and spring burns[J]. Journal of Applied Ecology, 2005, 42: 1073-1085.
[11] SZILI-KOVACS T, TOROK K, TILSTON E L, et al. Promoting microbial immobilization of soil nitrogen during restoration of abandoned agricultural fields by organic additions[J]. Biology and Fertility of Soils, 2007, 43: 823-828.
[12] MA H H, YIN Y F, GAO R, et al. Response of nitrogen transformation to glucose additions in soils at two subtropical forest types subjected to simulated nitrogen deposition[J]. Journal of Soils and Sediments, 2019,19(5):2166-2175.
[13] 朱兆良. 农田中氮肥的损失与对策[J]. 生态环境学报,2000,9(1):1-6.
ZHU Z L. Loss of fertilizer N from plants-soil system and the strategies and techniques for its reduction[J]. Ecology and Environmental Sciences, 2000, 9(1):1-6.
[14] 贾俊仙, 李忠佩, 车玉萍. 添加葡萄糖对不同肥力红壤性水稻土氮素转化的影响[J]. 中国农业科学,2010, 43(8):1617-1624.
JIA J X, LI Z P, CHE Y P. Effects of glucose addition on N transformations in paddy soils with a gradient of organic C content in subtropical China[J]. Scientia Agriculture Sinica, 2010, 43(8): 1617-1624.
[15] 贾俊仙,李忠佩,车玉萍. 添加葡萄糖对不同肥力黑土氮素转化的影响[J]. 土壤学报,2011,48(1):207-211.
JIA J X, LI Z P, CHE Y P. Effect of glucose addition on nitrogen transformation in black soils different in organic carbon content[J]. Acta Pedologica Sinica, 2011, 48(1): 207-211.
[16] HADAS A, KAUTSKY L, GOEK M, et al. Rates of decomposition of plant residues and available nitrogen in soil, related to residue composition through simulation of carbon and nitrogen turnover[J]. Soil Biology and Biochemistry, 2004, 36: 255-266.
[17] MORITSUKA N, YANAI J, MORI K, et al. Biotic and abiotic processes of nitrogen immobilization in the soil-residue interface[J]. Soil Biology and Biochemistry, 2004, 36 (7): 1141-1148.
[18] 巨晓棠,刘学军,张福锁. 尿素与DCD和有机物料配施条件下氮素的转化和去向[J]. 中国农业科学,2002,35(2):181-186.
JU X T, LIU X J, ZHANG F S. Nitrogen transformation and fate in soil under the conditions of mixed application of urea with DCD or different organic materials[J]. Scientia Agriculture Sinica, 2002, 35(2):181-186.
[19] CHENG Y, ZHANG J B, ZHU J G, et al. Ten years of elevated atmospheric CO2 doesn't alter soil nitrogen availability in a rice paddy[J]. Soil Biology & Biochemistry. 2016, 98: 90-108.
[20] CHENG Y, WANG J, Wang J Y, et al. The quality and quantity of exogenous organic carbon input control microbial NO3- immobilization: a meta-analysis[J]. Soil Biology and Biochemistry. 2017, 115: 357-363.
[21] 張乐,何红波,章建新,等. 不同用量葡萄糖对土壤氮素转化的影响[J]. 土壤通报,2008,39(4):775-778.
ZHANG L, HE H B, ZHANG J X, et al. Effect of glucose addition with different amount on extraneous nitrogen transformation in soil[J]. Chinese Journal of Soil Science, 2008, 39(4): 775-778.
[22] REICHEL R, WEI J, ISLAM M S, et al. Potential of wheat straw, spruce sawdust, and lignin as high organic carbon soil amendments to improve agricultural nitrogen retention capacity: an incubation study[J]. Frontiers in Plant Science, 2018, 9: 900.
[23] 徐鹏,邬磊,胡金丽,等. 添加葡萄糖、乙酸、草酸对红壤旱地土壤氮素矿化及反硝化的影响[J]. 环境科学学报,2017,37(12):4740-4746.
XU P, WU L, HU J L, et al. Effects of glucose, acetic acid and oxalic acid additions on nitrogen mineralization and denitrification in red upland soil[J]. Acta Scientiae Circumstantiae, 2017, 37(12): 4740-4746.
[24] 艾娜,周建斌,段敏. 不同有机碳源对施入土壤中不同形态氮素固持的影响[J]. 土壤通报,2009,40(6):1337-1341.
AI N, ZHOU J B, DUAN M. Effects of different organic carbons on nitrate and ammonium immobilization by soil microbial biomass in soil[J]. Chinese Journal of soil science, 2009, 40(6):1337-1341.
[25] OCIO J A, BROOKES P C, JENKINSON D S. Field incorporation of straw and its effects on soil microbial biomass and soil inorganic N[J]. Soil Biology and Biochemistry, 1991, 23(2): 171-176.
[26] TOROK K, SZILI-KOVACS T, HALASSY M, et al. Immobilization of soil nitrogen as a possible method for the restoration of sandy grassland[J]. Applied Vegetation Science, 2000, 3: 7-14.
[27] GU J, NICOULLAUD B, ROCHETTE P, et al. A regional experiment suggests that soil texture is a major control of N2O emission from tile-drained winter wheat fields during the fertilization period[J]. Soil Biology and Biochemistry, 2013, 60:134-141.
[28] LIU C Y, ZHENG X H, ZHOU Z X, et al. Nitrous oxide and nitric oxide emissions from an irrigated cotton field in Northern China[J]. Plant and Soil, 2010, 332(1/2):123-134.
[29] BAKKEN L R, BERGAUST L, LIU B B, et al. 2012. Regulation of denitrification at the cellular level: A clue to the understanding of N2O emissions from soils[J]. Philosophical Transactions of the Royal Society Biological, Sciences, 367(1593): 1226-1234.
[30] TILSTON E, SZILI-KOVACS T, HOPKINS D W. Contributions of labile and resistant organic materials to the immobilization of inorganic soil N when used in the restoration of abandoned agricultural fields[J]. Soil Use & Management, 2010, 25 (2):168-174.
[31] 朱霞,韓晓增,乔云发,等. 外加可溶性碳氮对不同热量带土壤N2O排放的影响[J]. 农业环境科学学报, 2009,28(12):2637-2644.
ZHU X, HAN X Z, QIAO Y F, et al. Influence of soluble carbon and nitrogen on N2O emission from different thermal zones soil[J]. Journal of Agro-Environment Science, 2009, 28 (12): 2637-2644.
[32] HUANG Y, ZOU J, ZHENG X, et al. Nitrous oxide emissions as influenced by amendment of plant residues with different C:N ratios[J]. Soil Biology & Biochemistry, 2004, 36(6): 973-981.
