Notch信号通路参与龙生蛭胶囊的抗动脉粥样硬化作用
2019-12-27秦咏王莹
秦 咏 王 莹
(山东省胸科医院药剂科,济南 250013)
动脉粥样硬化(Atherosclerosis,AS)是心脑血管疾病的重要病理基础,是一种导致斑块发展和冠状动脉进行性狭窄的炎症性疾病[1]。当人体内脂质代谢发生紊乱,引起局部炎症反应,从而导致AS发生[2]。已有研究发现Notch信号通路可调控血管新生,且阻断Notch配体可减轻代谢紊乱和动脉粥样硬化[3,4]。龙生蛭胶囊是由黄芪、水蛭、川芎等12味药组成的复合制剂,具有补气活血、化瘀通络的功效,在临床上联合其他药物对脑梗及气虚血瘀型脑梗死患者有较好的治疗效果[5,6]。龙生蛭胶囊可降低血脂,抑制炎症反应,但其作用的具体机制尚未阐述清楚[5,7]。因此,本次研究通过高脂饲料喂养构建AS大鼠模型,探讨龙生蛭胶囊是否通过调节Notch信号通路对AS大鼠产生治疗作用。
1 材料与方法
1.1材料
1.1.1动物 无特定病原体(Specific pathogen Free,SPF)级SD大鼠60只,体质量(180±20)g,购自长沙市天勤生物技术有限公司,动物许可证号:SCXK(湘)2014-0010。
1.1.2主要试剂 总胆固醇(Total cholesterol,TC)、三酰甘油(Triglyceride,TG)、低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDL-C)及一氧化氮(NO)试剂盒均购自南京建成生物工程研究所;TNF-α和IL-6 ELISA试剂盒均购自武汉华美生物有限公司;CD31抗体购自BD公司;兔抗活性Notch胞内结构域(Notch intracellular domain,NICD)多克隆抗体和兔抗Hes1多克隆抗体均购自Abcam公司;GAPDH购自Sigma公司;PVDF膜和化学发光试剂均购自Millipore公司。
1.2方法
1.2.1动物分组及模型构建[8]SD大鼠60只随机分为6组:正常组(N)、模型组(AS)、龙生蛭胶囊低剂量组(LSZ-LD)、龙生蛭胶囊中剂量组(LSZ-MD)、龙生蛭胶囊高剂量组(LSZ-HD)和辛伐他汀组(Simvastatin),每组10只。除正常组大鼠给予普通饲料喂养外,其他五组大鼠均给予高脂饲料喂养和一次性腹腔注射维生素D3(70万U/kg)。高脂饲料配方:80.8%基础饲料、3.5%胆固醇、10%炼制猪油、0.2%丙基硫氧嘧啶、0.5%胆酸钠、5%白糖。4周后开始灌胃给药处理,正常组和模型组给予等量生理盐水灌胃,低剂量组大鼠给予0.75 g/kg龙生蛭胶囊灌胃,中剂量组给予1.5 g/kg龙生蛭胶囊灌胃,高剂量组给予3.0 g/kg龙生蛭胶囊灌胃,辛伐他汀组给予5.0 mg/kg辛伐他汀灌胃,1 d/次。8周后,开始取材并检测。
1.2.2取材 给药结束后,各组大鼠禁食过夜。用戊巴比妥(30 mg/kg)对大鼠进行麻醉,打开大鼠腹腔进行腹主动脉取血,于-80℃中保存。分离并剪下1 cm的胸主动脉,置于4%多聚甲醛中固定,待检。
1.2.3生化及ELISA检测指标 将取出的腹主动脉血静置后离心分离出血清,然后根据试剂盒说明操作,采用比色法测定大鼠血清中TC、TG、LDL-C、HDL-C及NO水平。采用ELISA试剂盒检测血清中的TNF-α和IL-6含量。
1.2.4流式细胞仪检测循环内皮细胞数量 取出外周血并制成单细胞悬液,调整细胞密度后将细胞接种于96孔板中,1.5×103细胞/孔。加入5 μl CD31抗体,混匀后避光孵育30 min。PBS洗涤3次,离心收集细胞。PBS重悬细胞后进行流式细胞仪检测。
1.2.5苏木素-伊红(HE)染色观察形态学变化 取出固定的胸主动脉组织于包埋盒中进行脱水浸蜡包埋,然后切成厚度为4~5 μm的切片。脱蜡后行苏木素-伊红染色,梯度乙醇进行脱水,再用二甲苯透明,最后中性树脂封片,于显微镜下观察主动脉的形态变化。
1.2.6Western blot检测通路相关蛋白表达 提取主动脉组织总蛋白,BCA法蛋白定量后,用10% SDS-PAGE凝胶电泳分离目的蛋白。湿转法将蛋白转印至PVDF膜上,5%脱脂奶粉室温封闭2 h。加入稀释后的Ⅰ抗(NICD稀释比:1∶500;Hes1稀释比:1∶2 000),室温孵育1 h,TBST洗涤3次。加入经HRP标记的Ⅱ 抗后,室温孵育1 h,TBST洗涤3次后,加入化学发光试剂,置于暗室中曝光显影,全自动化学发光分析仪分析蛋白条带。

2 结果
2.1主动脉形态学观察 正常组胸主动脉内皮表面光滑,结构完整。模型组血管内皮细胞排列紊乱,内膜出现严重增生,有大量的泡沫细胞堆积,血管腔狭窄。经过不同剂量龙生蛭胶囊处理后主动脉内皮损伤得到改善,血管腔扩大,且高剂量组最明显,呈现一定的剂量依赖性(图1)。
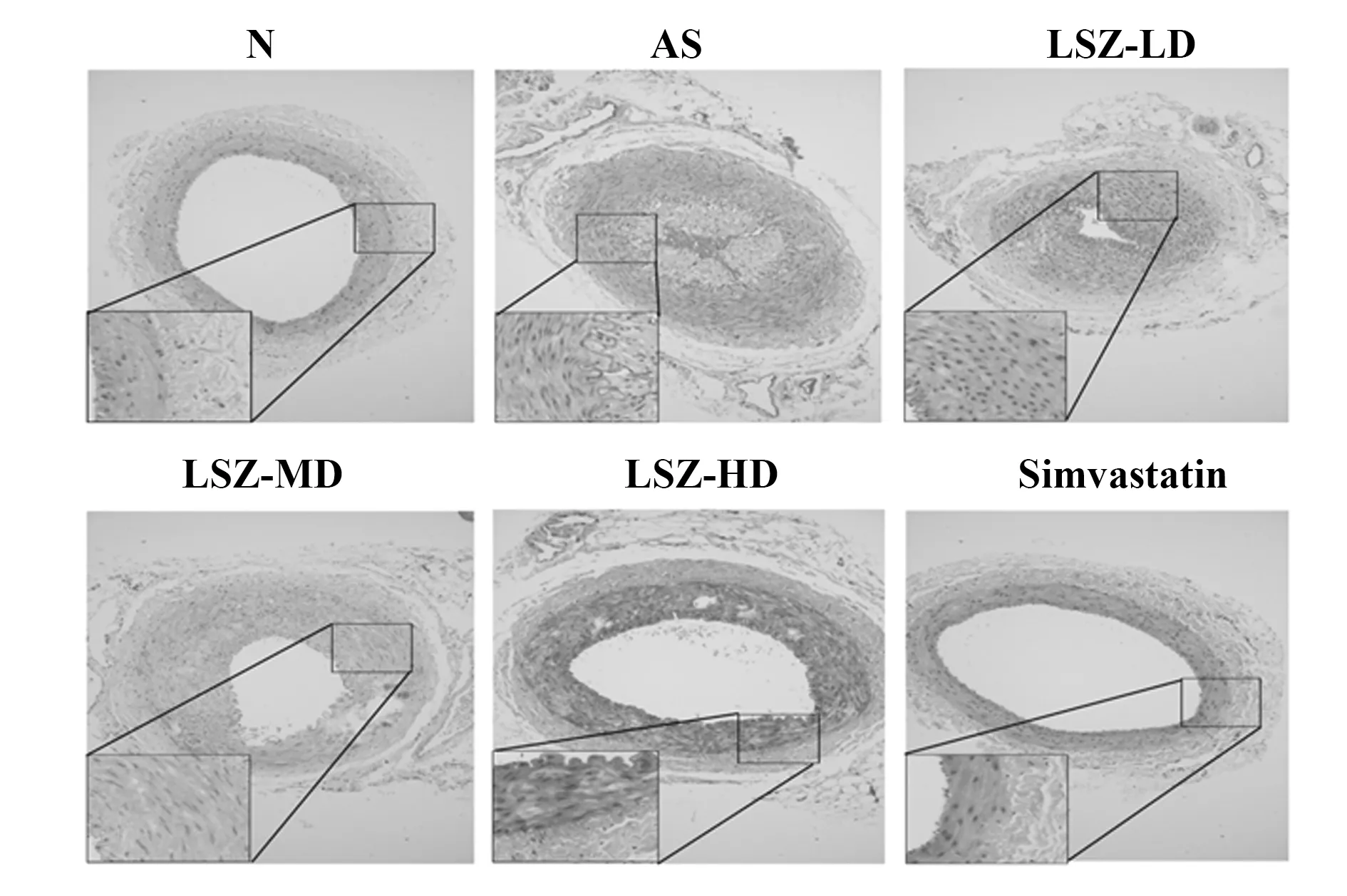
图1 主动脉HE染色(×100)Fig.1 HE staining of aorta(×100)
2.2龙生蛭胶囊对血脂水平的影响 生化实验检测各组大鼠血脂水平,结果如表1所示。与正常组比较,模型组血清中的TC、TG和LDL-C含量显著升高(P<0.01),HDL-C含量显著降低(P<0.01)。与模型组相比较,龙生蛭胶囊各剂量处理组的TC、TG和LDL-C含量降低,HDL-C含量升高,尤其是中剂量和高剂量组的改善效果更显著(P<0.01)。高剂量组与辛伐他汀组之间无明显差异(P>0.05)。
表1 龙生蛭胶囊对大鼠血脂水平的影响
2.3龙生蛭胶囊对血清炎症因子的影响 模型组大鼠血清中的TNF-α和IL-6含量均高于正常组,差异具有统计学意义(P<0.01)。而与模型组比较,各剂量给药组大鼠血清中的TNF-α和IL-6含量显著降低(P<0.01),效果最佳的高剂量组与阳性药物辛伐他汀组间的差异无统计学意义(P>0.05)。结果见表2。
表2 龙生蛭胶囊对大鼠血清TNF-α和IL-6水平的影响
2.4龙生蛭胶囊对血清NO水平及循环内皮细胞数量的影响 结果如图2和表3所示,与正常组相比,模型组大鼠血清中NO含量显著降低(P<0.01),外周血中循环内皮细胞数量显著增多(P<0.01)。与模型组相比,给予龙生蛭胶囊治疗的大鼠血清中NO含量出现明显升高(P<0.05),循环内皮细胞数量降低(P<0.05)。高剂量组和辛伐他汀组间无明显差异(P>0.05)。
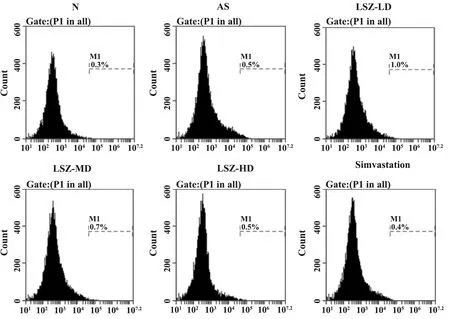
图2 流式检测循环内皮细胞数量Fig.2 Number of circulating endothelial cells was measu-red by flow cytometry
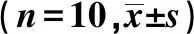
表3 龙生蛭胶囊对血清NO水平及循环内皮细胞数量的影响
2.5龙生蛭胶囊对Notch通路蛋白表达的影响 模型组大鼠的NICD和Hes1蛋白相对表达量显著高与正常组(P<0.01)。而经过不同剂量龙生蛭胶囊治疗后,AS大鼠模型的NICD和Hes1蛋白相对表达量降低,差异具有显著性(P<0.05或P<0.01)。NICD和Hes1在高剂量组和辛伐他汀组中表达量无明显差异。结果见图3。

图3 龙生蛭胶囊对NICD、Hes1蛋白表达的影响Fig.3 Effect of Longshengzhi capsule on proteins expression of NICD and Hes1Note:N.Normal group.Compared with the normal group,**.P<0.01;compared with the AS group,#.P<0.05,##.P<0.01.
3 讨论
AS的典型特征是动脉中形成动脉粥样硬化病变,即斑块,而斑块是在脂质代谢和免疫应答紊乱的背景下,由炎症反应支持而成,具有限制血流、血栓闭塞及破裂的倾向[9]。大量研究表明,血脂异常、高血压及肥胖是AS的早期干预危险因素[10,11]。且LDL-C、TC和TG水平升高易导致血管壁脂质沉积而形成斑块。因此,调节血脂是治疗AS的主要方法之一。而HDL具有抗动脉粥样硬化的功能,可抑制巨噬细胞释放炎症因子,并促进内皮细胞的自我修复[12]。在本研究中,龙生蛭胶囊可显著降低AS大鼠模型血清中的TC、TG及LDL-C含量,并升高HDL-C水平,发挥了明显的降脂作用。进一步检测了血清中TNF-α和IL-6含量,结果显示龙生蛭胶囊可显著减低TNF-α和IL-6水平。提示龙生蛭胶囊具有降低血脂,抗血管炎症的功能。
血管内皮细胞损伤及功能障碍在AS的发生发展过程中起重要作用,与早期AS发病的机制相关[13]。Gimbrone等[14]也阐述了内皮细胞功能障碍会影响凝血和血栓形成、局部血管张力和氧化还原平衡以及急性和慢性炎症反应之间的协调,是AS病变起始和进展中的关键因素[14]。NO由血管内皮细胞释放,具有扩张血管,抑制血小板黏附、聚集等功能,当内皮细胞功能发生障碍时导致NO合成减少或通路障碍,从而促进了AS的发病过程[15]。正常人体内的循环内皮细胞数量是极少的,当内皮细胞受损时,循环内皮细胞数量便会增多,是反映血管内皮损伤的标志物[16,17]。本次研究结果也显示,在AS大鼠模型血清中的NO含量降低,外周血中的循环内皮细胞数量增加,而经过龙生蛭胶囊给药处理后,NO含量升高,循环内皮细胞数量趋于正常,提示龙生蛭胶囊可改善AS大鼠的内皮细胞功能。
Notch信号通路是在进化过程中高度保守的一类通路,由受体、配体及效应物组成,不同的配体与不同的受体结合后转导的Notch信号所产生的生物学效用不同[18]。当受体胞外区和配体结合被激活后,胞内区释放出具有活性的NICD,NICD与重组信号蛋白结合后进一步激活下游靶基因Hes[19-21]。据报道,Notch信号通路参与了心血管疾病的炎症反应,从而推动了心血管疾病的病理过程[22]。Binesh等[19]的研究结果显示抑制NICD和下游靶基因Hes表达,即抑制了Notch信号通路可发挥抗AS的作用。鉴于Notch信号通路在炎症反应及AS病理中的作用,本研究中对AS大鼠模型主动脉血管组织中的NICD和Hes1蛋白表达水平进行检测,发现龙生蛭胶囊可有效地抑制AS大鼠模型的NICD和Hes1蛋白表达。
综上所述,龙生蛭胶囊可降低AS大鼠模型的血脂水平,发挥抗血管炎症反应、保护内皮细胞功能的作用,其抗AS的作用机制可能与抑制Notch信号通路有关。另外,在本次研究的HE染色结果中,龙生蛭胶囊高剂量组的作用效果稍差于辛伐他汀组,而Notch信号通路蛋白表达、炎性细胞因子及NO的水平与辛伐他汀组的差异并不明显,推测阳性药物辛伐他汀治疗AS的主要作用机制可能不是通过调控炎性细胞因子、NO等水平实现的。
