脂肪间充质干细胞中CCR7过表达对BALB/c小鼠皮片移植免疫调节的影响
2019-12-27姚翠英田治国杨云尉
陈 芳 姚翠英 田治国 杨云尉
(武汉科技大学附属天佑医院整形美容科,武汉 430064)
组织移植是整形外科中常用的组织修复方法,且随着材料学的不断发展,为组织修复提供了新的思路。但是,组织工程移植物血管化的速度相对缓慢,血管化不良在一定程度上限制了组织工程的发展。同种异体复合组织移植是临床上修复大面积或特殊部位(包括:阴茎、肢体或面部等)组织缺损的重要方法,能有效改善部位形态,成为修复重建最为理想的方法之一[1]。近年来,随着医疗技术的不断发展,冷冻同种异体手指复合组织移植术开始用于手外科,烧伤整形及美容等科室中,均能获得良好效果。但是,移植后多数患者需要长时间给予的免疫抑制剂,容易增加术后感染、糖尿病、恶性肿瘤的发生率[2,3]。因此,如何采取有效的措施降低免疫抑制剂使用剂量,减轻对机体免疫的影响成为研究的热点[4,5]。
间充质干细胞是一种多能干细胞,具有干细胞的所有特征,即自我更新和多向分化能力。目前,临床上应用相对较多,常与造血干细胞联合使用,有助于提高移植成功率,加速造血重建。临床研究表明:间充质干细胞不仅存在于骨髓中,亦可存在于骨骼肌、骨外膜与骨小梁中。而脂肪间充质干细胞是一类特殊的细胞,具有干细胞的特性,在同种异体复合组织移植后免疫调节中发挥重要的作用,但是其机制尚未知晓。CC趋化因子受体7(CCR7)属于一类趋化因子受体,配体为趋化因子配体21(CCL21)(由淋巴器官分泌生成),且能诱导、表达CCR7并趋化到脾脏等器官中[6-8]。因此,本文采用随机对照方法进行研究,探讨脂肪间充质干细胞中CCR7过表达对BALB/c小鼠异体复合组织移植早期免疫调节的作用,现报道如下。
1 材料与方法
1.1材料
1.1.1动物资料 取BALB/c小鼠5只进行脂肪间充质干细胞的提取、分离及培养,另取2017年5月~2018年1月参与实验的C57BL6与BALB/c小鼠各30只作为对象,以C57BL6小鼠作为供体获取皮片,BALB/c小鼠为受体。35只小鼠检疫合格,雌雄不限,体质量200~420 g,平均(310.63±15.66)g。动物合格证号:SCXK-(吉)2007-0003,所选动物均由医学动物实验中心提供,BALB/c小鼠常规饲养,自由摄食、饮水,光照12 h,建模前12 h禁食。
1.1.2仪器与设备 实验所需仪器与设备见表1。
1.2方法
1.2.1细胞的构建 ①脂肪间充质干细胞的分离、提取:对建模小鼠进行精确称重,腹腔注射浓度10.0%水合氯醛4 ml/kg,待麻醉生效后进行常规消毒、铺巾。在脂肪相对集中区域抽取相应脂肪2 ml,同时抽取颈动脉血2 ml,将其放置在-20℃冰箱中,备用。完成上述操作后采用PBS对抽取出的脂肪组织进行清洗,加入胶原酶液,振动,220 r/min离心15 min。采用PBS对获得的混悬液进行2次清洗,完毕后放入100 mm的细胞培养箱中培养3 d,每3 d换液1次,待细胞融合80.0%时按照1∶5比例进行细胞的扩增培养,调整细胞密度5×104ml-1,并将二代细胞放置在培养箱中继续培养,待融合90.0%后继续进行培养、传代,取第三代脂肪干细胞采用流式细胞仪测定细胞标记物CD90和CD34[9,10]。②细胞的构建:取第三代脂肪间充质干细胞,贴壁后加入10.0%胎牛血清a-MEM培养基重悬,调整细胞密度2×105ml-1,分装在12孔板中,放入培养箱中过夜。结合试验需要设置感染复数(MOI)为100,在生物安全柜中向培养基中加入CD197(CCR7)-APC(4B12)慢病毒颗粒包装试剂,为了提高转染效率可加入聚凝胺2.5 μl/ml,37℃温箱下静置,连续进行6 h 转染后首次换液。连续进行5~6 d转染后在荧光显微镜下观察细胞转染后的荧光。取传代扩增细胞,向培养基中加入浓度为4 mg/ml的杀稻瘟菌素1 μl/ml,完成转染细胞的筛选。调整细胞密度2×105ml-1,放置在EP管中,4℃避光静置20 min,利用PBS连续2次洗涤、备用,见图1。

表1 仪器与设备Tab.1 Instruments and equipment
1.2.2动物实验 ①异体复合组织移植动物模型的建立。C57BL6小鼠供体获取皮片,按照小鼠重量常规腹腔注射戊巴比妥钠(上海上药新亚药业有限公司,国药准字H31021724)5 g/L进行麻醉,待麻醉生效后进行常规消毒、铺巾,在无菌条件下采用美兰划线并标记圆形皮片直径1.0 cm,沿着划线区域完成全层皮片的剪取,给予生理盐水、纱布覆盖后备用。BALB/c小鼠受体:根据上述步骤,对BALB/c小鼠给予常规麻醉,无菌条件下在背部采用美兰划线并标记圆形皮片直径1.0 cm,根据划线区域切除皮肤及皮下组织,形成直径为1.0 cm的创面,并将C57BL6小鼠供体皮片覆盖到创面,给予4-0丝线完成缝合、固定,给予无菌棉球加压、打包覆盖,采用绷带包裹、固定,见图2。②建模后处理。建模成功后分为过表达CCR7组(CCR7组)、脂肪间充质干细胞组(干细胞组)与对照组。CCR7组建模后经尾静脉注射CCR7脂肪间充质干细胞1×106、干细胞组注射脂肪间充质干细胞1×106、对照组注射等体积生理盐水,连续进行30 d干预。
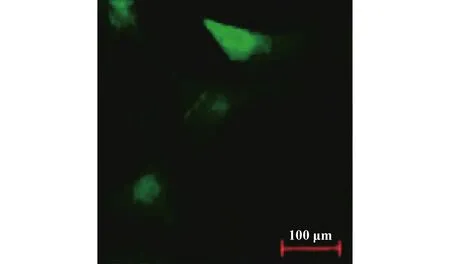
图1 荧光显微镜下细胞荧光(可见细胞荧光,转染成功)Fig.1 Cellular fluorescence under fluorescence micros-cope (visible cell fluorescence,successful trans-fection)

图2 异体复合组织移植动物模型建立Fig.2 Establishment of animal model of allogeneic composite tissue transplantationNote:A.The formation of wounds in BALB/c mice;B.The packing and sutures after transplantation of allogeneic skin grafts.
1.2.3观察指标 ①受体皮片存活面积:分别在小鼠移植后第 3、6、9及30天时进行换药,创面清理后给予塑料纸描边记录受体皮片存活的面积[15]。②HE染色:各组BALB/c小鼠30 d干预完毕后均给予断颈方式处死,取移植皮片组织,制备5 μm切片,经石蜡包埋后进行HE染色[16,17]。③细胞免疫水平:各组BALB/c小鼠30 d干预后取颈动脉血3 ml,1 129 g离心15 min,血清分离后经非特异诱导剂诱导后采用流式细胞仪测定淋巴细胞中Th17、Treg、Th1/Th2的细胞水平[18,19]。④Th1/Th2细胞因子水平:取上述分离的血清标本,采用酶联免疫吸附试验(ELISA)测定患者IL-6、IL-2、IL-10、IL-1β及肿瘤坏死因子-α(TNF-α)的水平。

2 结果
2.1三组受体皮片存活面积比较 CCR7组干预后第3、6、9及30天皮片存活面积均大于干细胞组与对照组(P<0.05);干细胞组预后第3、6、9及30天皮片存活面积均大于对照组(P<0.05),见图3和表2。
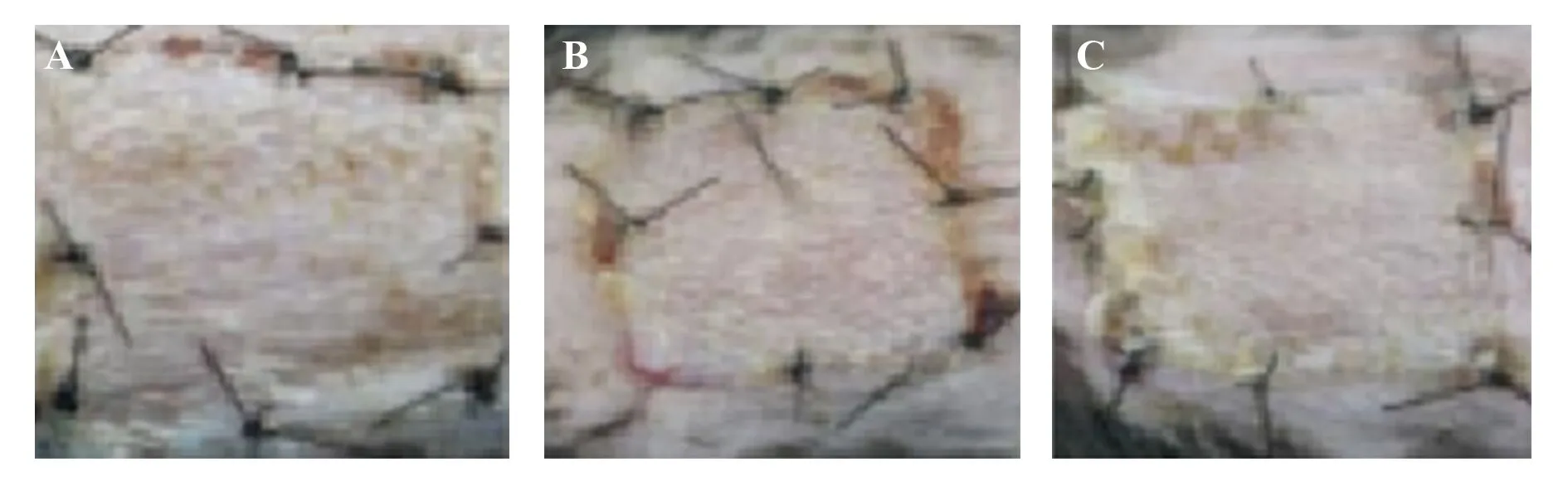
图3 三组皮瓣面积存活情况Fig.3 Survival of three groups of flapsNote:A.CCR7 Group;B.Stem cell group;C.Control group.

表2 三组受体皮片存活面积比较
2.2各组HE染色比较 HE染色结果表明:CCR7组小鼠多数存在角质层,可见毛囊等皮肤附属器官;干细胞组角质层剥脱,皮肤附属器官尚未缺失;对照组角质层剥脱且皮肤附属器官缺失,见图4。
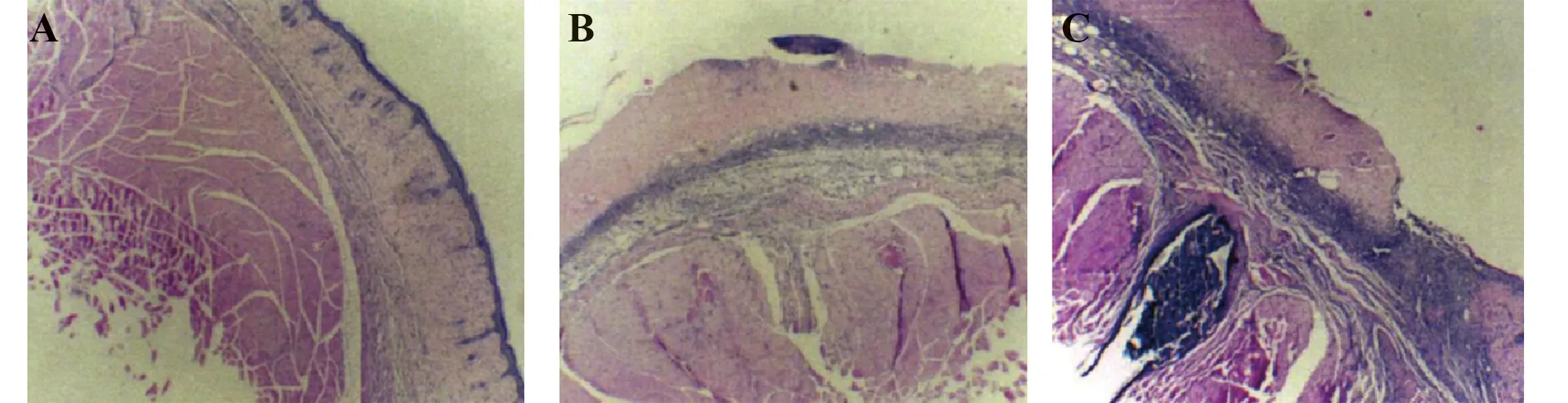
图4 各组HE染色结果比较(×200)Fig.4 Comparison of HE staining results of each group (×200)Note:A.The results of HE staining in the CCR7 group;B.The results of HE staining in the stem cell group;C.The result of HE staining in the control group.
2.3三组细胞免疫水平比较 CCR7组Th17水平均低于干细胞组和对照组(P<0.05);CCR7组Treg细胞水平高于干细胞组和对照组(P<0.05);干细胞组Th17水平低于对照组(P<0.05); 干细胞组Treg细胞水平高于对照组(P<0.05),见表3和图5。
表3 三组细胞免疫水平比较

图5 三组流式细胞图Fig.5 Three sets of flow cytometryNote:A.The CCR7 Group;B.The Stem cell group;C.The Control group.
2.4三组Th1/Th2细胞因子水平比较 CCR7组IL-6、IL-2、IL-10、IL-1β及TNF-α水平均低于干细胞组(P<0.05);干细胞组IL-6、IL-2、IL-10、IL-1β及TNF-α水平均高于对照组(P<0.05),见表4。

表4 三组Th1/Th2细胞因子水平比较
3 讨论
脂肪间充质干细胞是一种特殊的细胞,具有多向分化潜能,能在特定的调节下向其他细胞分化[20]。近年来,随着医疗技术的不断发展,临床上对于脂肪间充质干细胞诱导免疫的临床研究已取得阶段性进展,但是其免疫抑制作用机制尚未完全清除[21]。临床研究表明,脂肪间充质干细胞的免疫调节功能主要通过分泌各种细胞因子等产生抑制作用[22]。趋化因子是一种小分子家族蛋白质,在肿瘤的发生、免疫细胞的应答中发挥重要的作用[23,24]。CCR7是表达于细胞表面的趋化因子受体,而CCL21在其定向诱导表达中发挥了重要作用(淋巴结与脾脏是其主要场所)[25]。临床研究表明:过表达CCR7的脂肪间充质干细胞能在次淋巴结富集[26]。为了进一步分析过表达CCR7脂肪间充质干细胞在小鼠异体复合组织移植中的免疫作用,本研究中构建过表达CCR7细胞,并建立小鼠异体复合组织模型,动物建模成功后注射脂肪间充质干细胞1×106,结果表明:CCR7组干预后第3、6、9及30天皮片存活面积均大于干细胞组与对照组(P<0.05),说明过表达CCR7脂肪间充质干细胞用于小鼠异体复合组织模型中能获得良好的修复效果,有助于提高皮片的存活率,利于创面的愈合。同时,本文注射剂量为注射脂肪间充质干细胞1×106,该剂量既不太大,又符合小鼠需要,能获得良好的修复效果,但是对于其他剂量脂肪间充质干细胞对修复效果的影响尚需要进一步研究与探讨。
Treg是人体重要的免疫系统(视为免疫系统天然干扰器),其表达水平能抑制、降低小鼠异体复合组织移植过程中产生的排斥反应,是移植免疫的“信号灯”;而Th17属于一种辅助性T细胞,在炎症反应的发生、发展中发挥了重要的作用[27,28]。过表达CCR7的脂肪间充质干细胞能抑制CD4+细胞向炎症Th1细胞与Th17细胞分化,能充分体现免疫抑制作用[29]。本研究中,CCR7组Th17水平低于干细胞组与对照组(P<0.05);CCR7组Treg细胞水平高于干细胞组与对照组(P<0.05);CCR7组IL-6、IL-2、IL-10、IL-1β及TNF-α水平均低于干细胞组(P<0.05);干细胞组IL-6、IL-2、IL-10、IL-1β及TNF-α水平均高于对照组(P<0.05)。说明过表达的CCR7具有良好的免疫抑制作用,有助于改善机体免疫,促进移植皮片的存活,利于创面的修复。临床研究表明[30]:过表达的CCR7具有良好的归巢作用,能避免细胞在正常组织中潴留,且在次级淋巴结中能更好地发挥脂肪间充质干细胞的作用,能实现免疫细胞接触抑制,具有更强的免疫抑制作用。本研究中,HE染色结果表明:CCR7组小鼠多数存在角质层,可见毛囊等皮肤附属器官;干细胞组角质层剥脱,皮肤附属器官尚未缺失;对照组角质层剥脱且皮肤附属器官缺失,说明过表达CCR7脂肪间充质干细胞用于小鼠异体复合组织移植中有利于创面的愈合。但是,本研究仅局限于动物实验,再加上动物数量较少,获得的结论存在一定的偏倚性,均需要进一步研究与探讨。
综上所述,注射CCR7脂肪间充质干细胞1×106L-1对小鼠异体复合组织移植早期具有更好的免疫抑制作用,有助于提高受体小鼠的生存状态。
