高效液相色谱法测定饲料原料葡萄糖胺盐酸盐含量
2019-12-04商军华贤辉张浩然张亦菲田恺徐汀
商军,华贤辉,张浩然,张亦菲,田恺,徐汀
(上海市兽药饲料检测所,上海 201103)
葡萄糖胺盐酸盐是一种天然的氨基单糖,可以刺激软骨细胞产生正常多聚体结构的蛋白多糖,提高软骨细胞的修复能力,抑制产生损伤软骨的酶,促进软骨基质的修复和重建,可延缓骨关节疼痛的病理过程和疾病的进程[1]。现代工业生产中主要采用甲壳类动物和其他节肢动物的外骨骼为原料,经盐酸水解,再经活性炭脱色和干燥步骤得到其成品[2],葡萄糖胺盐酸盐已被收录于中华人民共和国农业部公告第1773号《饲料原料目录》中,其不仅广泛应用于医药及保健食品领域,而且也已在畜禽养殖业和宠物保健中得到了应用[3]。
目前医药及保健食品领域葡萄糖胺盐酸盐含量测定的国内外文献报道主要有以下几种方法:分光光度法[4]、高效液相色谱(HPLC)- 紫外检测法[5-6]、HPLC-蒸发光散射检测法[7-8]、HPLC-示差折光检测法[9]和HPLC - 荧光光度检测法[10],其中分光光度法操作繁琐费时、人为操作误差较大;采用HPLC - 蒸发光散射检测法,ELSD 的响应值与葡萄糖胺盐酸盐浓度的关系曲线,在较高浓度范围内大致呈线性,而在低浓度范围内呈指数关系;采用HPLC - 示差折光检测法,示差折光检测器的灵敏度低,不能实现梯度洗脱,对有干扰峰的样品不适用;采用HPLC-荧光光度检测法,需要衍生,操作相对复杂,消耗时间长,上述检测法的稳定性和重复性,均不如HPLC - 紫外检测法。目前,标准收载的葡萄糖胺盐酸盐原料含量测定方法主要有电位滴定法(欧洲药典9.0 版)[11]、高效液相色谱法(美国药典40 版)[12],国内尚无国家和行业标准,而质量控制的重要指标之一含量测定就非常重要,为此,本方法参考美国药典40 版,进一步优化相关条件,建立高效液相色谱法测定不同来源和批次的葡萄糖胺盐酸盐原料含量,并与电位滴定法进行了对比研究,结果表明,建立的方法具有准确、简便、专属性强的特点,可以作为饲料原料葡萄糖胺盐酸盐含量测定的质量控制方法。
1 仪器与试药
1.1 仪器 高效液相色谱仪(分离系统e2695,二极管阵列检测器PDA2998,紫外检测器2487,美国 Waters公司,配Empower 3软件);电位滴定仪(904 Titrando,瑞士万通公司);电子天平(AB135-S,瑞士METTLER TOLEDO 公司,精度为0.01 mg);纯水机(Molatom 1810A,中国重庆摩尔水处理设备有限公司)。
1.2 试药 葡萄糖胺盐酸盐对照品(中国食品药品检定研究院,批号为140649~201304,含量为100%);磷酸氢二钾(分析纯);磷酸(分析纯);乙腈(色谱纯);磷酸盐缓冲溶液(pH 7.5,称取磷酸氢二钾3.5 g,精确至0.01 g,置1000 mL容量瓶中,加水适量使溶解,加入0.25 mL氨水,用水稀释至刻度,摇匀;用磷酸调节pH值至7.5±0.2);0.1 mol/L 氢氧化钠标准滴定溶液;实验用水(电阻率>18 MΩ·cm,符合GB/T6682一级用水的规定)。饲料原料葡萄糖胺盐酸盐由国内4家典型的生产企业各提供3批(企业1的批号为201802173、201803122、201805215;企业2的批号为Y1710015、Y1710023、Y1803001;企业3的批号为20171102、20180116、20180429;企业4的批号为M1811001、M1811002、M1811003)。
2 方法与结果
2.1 色谱条件 色谱柱:C18柱(长:150 mm,内径:4.6 mm,粒径:4~5 μm);流动相:乙腈 - 磷酸盐缓冲溶液(70+30,V1+V2);流速:0.6 mL/min;柱温:35 ℃;检测波长:195 nm;进样量:10 μL。在上述色谱条件下,葡萄糖胺盐酸盐对照品溶液(4.00 mg/mL)和葡萄糖胺盐酸盐供试品溶液(4.00 mg/mL)的典型色谱图见图1,保留时间约为2.5~2.6 min,分离度大于1.5。
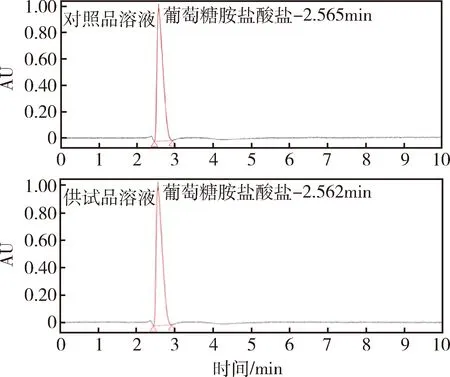
图1 葡萄糖胺盐酸盐对照品溶液和供试品 溶液的HPLC色谱图Fig 1 Chromatogram of standard solution and sample solution of glucosamine hydrochloride
2.2 溶液制备
2.2.1 对照品溶液制备 称取葡萄糖胺盐酸盐对照品约0.2 g,精确至0.1 mg,置50 mL容量瓶中,加50%乙腈溶液(V1∶V2)适量使溶解,用50%乙腈溶液稀释至刻度,摇匀;经0.45 μm滤膜滤过,滤液作为对照品溶液。
2.2.2 供试品溶液制备 称取供试品约0.2 g,精确至0.1 mg,置50 mL容量瓶中,加50%乙腈溶液(V1∶V2)适量使溶解,用50%乙腈溶液稀释至刻度,摇匀;经0.45 μm滤膜滤过,滤液作为供试品溶液。
2.3 供试品测定 分别取对照品溶液和供试品溶液,按2.1项的色谱条件操作,分别注入液相色谱仪,得对照品和供试品溶液中葡萄糖胺盐酸盐的峰面积,按外标法计算供试品中葡萄糖胺盐酸盐含量。
2.4 线性关系考察 分别称取葡萄糖胺盐酸盐对照品0.15、0.175、0.2、0.225、0.25 g,精确至0.1 mg,分别置50 mL棕色容量瓶中,加50%乙腈溶液(V1∶V2)至刻度,摇匀,制成葡萄糖胺盐酸盐浓度分别为3.00、3.50、4.00、4.50和5.00 mg/mL的对照品曲线溶液。取10 μL注入液相色谱仪,按2.1项的色谱条件操作,记录色谱峰面积,以对照品溶液的浓度(C)为横坐标,峰面积(A)为纵坐标,绘制对照品曲线,结果见表1。实验结果表明,在3.00~5.00 mg/mL浓度范围内,线性关系良好。

表1 葡萄糖胺盐酸盐的线性关系(n=3)Tab 1 Linear relationship of glucosamine hydrochloride (n=3)
2.5 精密度试验
2.5.1 重复性实验 分别取2.2.1项的葡萄糖胺盐酸盐对照品溶液(4.00 mg/mL)1份,按2.1项的色谱条件重复进样5次,检验系统测定的重复性;取201802173一批供试品,按2.2.2项的供试品溶液制备,分别制备成供试品溶液5份,按2.1项的色谱条件进样,检验供试品测定的重复性,结果见表2。实验结果表明,葡萄糖胺盐酸盐对照品峰面积的相对标准偏差(RSD)为0.02%,保留时间的相对标准偏差(RSD)为0.3%;5份葡萄糖胺盐酸盐供试品峰面积的相对标准偏差(RSD)为0.1%,系统和供试品测定重复性均良好。
2.5.2 中间精密度实验 取201802173一批供试品,分别于不同日期、不同人员和不同仪器,按2.3项的供试品测定对该批供试品含量进行双样测定,结果见表3。实验结果表明,不同日期、不同人员和不同仪器对批号201802173葡萄糖胺盐酸盐含量测定结果的RSD为0.09%。精密度较好。
2.6 稳定性试验 取2.5.1项的重复性试验中201802173一批供试品溶液,分别于0、2、4、6、8、10、12、16、24、30、36 h进样10 μL,在0~12 h,测得峰面积的RSD为0.7%;在16 h后峰面积有显著下降,说明供试品有部分降解。实验结果表明,供试品溶液在12 h内稳定。
2.7 回收率试验 分别称取已知含量的供试品约0.1 g,精确至0.1 mg,共9份,分别置50 mL容量瓶中,另分别称取葡萄糖胺盐酸盐对照品0.08 g、0.1 g和0.12 g各3份,精确至0.1 mg,依低、中、高分别置上述9个50 mL容量瓶中,加50%乙腈溶液(V1∶V2)适量使溶解,用50%乙腈溶液稀释至刻度,摇匀;经0.45 μm滤膜滤过,滤液作为供试品溶液;另取葡萄糖胺盐酸盐对照品,按2.2.1项的对照品溶液制备操作,制备成对照品溶液。分别取10 μL注入液相色谱仪,按2.1项的色谱条件操作,记录色谱图,按外标法计算测定结果,结果见表4。实验结果表明,供试品不同量的葡萄糖胺盐酸盐平均回收率为99.1%,标准偏差(SD)为0.6%,RSD为0.6%,方法的准确度较好。
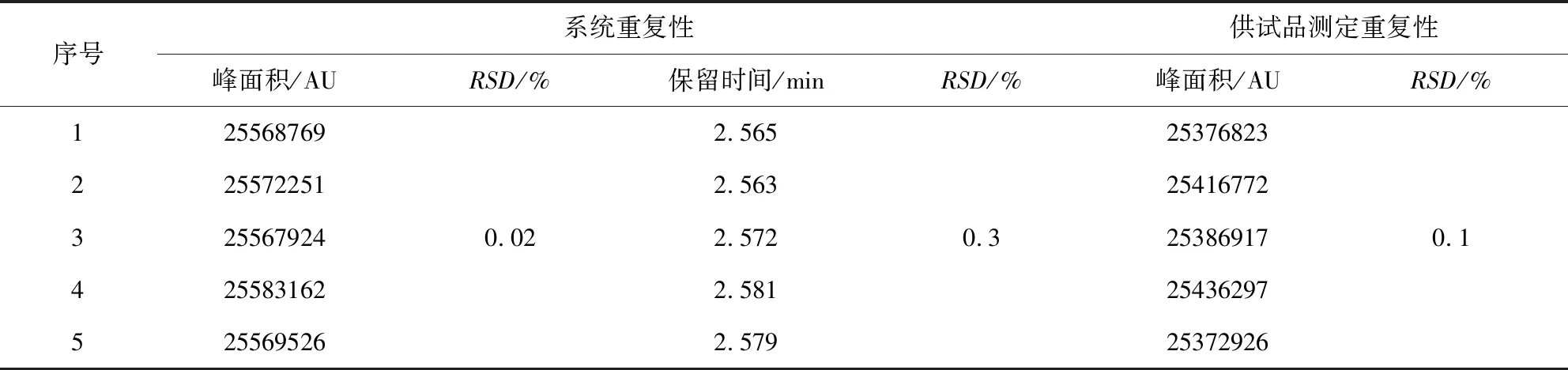
表2 方法的重复性试验结果Tab 2 Repeatability test results of the method
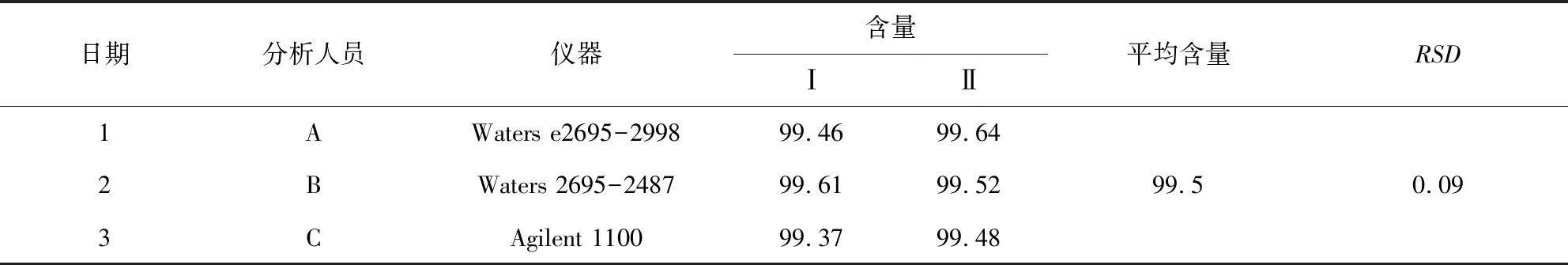
表3 方法的中间精密度试验结果Tab 3 Intermediate precision test results of the method %
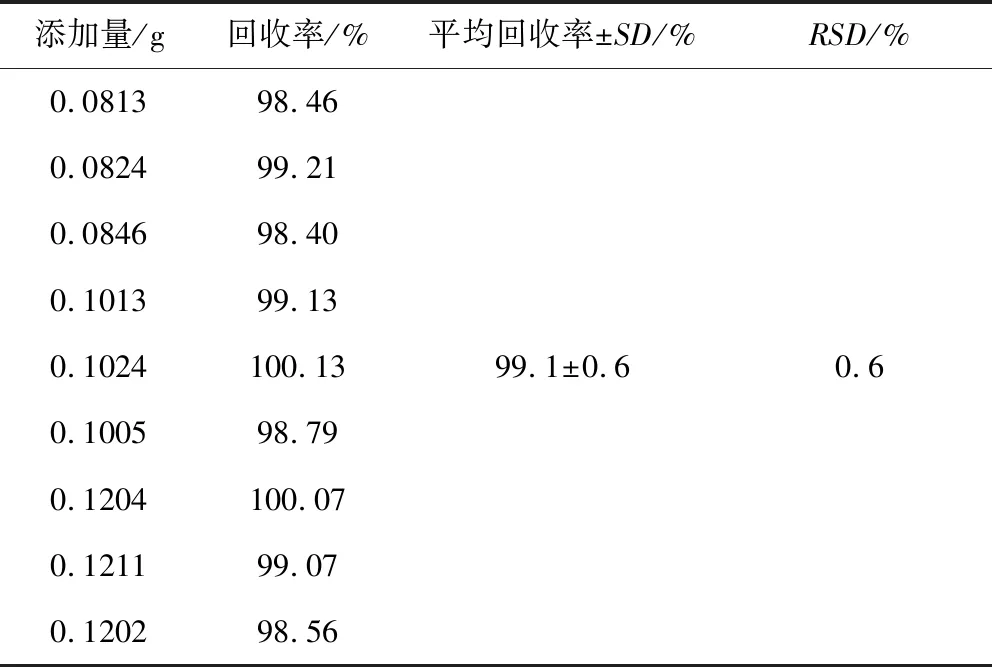
表4 回收率试验测定结果Tab 4 Method recovery test results
2.8 检测限与定量限 精密称取葡萄糖胺盐酸盐对照品0.03028 g,置10 mL容量瓶中,用50%乙腈溶液(V1∶V2)溶解稀释至刻度,摇匀。精密量取1 mL,用50%乙腈溶液(V1∶V2)逐级稀释成系列浓度,吸取10 μL注入液相色谱仪,记录色谱图。以信噪比(S/N)≥3计算为检测限,以信噪比(S/N)≥10计算为定量限。检测限为0.032 mg/mL,定量限为0.12 mg/mL。
2.9 本法与电位滴定法测定含量的比较 取批号为M1811001和Y1710015的供试品,分别按欧洲药典9.0 版的电位滴定法和本法的HPLC法进行测定,测定的结果采用双样本T进行检验,由表5和图2可知,两法测定供试品批号为M1811001和Y1710015葡萄糖胺盐酸盐含量的结果均无显著差异(P>0.05)。

表5 本法与电位滴定法测定结果比较(n=6)Tab 5 Comparison of the results of this method and potentiometric titration (n=6)
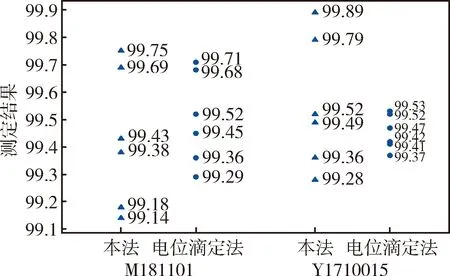
图2 本法与电位滴定法含量测定结果的分布比较图Fig 2 Comparisons of determination results between this method and potentiometric titration
2.10 不同实验室比较测定结果 分别取4家生产企业提供的饲料原料葡萄糖胺盐酸盐各3批,按本法由本实验室(Ⅰ)与4家生产企业实验室(Ⅱ)测定同批供试品中葡萄糖胺盐酸盐含量,结果见表6。实验结果表明,按本法测定饲料原料葡萄糖胺盐酸盐含量,本实验室与生产企业实验室测定的结果基本一致。
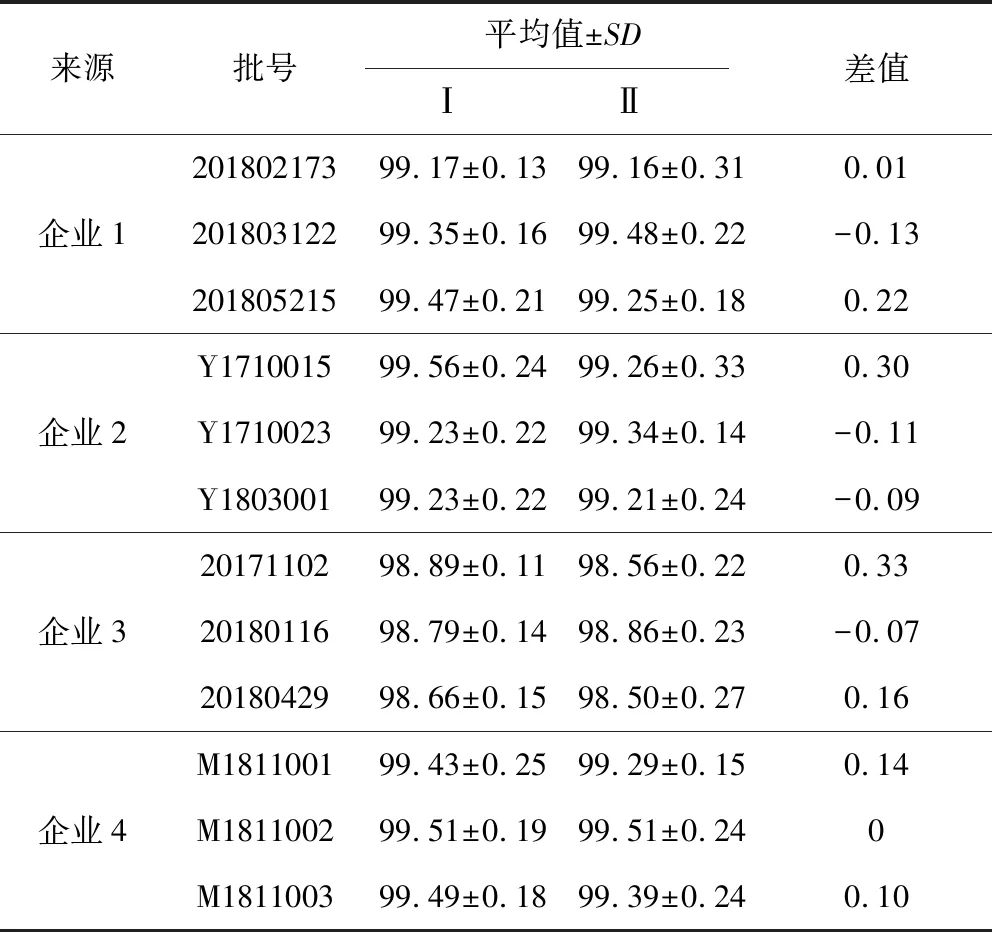
表6 供试品比较测定结果(n=3)Tab 6 Comparisons of sample determination results in different laboratories (n=3) %
3 讨论与结论
3.1 检测波长的选择 由于葡萄糖胺盐酸盐分子结构中无共轭双键,基本无紫外吸收,在195 nm和205 nm波长处具有较强的末端吸收,美国药典(40版)[12]和相关文献报道[6,13]对原料药的测定检测波长均采用195 nm,故本实验选择195 nm为本品的检测波长。
3.2 流动相与流速的优化 目前,从高效液相色谱法测定葡萄糖胺盐酸盐含量的文献报道来看,流动相组成主要有乙腈与磷酸盐缓冲液[6,12]、乙腈与乙酸铵溶液[13-14]。本研究参考了美国药典(40版),采用乙腈与磷酸盐缓冲液为组成的流动相,并优化了流动相的比例和磷酸盐缓冲液的pH值,优化结果表明,乙腈比例在65%~75%范围及磷酸盐缓冲液pH值在7.2~7.7范围时保留时间和分离效果均较好,为确保方法的耐用性,选择了乙腈比例为70%,磷酸盐缓冲液pH值为7.5±0.2,优化结果见图3和图4。美国药典(40版)采用NH2色谱柱进行分离测定,由于该型柱对葡萄糖胺盐酸盐的保留行为较强,故流速为1.5 mL/min,保留时间约为25 min,随着测定的进行,保留时间的重复性变化较大。为此本实验采用了C18柱进行分离测定,并对流速进行了优化,优化结果表明,当流速为0.6 mL/min时,葡萄糖胺盐酸盐色谱峰与供试品中的基质峰能完全分离,保留时间约为2.5~2.6 min,大大缩短了分析时间,且保留时间的重复性较好。
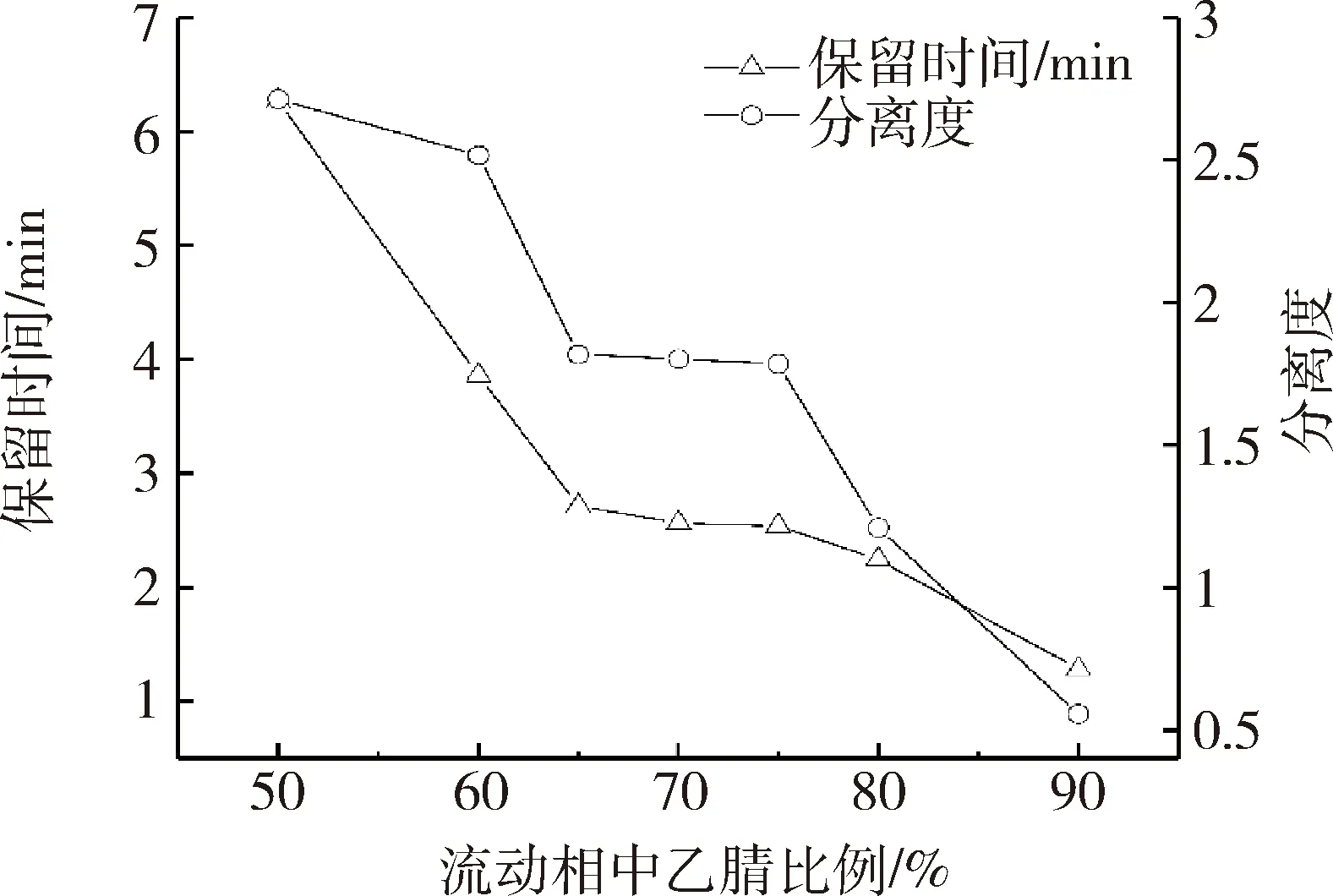
图3 流动相中乙腈比例对保留时间和分离度的影响Fig 3 Effect of acetonitrile ratio on retention time and resolution in mobile phase
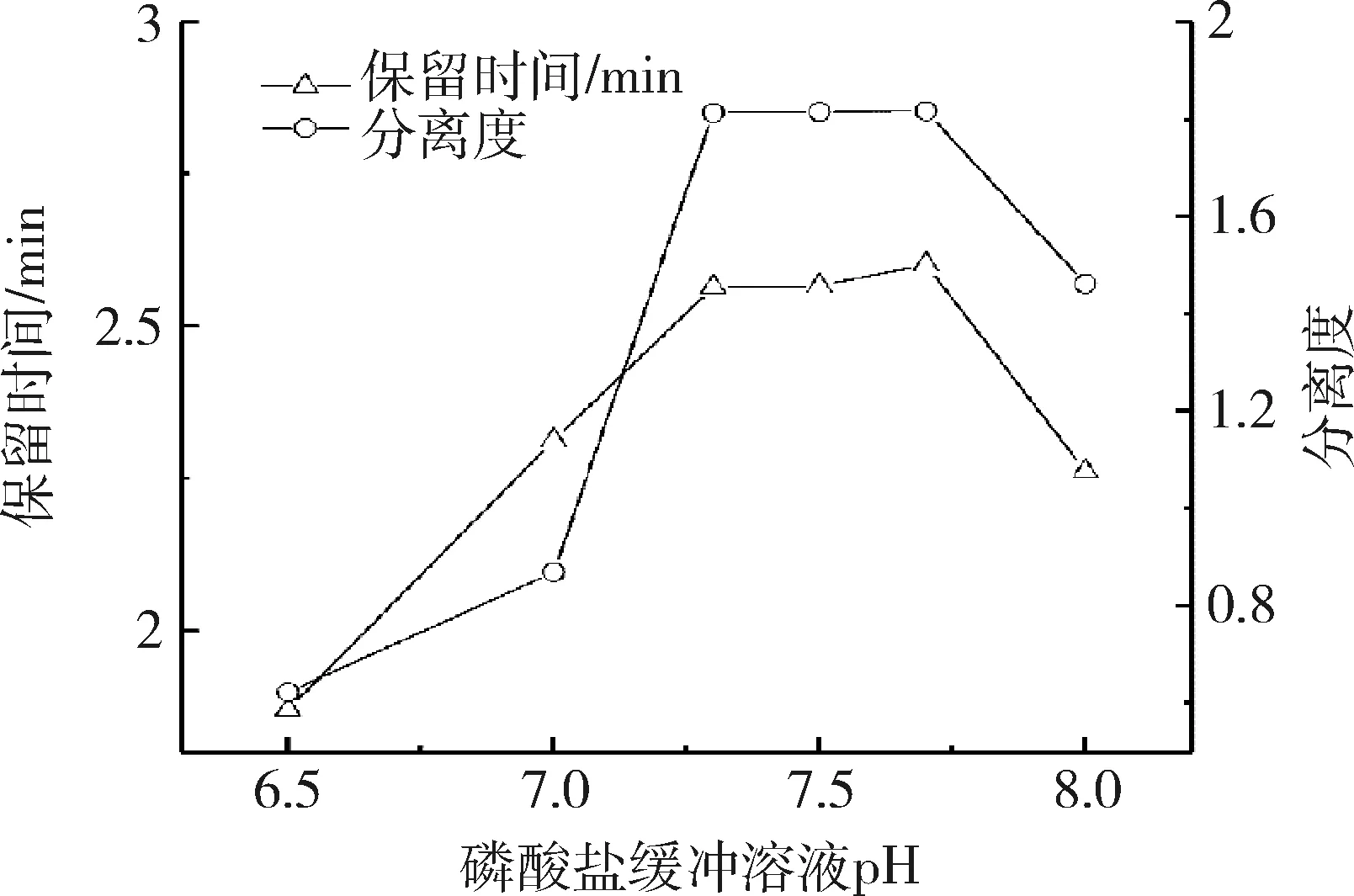
图4 磷酸盐缓冲液pH对保留时间和分离度的影响Fig 4 Effect of pH of phosphate buffer on retention time and resolution
采用高效液相色谱法测定葡萄糖胺盐酸盐含量,该方法操作简便易行、快速,方法的准确性、重复性均较好,可用于饲料原料葡萄糖胺盐酸盐含量测定的质量控制。
