用冻干菌液进行猪丹毒、多杀性巴氏杆菌病 二联灭活疫苗效力检验的研究
2019-12-04邵庆红邢佳鹏朱文革张连祥方鹏飞
邵庆红,邢佳鹏,朱文革,张连祥,方鹏飞
(北京华信农威生物科技有限公司,北京 102209)
猪丹毒病是由猪丹毒杆菌引起猪的一种烈性传染病,发现较早,分布十分广泛,世界各大洲凡养猪地区几乎都有发生猪丹毒病的报道,给养猪业造成很大损失。我国是养猪大国,过去认为猪丹毒主要发生在南方各地,但近些年东北、华北、西北等北方地区发病也较多。这主要是因为近些年对病毒病的重视,忽视了细菌病的防控,往往复杂的猪病情况和不良环境导致猪免疫力下降,给猪丹毒杆菌有机可乘。猪多杀性巴氏杆菌病与猪丹毒病类似,均属条件致病菌,在正常条件下不会导致猪发病,但在环境比较差,如闷热、寒冷、潮湿、营养缺乏、密度过大等不良条件下,导致机体免疫力下降,就会使病原繁殖,从而引起发病[1]。
疫苗接种是预防两种病发生的有效的方法。目前,市场上有减毒活疫苗、灭活疫苗,皆有良好的免疫效果。猪丹毒、多杀性巴氏杆菌病二联灭活疫苗因使用安全、易于保存、对母源抗体的影响不敏感、不受抗生素的影响且可联合免疫,得到广泛的认可[2]。
效力检验是评价猪丹毒、多杀性巴氏杆菌病二联灭活疫苗保护效果的关键参数。此产品的效力检验需要进行动物攻毒试验,在以往的检验中,质检室一直使用新鲜菌液进行攻毒试验。这就需要在检验工作中进行大量的前期准备工作,如培养基配制、菌液繁殖、活菌计数、最小致死量确定等等,检验程序繁琐,工作量大。新鲜菌液一般在效力检验攻毒前7 d制备完毕,在进行攻毒试验之前攻毒用菌液置于2~8 ℃冷藏状态中保存,但活菌数随着时间的延长而逐渐下降,从而会影响最终检验结果的准确性,而将菌液冻干更易于长期保存,也能减少检验人员的工作量[3]。本研究就冻干保存的攻毒菌与新鲜菌液进行攻毒对比试验,并对冻干菌进行保存期验证,以期能将新鲜的攻毒菌液冻干保存用于产品的攻毒保护试验。
1 材料和方法
1.1 材料
1.1.1 疫苗 猪丹毒、多杀性巴氏杆菌病二联灭活疫苗,由北京华信农威生物科技有限公司生产,批号为183602、183603,规格为20 mL/瓶,物理性状检验和安全检验及其他检验项目均合格。
1.1.2 攻毒用菌种 猪丹毒杆菌1型C43-8株(CVCC 43008)和2型C43-6株(CVCC 43006)、多杀性巴氏杆菌C44-8株(CVCC 44408)强毒菌液,基础菌种购自中国兽医药品监察所,由北京华信农威生物科技有限公司质检室自繁并鉴定合格,20%甘油,-70 ℃保存。其中,C43-6株、C43-8株同比例混合进行猪丹毒部分的效力检验,C44-8株进行猪多杀性巴氏杆菌病部分的效力检验。
1.1.3 培养基 马丁肉汤,购自中海生物科技有限公司;裂解血细胞全血,购自北京平睿生物科技有限公司。
1.1.4 冻干保护剂 5%蔗糖脱脂牛奶冻干保护剂,由北京华信农威生物科技有限公司质检室自制,经116 ℃、15 min高压灭菌处理。
1.1.5 试验动物 16~18 g清洁级小鼠,昆明系,雄性,76只,购自斯贝福(北京)生物技术有限公司;体重1.5~2.0 kg普通级兔,日本大耳白,性别不限,20只,购自北京金牧阳实验动物养殖有限责任公司。
1.1.6 小型冷冻干燥机 LABCONCO。
1.2 方法及判定标准
1.2.1 猪丹毒部分的效力检验 每批疫苗用体重16~18 g小鼠32只,分为冻干菌组和新鲜菌液组,每组设有免疫1组和免疫2组,同时设空白不免疫对照1组和对照2组。小鼠皮下接种疫苗21 d后,各免疫组和对照组分别用相应的猪丹毒杆菌混合菌液进行攻毒。攻毒后观察10 d,每组注射1000 MLD(Minimum Lethal Dose,最小致死量,简写MLD)的对照小鼠应全部死亡,注射1 MLD的对照小鼠至少死亡2只,免疫小鼠应至少保护7只[4]。具体免疫方案和攻毒剂量见表1。

表1 猪丹毒部分效力检验Tab 1 The detection of swine erysipelas
肩标*表示此组小鼠皮下注射4倍稀释的疫苗,即1份疫苗加3份40%氢氧化铝胶生理盐水的混合液
1.2.2 猪多杀性巴氏杆菌病部分的效力检验 每批疫苗用体重1.5~2.0 kg兔12只,分为冻干菌组和新鲜菌液组,每组设有免疫组和空白不免疫对照组。在疫苗接种21 d后,各免疫组和对照组分别用相应的C44-8株菌液进行攻毒,皮下注射80~100 CFU(Colony-Forming Units,菌落形成单位,简写CFU)。攻毒后观察8 d,对照组兔应全部死亡,免疫组兔应至少保护2只[4]。具体免疫方案和攻毒剂量见表2。

表2 猪多杀性巴氏杆菌病部分效力检验Tab 2 The detection of Pasteurella multocida
1.2.3 新鲜菌液的繁殖 马丁肉汤培养基按配方进行配制,分装量为200 mL/瓶,按要求进行灭菌。在灭菌合格的马丁肉汤中加入0.5%的裂解血细胞全血混匀,分别按照1.5%的比例加入C43-6株、C43-8株、C44-8株三种甘油冻存菌,在37 ℃摇床培养5~6 h,手摇菌液呈明显的云雾状停止培养。
1.2.4 新鲜菌液的保存及冻干 将停止培养的三种菌液各取出100 mL,分别加入适宜比例的蔗糖牛奶保护剂混匀分装至7 mL管制瓶,2.2 mL/瓶,放入冻干机进行21~22 h的冷冻真空干燥,置于-70 ℃保存。将剩余的菌液置2~8 ℃冰箱冷藏保存。
1.2.5 活菌计数
1.2.5.1 新鲜菌液的活菌计数 将停止培养的菌液用马丁肉汤进行倍比稀释,选择合适稀释度,平铺法活菌计数,并多次复核最终确定攻毒前活菌数。
1.2.5.2 冻干菌的活菌计数 将经冷冻真空干燥的冻干菌用1 mL马丁肉汤进行复原,并进行倍比稀释,选择合适稀释度,平铺法活菌计数,并多次复核最终确定攻毒前活菌数。
1.2.6 猪丹毒杆菌最小致死量的测定 根据新鲜菌和冻干菌的活菌数,分别将C43-6和C43-8按活菌数进行同比例混合,选择不同的菌数剂量进行小鼠攻毒试验,能使小鼠死亡的最小活菌数为猪丹毒杆菌对小鼠的最小致死量。
1.2.7 冻干菌种保存期验证试验 将冻干的猪丹毒杆菌和猪多杀性巴氏杆菌自冻干日期起保存2个月、4个月、6个月、8个月、10个月、12个月分别进行活菌计数,监测冻干菌在保存过程中的衰减情况。
2 结果与分析
2.1 猪丹毒杆菌最小致死量 将2~8 ℃保存猪丹毒杆菌的新鲜混合菌液和-70 ℃保存的冻干混合菌种分别选择4个剂量注射小鼠,小鼠死亡情况见表3。可见,新鲜菌液的小鼠MLD为3.2 CFU,冻干菌种的小鼠MLD为6.7 CFU。

表3 猪丹毒杆菌混合菌液的小鼠最小致死量Tab 3 Minimum lethal dose in mice with erysipelas mixture
2.2 活菌计数 由于新鲜菌液在停止培养7~10 d内进行活菌计数和MLD的计算且细菌的活菌计数只是一个相对值,故从表4的数据可以看出猪丹毒杆菌和猪多杀性巴氏杆菌新鲜菌液在攻毒前和攻毒时的活菌数虽有差异但并不显著。另外,冻干菌种活菌计数需要用适宜培养基复融不易再次保存,攻毒前和攻毒后也只是复核活菌数,故没有进行攻毒后的活菌数对比。表5数据表明冻干后的菌种在-70 ℃保存一年细菌计数结果稳定。

表4 活菌计数Tab 4 Live bacterial count

表5 冻干菌种保存期验证试验Tab 5 Test of lyophilized bacteria preservation period
2.3 攻毒保护试验结果
2.3.1 猪丹毒部分效力检验攻毒保护结果 两批疫苗的猪丹毒部分效力检验分别用新鲜菌液和冻干菌种进行小鼠攻毒试验,详细数据见表6。新鲜菌液组注射1 MLD剂量的对照组2小鼠全部死亡,注射1 000 MLD剂量的对照组1的小鼠全部死亡,183602批免疫组小鼠有9/10只保护,183603批免疫组的小鼠有8/10只保护。冻干菌液组注射1 MLD剂量的对照组2的小鼠全部死亡,1000 MLD剂量的对照组1的小鼠全部死亡,183602批免疫组的小鼠有10/10只保护,183603批免疫组小鼠有10/10只保护。
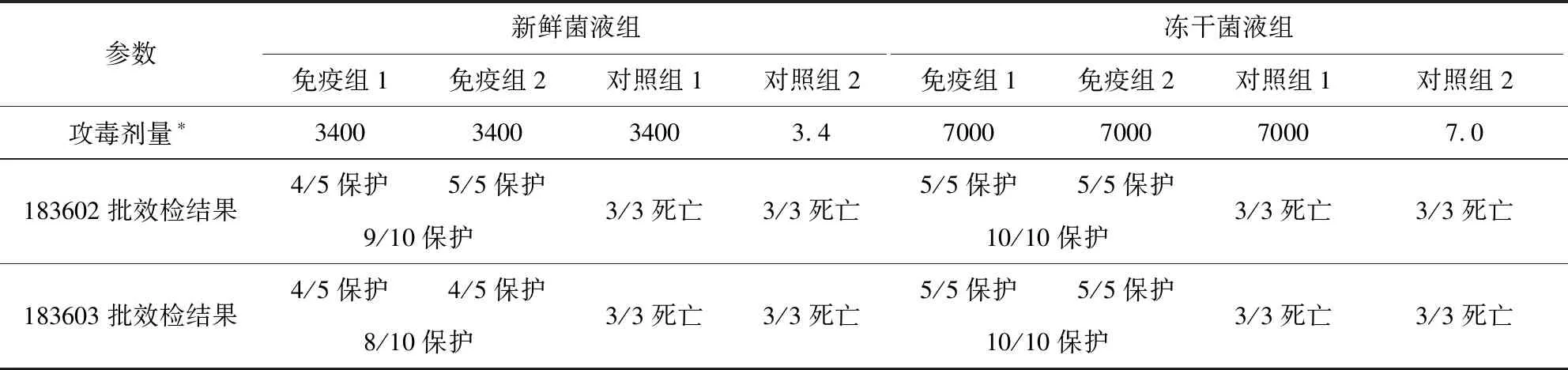
表6 两批猪丹毒部分效力检验Tab 6 The detection of swine erysipelas
肩标*表示以攻毒时活菌计数的量计算,单位是CFU
2.3.2 猪多杀性巴氏杆菌病部分效力检验攻毒保护结果 两批疫苗的猪多杀性巴氏杆菌病部分效力检验分别用新鲜菌液和冻干菌液进行兔子攻毒试验,详细数据见表7。新鲜菌液组对照组兔2/2死亡,183602批免疫组兔子3/4保护,183603批免疫组兔子2/4保护。冻干菌液组对照组兔2/2死亡,183602批免疫组兔3/4保护,183603批免疫组兔子3/4保护。
从表7数据看出新鲜菌液和冻干菌种的攻毒剂量基本一致,这是由于此产品检验标准规定为攻含活菌80~100 CFU,而C44-8对兔的最小致死量至多为10 CFU[5],故猪多杀性巴氏杆菌病部分效力检验部分无论新鲜菌液还是冻干菌种攻毒用活菌数都控制在90 CFU左右。

表7 两批猪多杀性巴氏杆菌病部分效力检验Tab 7 The detection of Pasteurella multocida
肩标*表示以攻毒时活菌计数的量计算,单位是CFU
3 讨论与结论
新鲜菌液在冷藏状态中细菌活性逐渐衰减,最佳保存时间仅为一周左右,而冻干菌种在12个月的监测期内活菌计数结果稳定,更易于长期保存[6-8],故利用冻干菌进行攻毒试验在保证攻毒菌数准确的前提下,避免了每个批次的产品检验都进行菌种繁殖、重复计数复核等工作,也降低了攻毒失败的风险,简化检验操作,提高工作效率,是值得推行的方法。
冻干菌种相对新鲜菌液有一定优势,但冻干过程可能会影响细菌体内部分酶的活性,降低细菌的活力和致病性[9-10],导致最小致死剂量会发生变化,因此应定期对冻干菌种的毒力进行监测,外加实验动物的个体差异,每次攻毒前应当测定冻干菌种对实验动物的最小致死剂量。
此研究利用两批产品的效力检验进行了冻干菌种和新鲜菌液的攻毒试验对比,冻干菌种在试验中能够达到新鲜菌液同等的检验结果。另外在长期保存过程中冻干保存的菌种活菌数稳定,可以保证对照组死亡,检验成立。初步说明将攻毒用菌液进行冻干保存用于猪丹毒、多杀性巴氏杆菌病二联灭活疫苗效检攻毒试验是可行的。
