副溶血性弧菌广谱裂解性噬菌体的筛选及其在海产品安全控制中的应用
2019-06-11郑小双饶胜其杨振泉
郑小双 ,高 璐,2,张 辉,饶胜其,2,杨振泉,2,*
(1.扬州大学食品科学与工程学院,江苏 扬州 225009;2.扬州大学 江苏省人兽共患病学重点实验室,江苏 扬州 225009;3.江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,江苏省农业科学院农产品质量安全与营养研究所,江苏 南京 210014)
副溶血性弧菌(Vibrio parahaemolyticus,Vp)是引起海产品食物中毒的主要病原菌[1-2]。该菌为嗜盐菌,主要分布于海洋动物的表面组织、海底沉积物及海水中[3-4],因此在海产食品中此菌检出率很高。食用被该菌污染的海产品后,极易引起急性肠胃炎[5]和败血症[6],随着现代海产品贸易和物流配送体系的完善,海产品的消费量逐年增加,该菌引发食源性致病菌的风 险和暴露人群也在不断升高[7-8]。传统的化学保鲜剂虽然具有良好的抑菌效果,但残留高,不利于人体健康[9]。因此,开发新型的高效、无毒、廉价的天然抑菌剂用于控制海产品养殖、加工、保藏过程中致病菌的载量,符合 人们对绿色产品的需求。噬菌体是细菌的病毒,能够专一性地裂解宿主菌,作用机理明确,具有对人体和动物安全等特点[10-11]。另一方面,噬菌体数量庞大[12],易于筛选,成本低廉,十分适合用于海产品等易腐败食品中主要病原菌的控制。
本研究以42 株不同来源致病性Vp为宿主菌,从江苏省扬州不同地点采集的污水样品中分离裂解型噬菌体,分析其形态、裂解谱、p H值及温度稳定性、抗性突变频率等生物学特征,并以人工污染的黄鱼作为模型,研究多噬菌体混合物对模拟污染黄鱼的抑菌效果,为开发广谱Vp噬菌体抑制剂提供理论支持。
1 材料与方法
1.1 材料与试剂
菌株:42 株Vp分离株均为本室分离并保存。
2216E液体、固体培养基 青岛高科园海博生物技术有限公司;TCBS琼脂 杭州滨和微生物试剂有限公 司。
SM缓冲液:NaCl 5.8 g,MgSO4·7H2O 2 g,明胶0.1 g,50 mL的1 mol/L Tris-HCl溶液(pH 7.5),蒸馏水定容1 000 mL,121 ℃灭菌备用;0.9%生理盐水由本实验室自行配制,121 ℃灭菌备用。
1.2 仪器与设备
BDY-2012 恒温摇床 上海百典仪器设备有限公司;DGX-9053B-2型生化培养箱 上海福玛设备有限公司;PHS-3C pH计 上海精密科学仪器有限公司;DICO型台式离心机 美国Thermo Fisher公司;SX-500型高压蒸汽灭菌锅 日本Tommy公司;Tecnai-12透射电镜荷兰Philips公司。
1.3 方法
1.3.1 菌株培养
将-70 ℃菌种保存液在4 ℃解冻后,取100 μL接种于5 mL 2216E液体培养基,37 ℃、150 r/min培养6 h后TCBS琼脂培养基上划线,37 ℃培养18 h,挑取单菌落接种于5 mL 2216E液体培养基中,37 ℃、150 r/min培养6 h,放置室温备用。
1.3.2 样品采集
45 份污水样品采集自江苏省扬州市3 个农贸市场,置于无菌离心管,4 ℃保存备用;新鲜黄鱼购自江苏省扬州市本地超市。
1.3.3 噬菌体的分离和纯化
将污水样品5 000 r/min离心10 min,取5 mL上清液加入5 mL 2216E液体培养基中,同时加入100 μL对数生长期的Vp宿主菌,37 ℃振荡培养8 h后5 000 r/min离心10 min,取上清液过0.22 μm滤膜,滤液经梯度稀释后与宿主菌混合倾注双层平板,37 ℃培养6~8 h检测噬菌斑。挑取单个空斑至1 mL SM缓冲液中,4 ℃过夜,用SM缓冲液倍比稀释噬菌体液,取适宜梯度加入宿主菌制成双层平板,37 ℃培养6~8 h,重复培养5次,得到纯噬菌体备用。
1.3.4 噬菌 体的电镜观察
参考文献[13],采用磷钨酸负染色法。取20 μL噬菌体悬液(效价109PFU/mL)滴于复膜铜网上,吸附10 min后取出铜网,空气中 自然干燥2~3 min;然后用2%的磷钨酸溶液进行染色,2 min后吸干水分,空气干燥5 min,用Tecnai-12透射电镜观察噬菌体形态。
1.3.5 裂解谱测定
应用点斑法测定噬菌体的裂解谱[14],取5 mL 2216E半固体培养基加入50 μL宿主菌(108CFU/mL),颠倒混匀后倾倒在固体培养基上,待凝固后,滴加噬菌体悬液(108PFU/mL)10 μL,置培养箱中培养8~12 h,观察裂解圈的形成。
1.3.6 噬菌体pH值和热稳定性测定
取100 μL 109PFU/mL的噬菌体液与pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0的2216E培养基混合,37 ℃的水浴2 h,测定噬菌体的效价,每组实验重复3 次。取0.5 mL的噬菌体(109PFU/mL),分别于50、60、70、80 ℃水浴作用20、40 min和60 min,作用结束后取样,测定噬菌体的效价,每一温度设3 个平行。取平均值用于分析噬菌体pH值和热敏感性。
1.3.7 最佳感染复数(multiplicity of infection,MOI)测定
噬菌体悬液(109PFU/mL)梯度稀释,与对数期的宿主菌液(108CFU/mL)按照MOI为0.000 1、0.001、0.01、0.1、1、10、100的比例混合,加入10 mL的2216E液体培养基中,37 ℃、150 r/min培养6 h;取1 mL培养液8 000 r/min离心10 min,取上清液测定噬菌体的效价,选择效价最高的MOI为最佳MOI。
1.3.8 一步生长曲线测定
一步生长曲线的测定采用Lu等[15]改进的方法。将噬菌体悬液(109PFU/mL)与对数期宿主菌悬液(108CFU/mL)按照MOI大于 10的比例加入 到2216E液体培养基,37 ℃恒温孵育10 min,12 000 r/min离心30 s,用2216E液体培养基洗涤沉淀3 次;然 后加入等体积预热的2216E液体培养基,37 ℃、150 r/min振 荡培养,每隔10 min取样,测定噬菌体效价(lg(PFU/mL))。以时间为横坐标、噬菌体效价为纵坐标,绘制噬菌体的一步生长曲线。裂解量按裂解末期噬菌体的效价与裂解初期宿主菌的浓度比值进行计算。
1.3.9 噬菌体不敏感突变频率的测定
参考文献[16]所述方法测定噬菌体不敏感突变频率(bacteriophage insensitive mutants frequency,BIMF)。分别取新鲜培养的Vp菌悬液(105CFU/mL)和相应噬菌体悬液(108PFU/mL)各100 μL混合,混合噬菌体BIMF测定取5 株噬菌体(107PFU/mL)制成的混悬液(VppMIX)和相应5 株宿主菌混合菌液(105CFU/mL)各100 μL混合,在混合体系中加入 CaCl2(0.01 mol/L)和MgSO4(0.01 mol/L),以不加噬菌体的Vp菌株作为对照,37 ℃静置培养10 min,梯度稀释后涂布TCBS平板上,37 ℃培养18 h,计算平皿中噬菌体抗性菌落总数(假定不敏感菌落数)。挑取所有抗性菌落,接种于2216E液体培养基,摇床培养8 h,点斑法测定培养物对噬菌体的敏感性,计算没有裂解圈的菌株总数(确定不敏感菌落数)。BIMF为确定的不敏感菌落数量与没有添加噬菌体的菌落数比值。
1.3.10 噬菌体对黄鱼中Vp的抑制作用
应用模拟污染的黄鱼肉作为模型测定噬菌体对海水鱼基质中Vp的抑制作用[17]。采集新鲜黄鱼背部肌肉,切成2 cm×2 cm的小块,先用次氯酸钠浸泡15 min,捞出沥干,无菌水漂洗5次,每次3 min,沥干备用。将鱼肉样品分为4 个处理组(每组30 块):实验组1:噬菌体处理,MOI=10 000;实验组2:噬菌体处理,MOI=100;实验组3:噬菌体处理,MOI=1;对照组:空白,没有噬菌体处理。
将5 种噬菌体液(109PFU/mL)等体积混合制成VppMIX,终体积为500 mL,梯度稀释到107PFU/mL和105PFU/mL备用。将实验组和对照组鱼块先用Vp菌悬液(105CFU/mL)浸泡10 min,捞出沥干;实验组1、2、3鱼块分别置于109、107、105PFU/mL噬菌体悬液中浸泡10 min,捞出沥干,装入聚乙烯薄膜袋中;将对照组鱼块置于等体积的生理盐水中浸泡10 min,沥干后装入聚乙烯薄膜袋中。将所有鱼块放置25 ℃进行恒温贮藏。分别在0、2、4、6、8 、10、12、18、24 h取鱼块,均质后,用生理盐水梯度稀释,涂布TCBS平板,37 ℃培养18 h,人工计数菌落总数(lg(CFU/mL)),每组实验重复3 次,比较不同处理组的抑菌效果。
1.4 数据处理
采用S P S S 1 7.0软件对 数据进行方差分析(ANOVA),P<0.05,差异 显著;并用Origin 8.5作图。
2 结果与分析
2.1 噬菌体分离纯化
从扬州市3 个农贸市场的45 份污水样品,以42 株Vp菌株作为宿主菌,从其中10 份样品中分离到15 株烈性噬菌体,噬菌斑裂解圈直径在1~2 mm之间,存在清澈透明、浑浊、透明圈外有晕环等形态;筛选其中裂解图清澈透明(图1)5 株噬菌体(编号为VppYZU64、VppYZU68、VppYZU81、VppYZU92、VppYZU110)进一步研究。

图1 1 VpVp噬菌体的噬菌斑Fig. 1 Morphology of Vp phages plaques
2.2 噬菌体的微观形态

图2 2 VpVp噬菌体透射电镜照片Fig. 2 Transmission electron micrographs of Vp phages
图2透射电镜结果显示5 株噬菌体呈现不同的微观形态。VppYZU64头部呈长多面体对称,直径约为90.9 nm,尾部长约136.4 nm;VppYZU68头部为正多面体结构,直径约为63.6 nm,尾部长约115.2 nm;VppYZU92头部为69.2 nm的正多面体结构,有细长而柔软的尾部,长度约为200 nm。根据国际病毒分类委员会第九次报告所提出的分类准则[18],这3 种噬菌体属于长尾噬菌体科(Siphoviridae)。VppYZU81头部呈正多面体结构,直径约为55 nm,没有尾部,属于盖噬菌体科(Corticoviridae);VppYZU110头部呈正多面体结构,直径约为87.1 nm,尾部 长约93.1 nm,外围有一个收缩性的尾鞘,属于肌尾噬菌体科(Myoviridae),结果显示了Vp烈性噬菌体存在形态多样性。
2.3 噬菌体的裂解谱
应用点斑法测定5 株及其混合悬液噬菌体(VppMIX)对42 株Vp菌株的裂解谱(表1),结果显示不同噬菌体分离株具有不同的裂解范围。噬菌体VppYZU68能裂解5 个Vp菌株;VppYZU64能裂解17 个Vp菌株;VppYZU81可以裂解24 个Vp菌株;VppYZU92可以裂解10 个Vp菌株;VppYZU110能裂解23 个Vp菌株。5 株噬菌体混合物VppMIX裂解谱覆盖了所有Vp菌株。噬菌体对Vp种内菌株的裂解性与菌株来源和毒力基因型并未发现相关性。
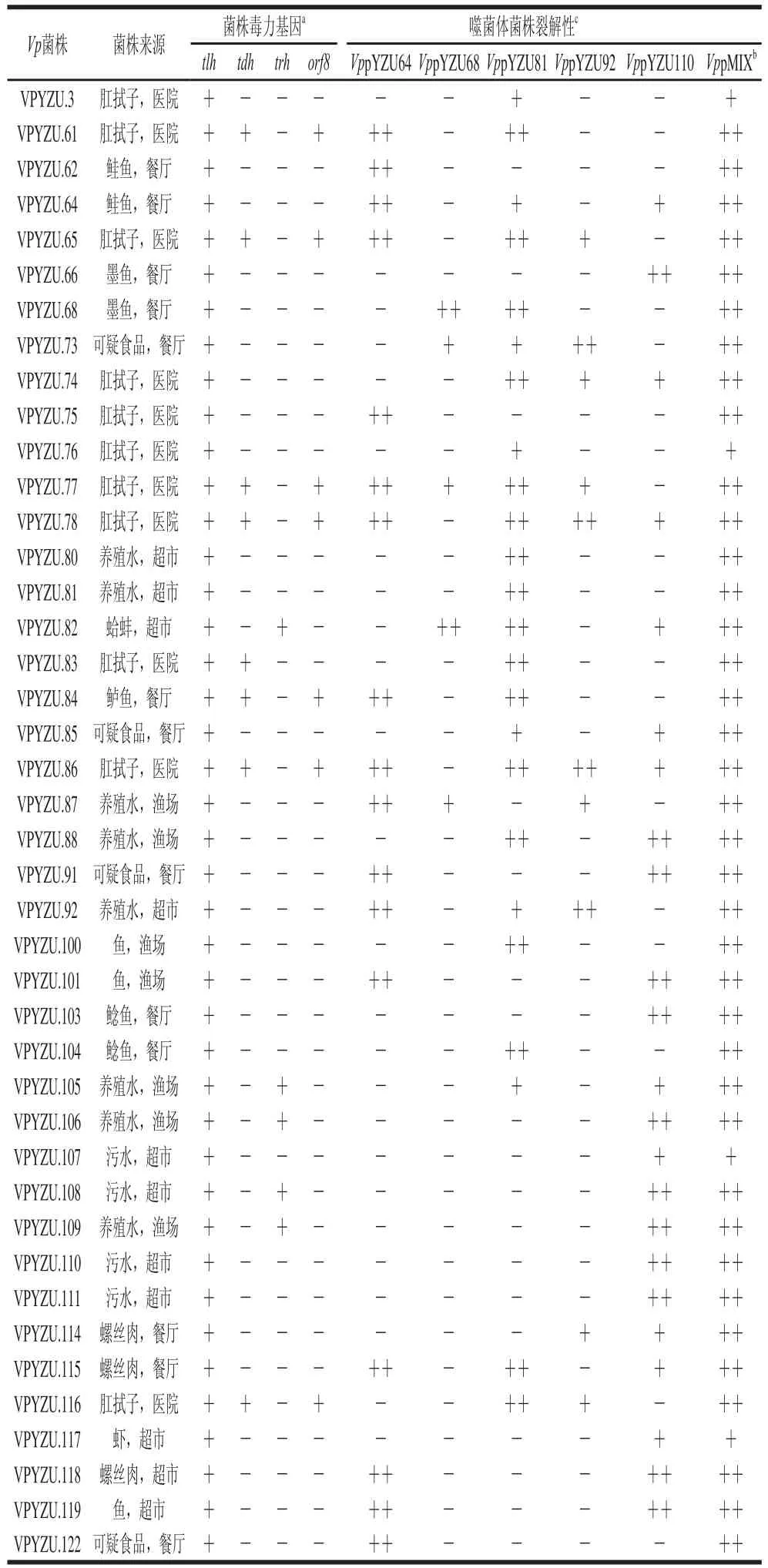
表 11 VVpp噬菌体裂解谱Table 1 Lysis spectrum of Vp p haaggeess
2.4 pH值对噬菌体活性的影响


图3 Vp噬菌体的pH值稳定性Fig. 3 pH stability of Vp phages
如图3所示,pH值对噬菌体的活性具有影响,5 株噬菌体在pH 4~10之间保持较高活性;当pH值超过10时,效价均呈现不同程度下降。VppYZU64在pH 10~12时,效价下降了2.2(lg(PFU/mL))(图3A)。VppYZU92在pH 9~12时,效价下降了2.0(lg(PFU/mL))(图3D);VppYZU110在pH值为12时,效价降到0(lg(PFU/mL))(图3E),呈现较高的碱不稳定性。所有噬菌体在pH值不大于3或大于13时,效价均为0。
2.5 温度对噬菌体活性的影响
图4结果显示,所有噬菌体在50 ℃作用60 min效价保持不变;在60 ℃作用40 min以后,效价缓慢下降;在70 ℃作用,效价均急剧下降,其中VppYZU1 10在20 min后已经完全失活(图4E);大多数噬菌体对80 ℃处理敏感,VppYZU68、VppYZU92在20 min后已测不出活性(图4B、D),但VppYZU64和VppYZU81在80 ℃处理20 min时仍保持微弱活性(图4A、C)。

图4 噬菌体的热稳定性Fig. 4 Thermal stability of Vp phages
2.6 噬菌体的最佳MOI
以不同浓度(103~108PFU/mL)噬菌体感染Vp宿主菌(106CFU/mL),测定培养后噬菌体效价,测定的最佳MOI如表2所示。结果显示:VppYZU64、VppYZU68、VppYZU81、VppYZU92、VppYZU110的最佳MOI分别为0.1、0.001、1、0.1、0.1。
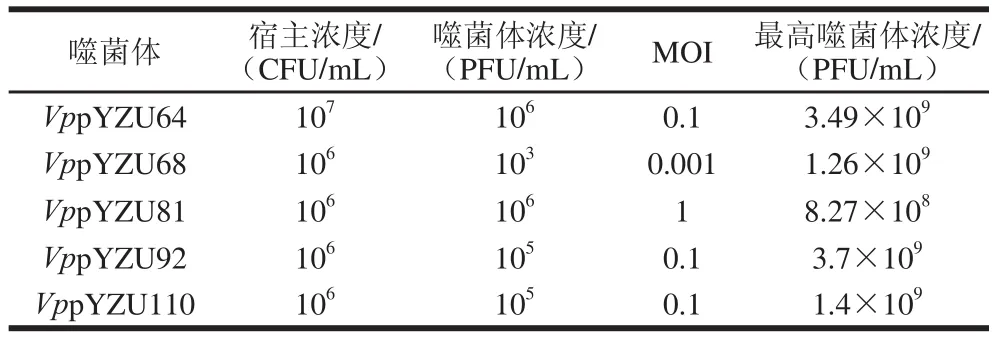
表2 Vp噬菌体的最佳MOITable 2 Optimum MOI of Vp phages
2.7 噬菌体的一步生长曲线
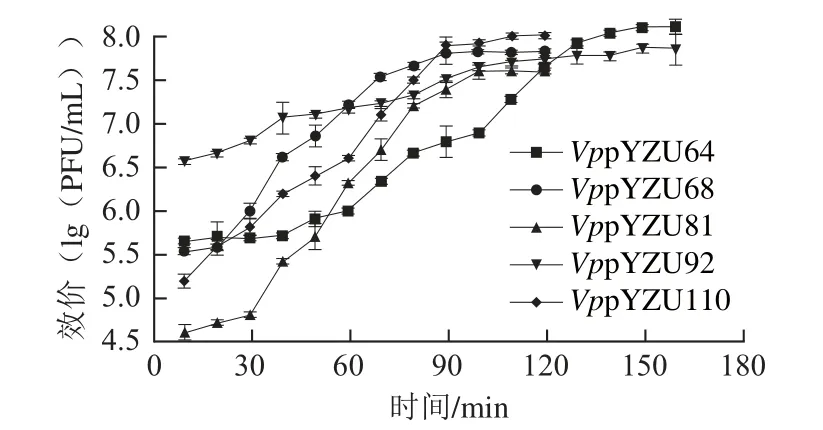
图5 5 VpVp噬菌体一步生长曲线Fig. 5 One-step growth curve of Vp phages
如图5所示,所有噬菌体的增值规律均呈典型的S型曲线,具有明显的潜伏期、爆发期和平台期。根据一步生长曲线估算的噬菌体的潜伏时间、爆发时间和裂解量结果如表3所示,VppYZU64裂解量最高达到150 PFU/cell,但潜伏期较长为40 mi n,VppYZU68、VppYZU81裂解量分别为87、20 PFU/cell,潜伏期分别为20 min和30 min,VppYZU92、VppYZ U110显示了较短的潜伏期,均为10 min,裂解量分别为35 PFU/cell和58 PFU/cell。

表 33 VVpp噬菌体的裂解特征Table 3 Lysis properties of Vp phaaggeess
2.8 噬菌体BIMF
不敏感突变体的出现,降低了噬菌体裂解宿主菌的能力,通常与细菌细胞表面编码受体分子的基因点突变有关[19],多糖等的产生遮蔽了受体,从而抑制噬菌体吸附。测定5 株噬菌体及其混合物的BIMF,结果如表4所示。单一噬菌体的BIMF差异性较大;VppYZU81比VppYZU64的BIMF高100 倍,这种差异可能是由于噬菌体的吸附受体不同[20-21]。VppMIX的BIMF值最小,为3.50×10-6,显著低于单一噬菌体。结果表明噬菌体混合物可以克服噬菌体抗性突变体的生长缺陷。
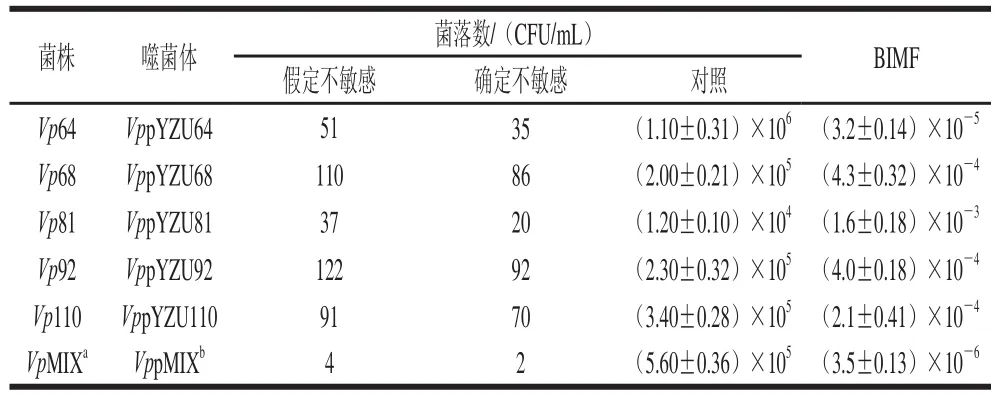
表4 不同噬菌体BIMFTable 4 Frequencies of Vp spontaneous phage resistant mutants
2.9 VppMIX对海鱼中致病性Vp的抑制作用
应用Vp模拟污染的黄鱼作为模型评价VppMIX对Vp的抑制效果,结果如图6所示。Vp菌悬液污染的鱼片25 ℃保存5 h,菌落数由起始的4.13(lg(CFU/g))上升到5.60(lg(CFU/g)),而VppMIX处理的鱼片中Vp总数下降至2.0(lg(CFU/g))(MOI=1,实验组3)、1.35(lg(CFU/g))(MOI=100,实验组2)以及0.93(lg(CFU/g))(MOI=10 000,实验组1);在25 ℃贮藏12 h,噬菌体处理组的Vp总数分别达到7.51(lg(CFU/g))(MOI=1,实验组3)、5.40(lg(CFU/g))(MOI=100,实验组2)以及3.94(lg(CFU/g))(MOI=10 000,实验组1),均显著小于对照组8.92(lg(CFU/g))(P<0.01)。结果表明高浓度噬菌体混合物VppMIX可以有效抑制鱼片中多个致病性Vp株的生长,高浓度处理更有利于Vp的失活。

图6 混合噬菌体VppMIX在模拟污染鱼块中的抑菌效果Fig. 6 Inactivation of Vp in arti ficially contaminated fish fillet by phage cocktail VppMIX
3
讨 论
噬菌体在食品及公共环境领域控制病原菌污染及危害具有良好的应用前景[22]。分离筛选广谱高效的噬菌体分离株对构建高效的生物减菌剂具有重要价值。本研究从污水样品中筛选致病性Vp的烈性噬菌体,获得了5 株噬菌体具有较宽的抑菌谱及良好的耐热能力,以及较广的pH值生存范围,为进一步研发食品加工温度和酸碱度下噬菌体减菌剂提供了分离株。
噬菌体大量存在于含有其宿主菌的环境中,目前分离到的Vp噬菌体形态主要属于肌尾噬菌体科[23]、长尾噬菌体科[24]、短尾噬菌体科[25]。本研究发现5 株噬菌体分离株分别属于这3 个科,且针对同一个Vp宿主菌株的噬菌体存在不同形态,同一噬菌体可以对不同毒力基因型和来源的Vp产生裂解活性。查涛等[26]研究发现噬菌体对不同血清型宿主菌表现出不同的裂解特征,产生不同形态的噬菌斑,但本研究中并未发现裂解特征与菌株基因型具有明显相关性。结果表明自然界Vp噬菌体存在高度多样性,其裂解性与宿主菌来源无关[27]。
不敏感突变体的出现直接影响噬菌体的抑菌效果,不同噬菌体单株产生抗性突变频率(BIMF)变化很大,而噬菌体混合物的应用可以有效降低BIMF[28],扩大裂解宿主范围。O’Flynn等[20]研究表明较低的BIMF(10-6)并不影响将噬菌体用作生物控制剂,这与本研究的结果一致。本研究构建的5 株Vp烈性噬菌体混合制剂VppMIX,不敏感突变株的产生频率降低到10-6以下,对42 株Vp菌株均具有裂解作用,拓宽了抑菌谱。Alagappan等[29]得到了相似的结论,与单独使用相比,3 株Vp噬菌体混合物明显降低了虾的死亡率。本研究鱼肉抑菌实验结果表明,VppMIX可以在25 ℃贮藏温度下有效抑制鱼肉基质中Vp增殖,并且生物抑菌效果呈剂量依赖性,与文献报道一致,较高的噬菌体浓度通常会导致更多的细菌失活[30-31]。
