不同大分子乳化剂构建番茄红素纳米乳液的体外消化规律比较
2019-06-11洪泽翰吴婉仪解新安
洪泽翰,吴婉仪,李 璐*,李 雁,解新安
(华南农业大学食品学院,广东 广州 510000)
番茄红素是类胡萝卜素的一种,外观呈深红色晶体,广泛分布在各种成熟生果蔬菜中[1]。相关研究证实,番茄红素在防治疾病、提高机体健康水平方面的功能活性主要是通过防止人体细胞被氧化来实现[2]。但其结构中存在多个不饱和双键直接导致番茄红素易受光照、温度、氧气、酸碱度、金属离子及催化剂的作用而发生氧化分解,使其在应用中具有一定困难。作为一种载运体系,纳米乳液技术可用来改善这类营养素的水分散性和稳定性,提高生物利用率,因而引起医药、食品领域研究者的广泛关注[3]。近年来,许多学者尝试将番茄红素包埋于纳米乳液中,研究乳化-蒸发法或高压均质法等不同的构建方式及条件[4-5];研究不同种类的乳化剂和油水比[6-7]等对番茄红素纳米乳液稳定性和生物利用率等的影响,结果表明纳米乳液可显著提高所包埋番茄红素的稳定性和物利用率,如Ho等[6]发现通过纳米乳液负载,番茄红素在避光4 ℃贮藏14 d后的保留率可达到65%以上;Amiri-Rigi等[7]使用辅助表面活性剂从番茄工业废物中回收番茄红素,回收率可达35%,效率提高6 倍;Ha等[8]发现通过纳米乳液包埋,番茄红素的生物利用率从1%提高到53%。
在构建稳定的纳米乳液时,乳化剂起着非常重要的作用,它需要在乳液体系中显示出良好的表面活性和产生低界面张力,以及单独或与已经在界面吸附的组分形成界面膜[8-9]。虽然相关的毒性报道并不常见,但为避免小分子表面活性剂使用时带来的潜在毒性,选择较为安全的生物兼容大分子乳化剂,是目前构建纳米乳液的重要发展方向。利用辛烯基琥珀酸酐改性后得到的辛烯基琥珀酸酯化(octenyl succinic anhydride,OSA)变性淀粉被美国食品药品监督管理局认证为安全乳化剂,不仅价格便宜,且受体系离子强度及酸碱度影响小,具有很好的乳化稳定性和乳化活性[10]。而蛋白类乳化剂的主要代表有乳清分离蛋白(whey protein isolate,WPI)、酪蛋白酸钠(sodium caseinate,SC)等,它们均具有良好的乳化能力,能有效地降低油水界面张力,且来源十分安全,因此这些乳化剂被广泛应用于负载营养物的纳米乳液的构建[11]。有研究表明乳化剂种类是影响纳米乳液消化特性的重要因素,伴随着人体消化道内不同部位复杂的物理化学和生物学条件如pH值、离子强度、消化酶、剪切力等[12-15],纳米乳液的结构和所运载的营养素的存在形式都会发生显著变化,并对乳液的生物学效应和生物安全性产生影响,因此研究不同乳化剂所构建纳米乳液的消化规律是非常有必要的,然而相关研究并不多见,对淀粉类和蛋白质类乳化剂消化规律的比较更是鲜见报道。
本研究以生物大分子OSA变性淀粉、WPI和SC为乳化剂构建番茄红素纳米乳液,详细分析3 种大分子乳化剂制得乳液在口腔、胃、肠消化过程及胶束消化液中粒径、Zeta电位的变化,比较体外消化后游离脂肪酸释放率以及番茄红素的生物利用度的变化规律,以期为选用生物大分子乳化剂构建纳米乳液用于番茄红素等生物活性物质的运输提供理论支持。
1 材料与方法
1.1 材料与试剂
OSA变性淀粉 广东佛山德峰淀粉糖业有限公司;WPI、SC 广州市齐云生物技术有限公司;中链甘油三酯(medium chain triglycerides,MCT) 广州耶尚贸易公司;番茄红素(纯度90%)、尿素、尿酸、α-淀粉酶(4 000 U/g)、胰脂酶(30 000 U/g)、胃蛋白酶(USP级,1∶3 000)、猪胆酸盐、糖化酶(100 000 U/g)、尼罗红 上海源叶生物科技有限责任公司;其他常规分析纯级试剂购自广州化学试剂厂。
1.2 仪器与设备
Scientz-150型高压均质机 宁波新芝生物科技股份有限公司;FJ200型高速分散均质搅拌器 上海弗鲁克流体机械制造有限公司;HJ-6B型多头数显恒温磁力搅拌器 常州市万合仪器制造有限公司;ZetasizerNano ZS90型纳米粒度及Zeta电位分析仪 英国Malvern公司;Centrifuge5804 R型离心机 德国Eppendorf股份公司;DL55型滴定仪 美国Mettler Toledo公司;780 Live型激光扫描共聚焦显微镜 德国蔡司公司。
1.3 方法
1.3.1 负载番茄红素的纳米乳液体系的构建
在课题组前期工作的基础上[5],以3 种乳化剂的较优使用量分别构建番茄红素纳米乳液,具体如下:以去离子水或磷酸盐缓冲溶液(pH 7.0)作为连续相,以MCT油为载体油构建负载番茄红素的O/W纳米乳液体系。不同乳化剂体系的连续相处理方式不同:淀粉连续相为将30%(质量分数)OSA变性淀粉分散在去离子水中,溶解温度和溶解时间为70 ℃和15 min,而后在室温(25 ℃)100 r/min磁力搅拌过夜(12 h);而蛋白质类连续相为1% WPI(质量分数)及2% SC(质量分数)分散在磷酸盐缓冲溶液中,并在室温(25 ℃)100 r/min磁力搅拌4 h,而后在4 ℃的冰箱中贮藏过夜(12 h)。分散相制备方法均为在温和加热(小于5 min,50 ℃)条件下,在MCT油中分散载量为0.2%(质量分数)的番茄红素标准品,100 r/min磁力搅拌1 h以确保其完全溶解。然后将连续相与分散相按9∶1的比例混合,磁力搅拌均匀后在高速分散机上以10 000 r/min分散5 min制得粗乳液,再将制得的粗乳液通过高压均质机在110 MPa下循环均质3 次以形成O/W纳米乳液。为保护对光热敏感的番茄红素,在制备纳米乳液过程中使用锡箔以保证其最小化暴露于光。
1.3.2 模拟消化道的构建
根据人体和动物消化道的构造,构建3个阶段模拟消化道[16],包括模拟口腔、模拟胃和模拟肠阶段。
模拟口腔消化阶段:称取4 mL纳米乳液样品与4 mL模拟口腔液(含0.896 g/L KCl、0.2 g/L KSCN、0.888 g/L NaH2PO4、0.57 g/L Na2SO4、0.298 g/L NaCl、1.694 g/L NaHCO3、0.2 g/L尿素、0.015 g/L尿酸和0.6 g/L α-淀粉酶)混合,稳定温度在37 ℃,调节pH 7.0,并在100 r/min下搅拌3 min以模拟口腔消化[17]。
模拟胃消化阶段:配制10 mL模拟胃液(含2 g/L NaCl和2 g/L胃蛋白酶)。在纳米乳液样品于模拟口腔液中消化3 min后,将提前制备的模拟胃液加入其中,然后用0.1 mol/L的HCl溶液调节体系pH值至2.0,同时稳定消化液温度为37 ℃。调节pH值后,将消化液样品置于100 r/min条件下模拟胃液消化1 h[18]。
模拟肠液消化阶段:消化液样品在经过模拟胃消化阶段1 h后,使用0.25 mol/L的NaOH溶液将体系pH值调节到7.0。配制15 mL的模拟肠液(含0.244 2 g/L CaCl2、140 U糖化酶、44 g/L猪胆酸盐和2.2 g/L胰脂肪酶),加入到经过模拟胃阶段消化1 h后的纳米乳液消化液体系中,置于100 r/min条件下均匀搅拌,进行模拟肠阶段2 h的消化。在此消化过程中,根据pH-stat法,利用滴定仪不断加入0.25 mol/L的NaOH溶液,使消化液pH值稳定在7.0,同时稳定消化液温度为37 ℃。记录滴定过程中随时间的变化、消化液所消耗的NaOH溶液量[19-20]。消化液样品经过模拟消化的第3阶段即模拟肠消化2 h后,平行取样置于离心管中,10 000 r/min离心15 min。离心后的样液分为3 层:最上一层是由未消化油形成的油脂层,中间一层是载有营养素的透明胶束层,底部是未完全消化的不溶物质[21]。
1.3.3 模拟消化过程中乳液微观形态的变化
1.3.3.1 模拟消化过程中乳液粒径的变化
利用纳米粒度及Zeta电位分析仪Zetasizer Nano ZS90(配有He/Ne激光器(λ=633 nm))对3 种大分子乳化剂(OSA变性淀粉、WPI和SC)优化制备的纳米乳液最初的粒径以及经过模拟口腔、模拟胃、模拟肠5 min、模拟肠120 min和胶束消化液的粒径进行测定。所有样品测试前先使用去离子水或磷酸盐缓冲溶液对原乳液稀释100 倍,然后吸取适量(约为比色皿的2/3)的待测液加入石英比色皿中,测试参数为水折射率1.33、测试温度25 ℃,每个样品平行测定3 次,取平均值。
1.3.3.2 模拟消化过程中纳米乳液表观结构的变化
根据相关文献报道[22-23]的方法,采用激光扫描共聚焦显微镜对消化过程中3 种番茄红素纳米乳液的表观形态进行观察。以无水乙醇为溶剂,配制质量分数0.01%的尼罗红染液,并置于4 ℃冰箱贮藏。在3 种乳化剂构建的番茄红素纳米乳液模拟消化的过程中,分别取原始乳液、模拟口腔、模拟胃和模拟肠的样品后染色,样品中尼罗红最终质量浓度为0.25 μg/mL。取染色后的样品10 μL,滴加到载玻片上后迅速盖上盖玻片,放置在激光扫描共聚焦显微镜上后,使用10 倍目镜和100 倍物镜,显微镜的实验参数为激发波长543 nm,吸收波长563~733 nm。
1.3.4 模拟消化过程中乳液电位的变化
样品的前期处理和测试操作同1.3.3节,利用纳米粒度及Zeta电位分析仪(配有He/Ne激光器(λ=633 nm))测定番茄红素纳米乳液在不同模拟消化阶段时的电位。
1.3.5 乳化剂种类对纳米乳液游离脂肪酸释放的影响
在模拟肠的消化过程中,纳米乳液中的油脂在胰脂肪酶的作用下被水解成游离脂肪酸,所以在水解过程中消化液体系会不断地产生H+,从而导致pH值降低。在模拟肠消化过程中,根据pH-stat法,利用NaOH溶液平衡消化液体系的pH值。利用消耗的NaOH溶液的体积,计算出番茄红素纳米乳液体系中释放的游离脂肪酸量,计算释放率公式如下:

式中:V(NaOH)为产生游离脂肪酸所消耗的NaOH溶液体积/mL;C(NaOH)为NaOH溶液的浓度/(mol/L);Mlipid为MCT油脂的平均分子质量/(g/moL);mlipid为最初存于纳米乳液中载物油的质量/g。
1.3.6 模拟消化后乳液中番茄红素生物利用率的测定
番茄红素标准曲线的绘制:番茄红素溶液在低质量浓度范围内满足朗伯-比尔定律[24],用二氯甲烷溶液溶解番茄红素标品,通过紫外-可见光分光光度计在400~600 nm波长范围内全波长扫描,番茄红素吸收图谱显示其在472 nm波长处有明显的吸收峰。使用少量二氯甲烷溶解番茄红素标品,以二氯甲烷-正己烷(1∶3,V/V)为混合溶剂,配制质量浓度为0.2~40 μg/mL的番茄红素标准溶液,绘制的番茄红素标准曲线为A=0.051C-0.008,相关系数r为0.996 1。
番茄红素质量浓度的测定:取500 μL新制的番茄红素乳液样品与500 μL的二甲基亚砜溶液均匀混合,然后依次加入2 mL的二氯甲烷-正己烷(1∶3,V/V)混合有机相进行萃取,重复萃取3 次,直至样品变澄清,而后合并萃取液,在4 000 r/min离心10 min,取上层清液置于分光光度计下测定番茄红素的吸光度。以混合有机相作为空白对照,测定波长为472 nm,根据标准曲线计算番茄红素质量浓度。
3 种乳化剂构建的番茄红素纳米乳液经模拟口腔、胃和肠阶段消化后,消化液离心后得到胶束液。取1 mL胶束液,使用以上方法测定胶束中的番茄红素质量浓度,并通过式(2)计算番茄红素纳米乳液经消化后的生物利用率。

式中:C0为纳米乳液中番茄红素质量浓度/(μg/mL);C1为胶束中番茄红素质量浓度/(μg/mL)。
1.4 数据分析和图像处理
所有实验都至少重复3 次并取平均值,使用Microsoft Excel 2010软件对数据进行方差分析,计算标准偏差,使用SPSS软件对数据进行差异显著性分析,使用Origin 8.5软件制图。
2 结果与分析
2.1 模拟消化过程中乳液粒径的变化

图1 不同乳化剂构建的番茄红素纳米乳液在模拟消化过程中粒径的分布Fig. 1 Particle size distribution of three lycopene nanoemulsions prepared with different emulsifiers during simulated digestion
纳米乳液的平均粒径直接影响包埋物在消化过程中的生物利用度。由图1和图2可知,3 种纳米乳液在模拟消化过程中粒径变化趋势为先增加后降低,其中OSA变性淀粉纳米乳液经过模拟口腔液和胃液后粒径增加较少,在模拟肠消化5 min粒径急剧增大,这是因为OSA变性淀粉增大了乳液体系对α-淀粉酶的抗酶解作用,而肠液中含有的胰淀粉酶和糖苷酶使OSA变性淀粉大量水解崩坏,从而使体系粒径在此阶段急剧增大。陈翰[17]使用3 种淀粉类乳化剂构建的纳米乳液在模拟肠消化阶段中二糖的生成量大量增加,表明在肠消化阶段淀粉被大量水解;而蛋白质类的纳米乳液在模拟胃阶段时粒径急剧增大,这可能是因为胃液中的蛋白酶大量水解WPI和SC,从而导致了以蛋白质为乳化剂的乳液体系粒径在此阶段增大。Malaki等[25]研究也指出,乳化剂被分解会使乳液的结构被破坏,从而发生大量聚集,体系的粒径急剧增大。

图2 不同乳化剂构建的番茄红素纳米乳液在模拟消化过程中平均粒径的变化Fig. 2 Change in average particle size of three lycopene nanoemulsions prepared with different emulsifiers during simulated digestion
2.2 模拟消化过程中纳米乳液表观结构的变化

图3 3 种不同乳化剂制备的番茄红素纳米乳液在模拟消化中的形貌图Fig. 3 Morphology of lycopene nanoemulsion prepared by three different emulsifiers during simulated digestion
为便于观察,可使用通过尼罗红染色的方法来观察油脂变化情况[26-27]。利用激光扫描共聚焦显微镜检测,由图3可以看出,3 种番茄红素纳米乳液在消化过程中的聚集变化情况与粒径变化的结果相一致,原始的纳米乳液显微镜图中观察不到油滴颗粒,但经模拟消化后观测到油滴颗粒聚集现象的出现,即3 种纳米乳液在不同消化阶段发生了不同程度的水解。OSA变性淀粉构建的番茄红素纳米乳液在模拟口腔阶段便可观察到油滴颗粒,而蛋白质类乳化剂构建的番茄红素纳米乳液在模拟胃阶段发生的油滴聚集较为剧烈。
2.3 模拟消化过程中乳液电位的变化

图4 3 种番茄红素纳米乳液在模拟消化过程中电位的变化Fig. 4 Change in potential of three lycopene nanoemulsions during simulated digestion
利用Zeta电位分析仪检测可知(图4),OSA变性淀粉构建的纳米乳液电位绝对值呈现出先增大后减小又增大的趋势,而蛋白质类乳化剂构建的纳米乳液电位均为先减小后增大的趋势,且OSA变性淀粉构建的纳米乳液电位绝对值整体比蛋白质类大。Zeta电位表示液滴的静电排斥力,其值越高,乳液的稳定性越好。另外,乳液电位的变化与粒径变化的规律相应,OSA变性淀粉纳米乳液的电位绝对值在模拟肠5 min阶段达最低,而蛋白质类的纳米乳液电位绝对值的最低点在模拟胃阶段。这是因为对于蛋白质类纳米乳液,胃阶段的pH值在蛋白质乳化剂WPI和SC的等电点附近,粒子间的静电排斥作用减少,体系的电位绝对值低。
2.4 乳化剂种类对纳米乳液游离脂肪酸释放的影响
以溶有同等质量浓度番茄红素的MCT油为对照组,比较3 种番茄红素纳米乳液在模拟肠阶段后的游离脂肪酸释放率,如图5所示。

图5 3 种番茄红素纳米乳液与对照组在模拟肠消化过程中的游离脂肪酸释放率Fig. 5 FFA release from three lycopene nanoemulsions and control group during simulated intestinal digestion
经过小肠阶段的模拟消化后,3 种乳化剂构建的番茄红素纳米乳液的消化速率大小排序为SC>WPI>OSA变性淀粉>对照组,游离脂肪酸释放率的大小排序为OSA变性淀粉(92.25%)>SC(86.53%)>WPI(79.88%),高于对照组的48.7%,这一结果证明,纳米乳液运载体系能有效地改善油脂的消化[28]。这是因为纳米级的乳液油水体系增大了脂肪酶与油滴的接触面积,从而提高脂肪的水解速度。而不同种类的大分子乳化剂有着不同的化学结构,因而在人体消化过程中酶解情况不同,从而导致游离脂肪酸释放率不同。通常,乳化剂的消化速率越快,颗粒的聚集也越快,使得油滴总的表面积减少,导致较低的游离脂肪酸释放率[29]。蛋白质类纳米乳液油脂的消化速率高于OSA变性淀粉,原因是肠液中的胰淀粉酶和糖苷酶大量水解了OSA变性淀粉,对脂肪消化起了抑制作用。对于蛋白质类纳米乳液,SC较WPI更容易被脂肪酶水解,这是因为SC表观结构呈现多孔凹状,易于胆盐等分子的吸附[30]。
2.5 乳化剂种类对番茄红素生物利用率的影响
纳米乳液体系所包埋的营养素,在模拟肠消化阶段中,由于载物油被水解,营养素会逐渐从载物油中释放出来,有研究表明大部分营养素会以胶束的形式被小肠所吸收[31]。因此,在体外模拟消化过程中,纳米乳液中的番茄红素生物利用率转换为胶束中的浓度百分比计算。以溶有同等质量浓度番茄红素的MCT油为对照组,图6为3 种番茄红素纳米乳液和对照组经过模拟人体消化后番茄红素的生物利用率。
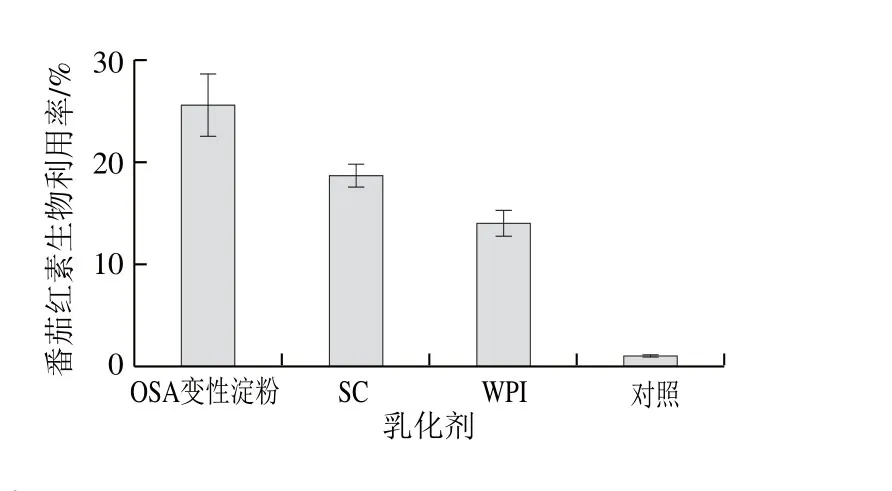
图6 3 种番茄红素纳米乳液与对照组的番茄红素生物利用率Fig. 6 Bioavailability of lycopene in three lycopene nanoemulsions and control
由图6可知,由O S A变性淀粉、S C和W P I构建的纳米乳液番茄红素的最终生物利用率分别为(25.60±3.08)%、(18.70±1.14)%、(14.05±1.23)%,远大于对照组的(1.06±0.06)%。结果证明纳米乳液体系包埋的番茄红素具有较好的生物利用率,且以OSA变性淀粉为乳化剂的纳米乳液番茄红素的生物利用率高于蛋白质类,此结果与游离脂肪酸释放率的结果呈正相关,这是因为体系中胶束的形成与体系中脂肪水解的程度有关,脂肪水解程度越低,体系中胶束越难以形成,从而导致了番茄红素生物利用率较低,这与梁蓉[32]的研究结果一致。Mcclements等[33]研究表明,在包埋有营养素的纳米乳液中,营养素的摄取吸收率要明显强于溶解于水中或者油系中的摄取率,且其效率会因粒径的不断减小而明显增强。但也存在部分的纳米载体颗粒,结构牢固、稳定性较强,经过上皮细胞吸收并进入体内循环的过程后,仍能够以纳米颗粒的稳定形式存在,不会轻易被细胞代谢,其中的营养素也无法释放,因此难以被利用。可见,在构建每一个纳米乳液体系时,应当使粒径范围控制至某一合适的区间内,这样才能使其生物利用率最优化。
3 结 论
通过高压均质的方法,分别以OSA变性淀粉、WPI和SC为乳化剂构建番茄红素纳米乳液,以粒径、Zeta电位、游离脂肪酸释放率以及番茄红素生物可利用度为指标,探讨3 种番茄红素纳米乳液在口腔、胃、肠中的消化规律。在口腔消化阶段,3 种纳米乳液的粒径并无明显变化;在胃消化阶段,蛋白质类乳化剂构建的纳米乳液粒径显著增大,且电位绝对值达到最低;在肠消化阶段,OSA变性淀粉构建的纳米乳液粒径明显增加,电位绝对值降到最小。激光共聚焦显微镜观察显示OSA变性淀粉和蛋白质类大分子构建的纳米乳液分别在肠和胃阶段发生大量水解。蛋白质类纳米乳液油脂的消化速率高于OSA变性淀粉,但OSA变性淀粉纳米乳液拥有更高的游离脂肪酸释放率。3 种纳米乳液的生物利用率均远高于对照组,且OSA变性淀粉构建的番茄红素纳米乳液能表现出更高的生物利用率。因此,可以认为OSA变性淀粉是构建负载营养物纳米乳液的更为优良的大分子乳化剂。
