乳杆菌发酵鲟鱼骨酶解液条件优化及营养成分分析
2019-06-11武瑞赟杜怡丽张金兰胡锦蓉李平兰
武瑞赟,杜怡丽,张金兰,尹 剑,胡锦蓉,李平兰*
(北京食品营养与人类健康高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083)
鱼骨中富含钙、蛋白质以及矿质元素[1],是营养丰富的天然资源,但由于钙和蛋白质分别以结合态形式[2]和三螺旋结构的骨胶原形式[3]存在,均很难被机体吸收利用。酶解是提高蛋白质功能特性的手段之一[4],骨胶原在蛋白酶作用下降解为肽和少量氨基酸[5-6],具有抗氧化、降血糖[7-8]等生理功能。通常钙是在小肠部位以可溶性钙离子的方式吸收利用的[9],而单纯的酶解并不能使鱼骨中以羟基磷灰石Ca10(PO4)6OH结合态存在的钙完全转化为游离态,导致鱼骨中大量的钙仍不能够被利用。研究发现,发酵可以使羟磷石灰钙转变为易于吸收的离子钙[10],因此,采用酶解与发酵相结合的手段可以进一步提高鱼骨的营养价值和利用率。
常用的发酵剂有酵母菌、葡萄球菌、微球菌以及乳酸菌[11]等,其中乳酸菌种类较多,发酵过程产酸[12],有调节人体肠道微环境、促进营养物质吸收、增强抵抗力、抗肿瘤[13-15]等功能。研究发现,乳酸菌能够利用肽[16]、氨基酸为氮源生长[17],所以酶解液可以为乳酸菌的生长提供天然底物,同时发酵过程中产生的酸性环境为骨中钙由结合态分解为游离态提供了条件;微生物分泌的蛋白酶和肽酶[18-19]又可进一步将长链肽水解为短肽,一些短肽可以与钙、镁等离子形成螯合物[20-21],有利于机体的吸收,提高生物利用率。
L-ZS9是本实验室从比利时发酵肉制品Saucisson sec pur中分离得到的1 株类植物乳杆菌(Lactobacillus paraplantarum),是国内首个在GenBank上提交全基因序列的类植物乳杆菌[22]。前期研究发现,该菌株生长速度快,产酸能力强,与肠细胞有很好的黏附作用,并可产生双肽细菌素(IIb类)[23-24],具有良好的竞争优势。同时,该菌株还存在调控生物被膜形成的LuxS/AI-2群体感应系统[25-26],有利于菌株耐受消化道环境及在肠道内黏附定植,显示出具有开发成为益生菌产品或发酵剂的潜力。
目前,国内外利用乳酸菌发酵骨粉酶解液的相关研究很少,本研究以鲟鱼软骨酶解液为材料,类植物乳杆菌L-ZS9为发酵剂,通过单因素试验及响应面法优化适合类植物乳杆菌L-ZS9生长的最佳发酵条件,同时考察发酵对酶解液中钙、镁、磷等营养成分的影响,为开发富含益生菌及多种营养成分的新型骨产品提供技术支撑,同时为禽畜骨的高值利用和新产品开发提供新思路。
1 材料与方法
1.1 材料与试剂
鲟鱼由北京市农科院水产所十渡鲟鱼繁育基地提供,为史氏鲟和西伯利亚鲟杂交品种;类植物乳杆菌L-ZS9,由本实验室分离并保存。
MRS肉汤培养基 北京奥博星生物技术有限公司;琼脂 宝如亿(北京)生物技术有限公司;葡萄糖 西陇科学股份有限公司;氢氧化钠、盐酸(均为分析纯)北京化工厂;钙试剂盒、磷试剂盒、镁试剂盒、BCA蛋白定量试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
LGJ-12冷冻干燥机 北京松源华兴科技发展有限公司;FA1004电子分析天平 上海天平仪器厂;UV-1800紫外-可见分光光度计 上海美谱达仪器术有限公司;MET-30033757 pH计 上海梅特勒-托利多仪器有限公司;Sorvall Legend Micro 17微量台式离心机 赛默飞世尔科技公司;HZQ-F160全温振荡培养箱 苏州培英实验设备有限公司;YXQ-LS-SII全自动立式蒸汽灭菌锅 上海博迅实业有限公司;DK-8B电热恒温水槽 上海精宏实验设备有限公司;SW-CJ-1F超净工作台 苏州安泰空气技术有限公司;DW-86W100超低温保存箱 青岛海尔特种电器有限公司;FEI Quanta 200环境扫描电子显微镜 美国菲达康有限责任公司。
1.3 方法
1.3.1 鲟鱼软骨粉酶解液的制备
依据实验室前期的实验所得的条件,以料液比1∶25(g/mL),使用碱性蛋白酶与中性蛋白酶以3%加酶量2∶1混合,55 ℃酶解5 h可得到蛋白水解度较高的鲟鱼软骨粉酶解液。
1.3.2 菌株活化与保存
取适量实验室保藏的类植物乳杆菌L-ZS9冻干粉溶解于0.85%生理盐水中得菌液,取菌液接种于无菌MRS肉汤培养基,37 ℃恒温摇床培养24 h。连续接种3 代,每一代划平板培养观察菌落形态,同时取菌液涂片固定,进行革兰氏染色,100 倍油镜观察菌体特征,确保操作无污染。连续接种3 代至菌株活力正常,转接于磁珠菌种保存管,-80 ℃保存备用。
1.3.3 单因素试验
1.3.3.1 发酵时间的选择
以3%接种量将活化后菌株接种于初始pH 6.5的无菌鲟鱼软骨粉酶解液培养基中,37 ℃培养0、12、24、36、48、60 h取样,取适宜的3 个稀释度各倒3 个平行平板菌落计数。
1.3.3.2 接种量的选择
分别以2%、3%、4%、5%、6%不同接种量将活化后菌株接种于初始pH 6.5的无菌鲟鱼软骨粉酶解液培养基中,37 ℃培养24 h,取适宜的3 个稀释度各倒3 个平行平板菌落计数。
1.3.3.3 发酵起始pH值的选择
以4%接种量将活化后菌株接种于起始pH值分别为5.5、6.0、6.5、7.0、7.5的无菌鲟鱼软骨粉酶解液培养基中,37 ℃培养24 h,平板菌落计数。
1.3.3.4 葡萄糖添加量的选择
以4%接种量将活化后菌株接种于灭菌前分别添加0、10、20、30 g/L和40 g/L葡萄糖,初始pH 6.0的无菌鲟鱼软骨粉酶解液培养基中,37 ℃培养24 h,平板菌落计数。
1.3.4 响应面试验设计
利用Design-Expert 8.0.6软件中Box-Behnken模型,选择发酵液中活菌数(Y)为响应值,进行发酵时间(A)、葡萄糖添加量(B)、发酵起始pH值(C)、接种量(D)4 个因素对发酵液活菌数的响应面分析,优化4 个因素的最优水平组合。响应面试验设计因素与水平见表1。

表1 响应面试验设计因素与水平Table 1 Code and level of independent variables used for response surface d esiiggnn
1.3.5 乳酸菌活菌数的测定
发酵液中活菌数按GB 4789.35—2016《食品微生物学检验 乳酸菌检验》中的方法测定。
1.3.6 扫描电镜观察骨粉微观结构变化
将酶解后及发酵后的鲟鱼软骨粉样品用1 mL戊二醛固定,真空喷金2 次各60 s达到厚度为10 nm成像,使用FEI Quanta 200型环境扫描电镜对样品进行显微结构观察。
1.3.7 营养成分测定
可溶性钙含量由钙试剂盒微孔板法测定;可溶性磷含量由磷试剂盒微孔板法测定;可溶性镁含量由镁试剂盒微孔板法测定;可溶性蛋白质含量利用BCA蛋白定量试剂盒测定。
1.4 数据处理
所得数据均为平行测定3 次以上取平均值,并计算出正负标准偏差,用误差线表示。采用Design-Export 8.0.6数据处理软件对实验结果进行处理,应用中心点法对各组变量的计算结果进行方差分析和差异显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 单因素试验结果
选取对发酵液活菌数影响显著(P<0.05)且贡献值最高的发酵时间、接种量、起始pH值及葡萄糖添加量4因素进行单因素试验,结果见图1。
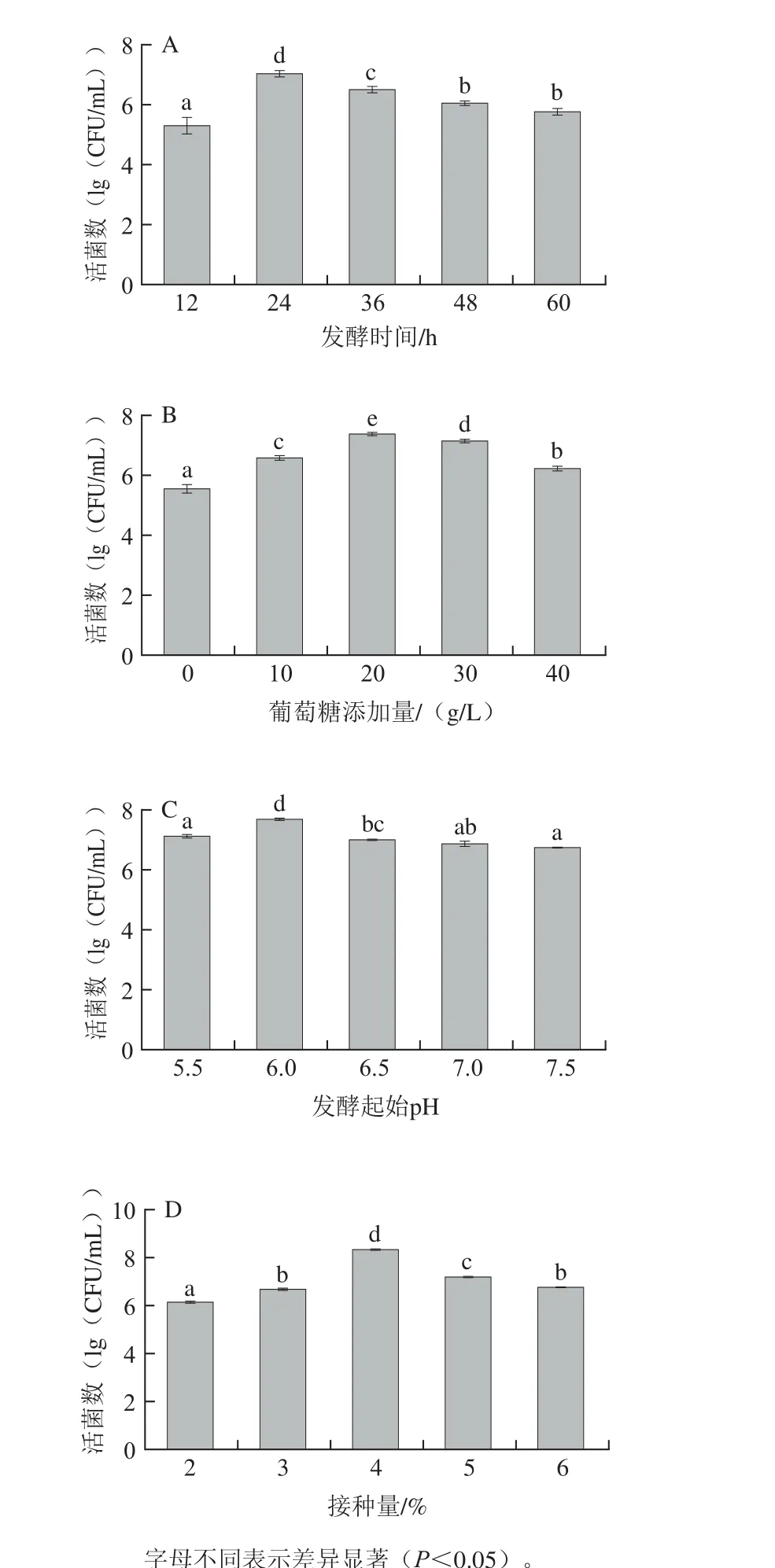
图1 发酵时间(A)、葡萄糖添加量(B)、发酵起始pH值(C)、接种量(D)对活菌数的影响Fig. 1 Effects of fermentation time (A), glucose addition (B), initial pH (C),inoculum size (D) on the number of live bacteria
由图1可知,随发酵时间、接种量、起始pH值及葡萄糖添加量的增加,活菌数都呈先增加后下降的趋势,其中发酵时间为24 h时,活菌数达到最大值9.50×106CFU/mL,24 h之后,由于发酵液中的碳源、氮源等营养物质的减少,以及菌体自身可能进入衰亡期,使得活菌数有所下降(图1A);图1B显示,将葡萄糖添加量范围控制在0~40 g/L之间,发酵24 h时,活菌数结果显示在20 g/L得到活菌数值最大为2.34×107CFU/mL。在固定发酵时间24 h、葡萄糖添加量20 g/L的情况下,图1C显示,发酵起始pH 6.0时,活菌数达最大值为5.01×107CFU/mL。固定以上因素,由图1D可知,在接种量为4%时,活菌数达最大值8.37×108CFU/mL,随着接种量的增加,活菌数有所下降,可能是由于培养基营养成分的局限性,不能供给微生物更多的营养,微生物生长受到限制,活菌数有所下降。另外,考虑到过高的接种量对发酵体系物质消耗的因素以及菌体自溶带来的影响,确定4%为适宜接种量;通过单因素试验得到的最适发酵时间、接种量、起始pH值及葡萄糖添加量分别为24 h、4%、6.0和20 g/L。
2.2 Box-Behnken响应面试验结果
2.2.1 响应面优化的试验方案及结果
利用Design-Expert 8.0.6软件设计Box-Behnken模型,共得到29 个试验组,并按照方案进行试验,以活菌数为响应值(Y),试验方案及结果如表2所示。
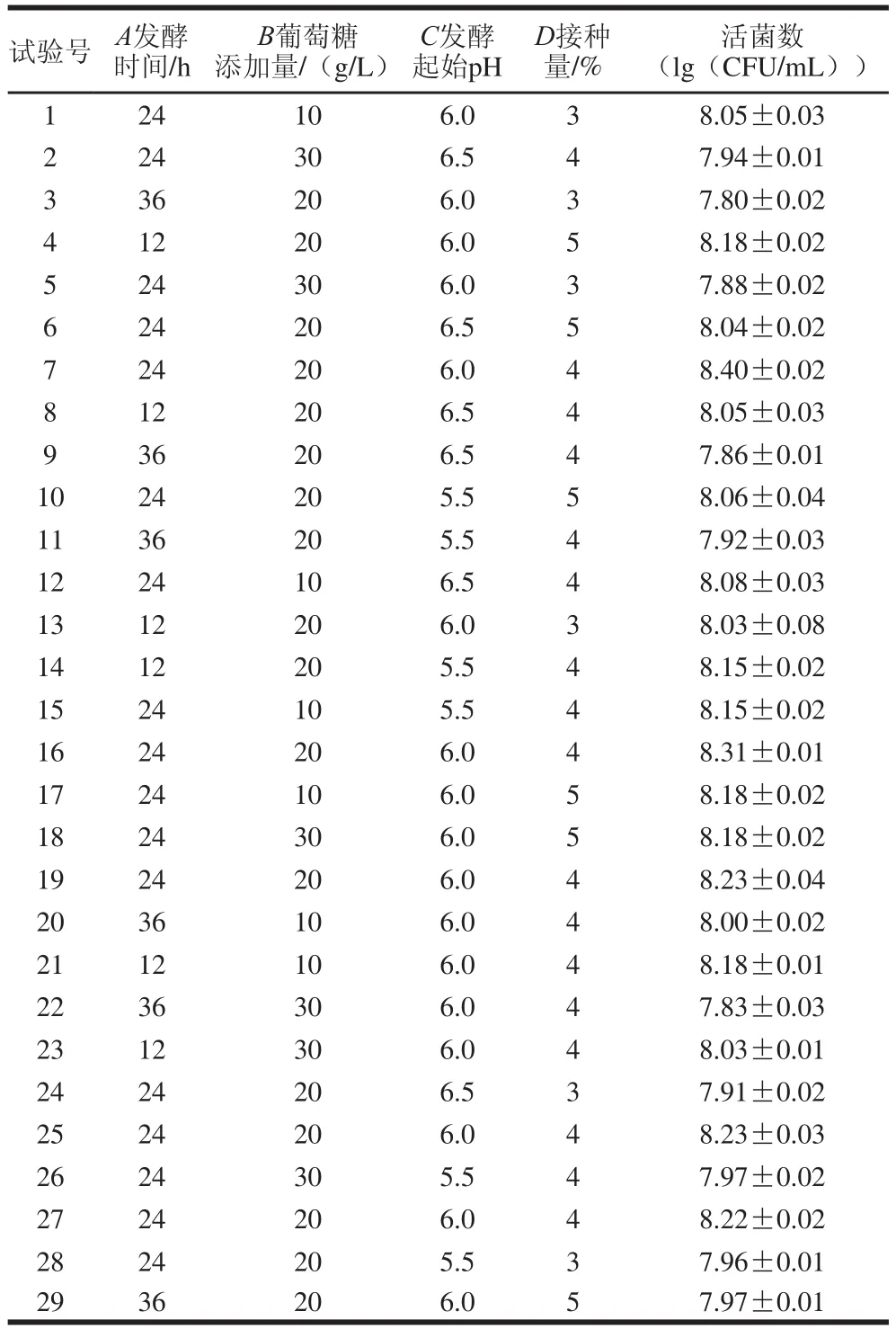
表2 响应面试验设计与结果Table 2 Box-Behnken design with experimental results
2.2.2 响应面模型方差分析
根据试验结果建立回归模型并进行方差分析,如表3所示。
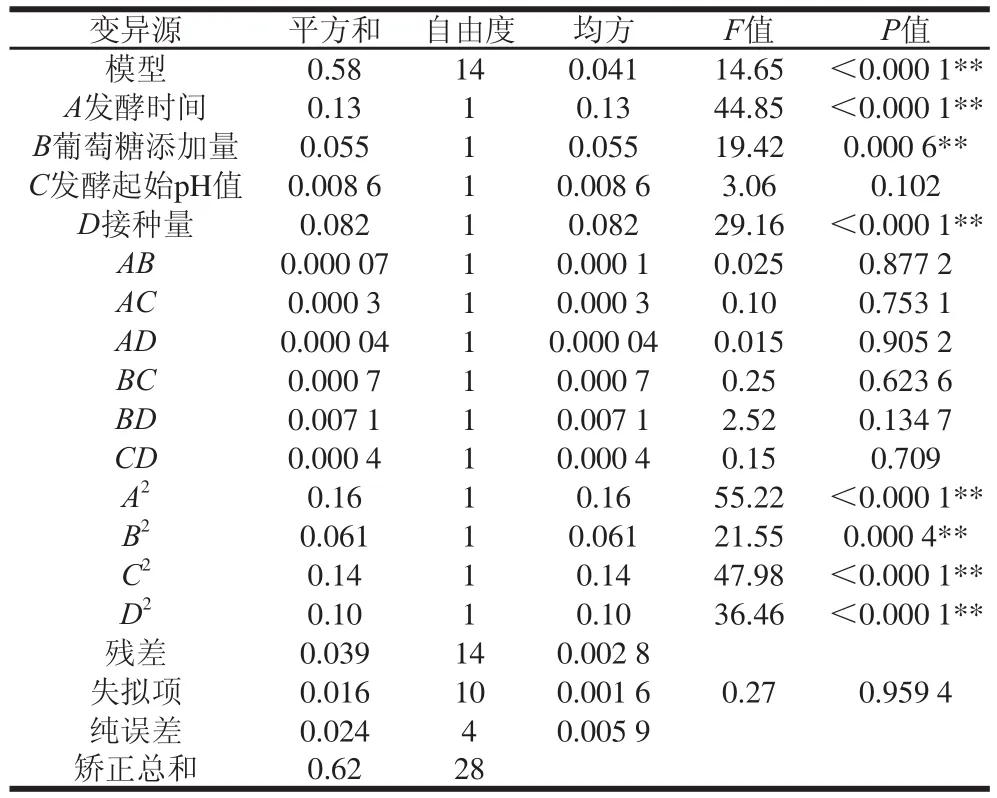
表3 响应面试验回归模型方差分析Table 3 Analysis of variance of quadratic polynomial regression model
由表3可知,所选模型P值小于0.000 1,高度显著,说明与实际情况拟合良好;失拟项P值大于0.05,不显著,说明未知因素对试验结果干扰小,模型选择适当。同时,该模型的决定系数为0.936 1,说明该方程与实际情况拟合良好,较好地反映了发酵液中活菌数与发酵时间、接种量、发酵起始pH值和葡萄糖添加量之间的相互作用关系,因此该模型可用。利用Design-Expert 8.0.6对表3所显示的结果进行二次多元拟合处理,得到发酵液中活菌数(Y)对发酵时间(A)、葡萄糖添加量(B)、发酵起始pH值(C)和接种量(D)的二次多元回归方程为:Y=8.28-0.10A-0.067B-0.027C+0.083D-0.004 17AB+0.008 51AC+0.00322AD+0.013BC+0.042BD+0.010CD-0.15A2-0.097B2-0.14C2-0.13D2。
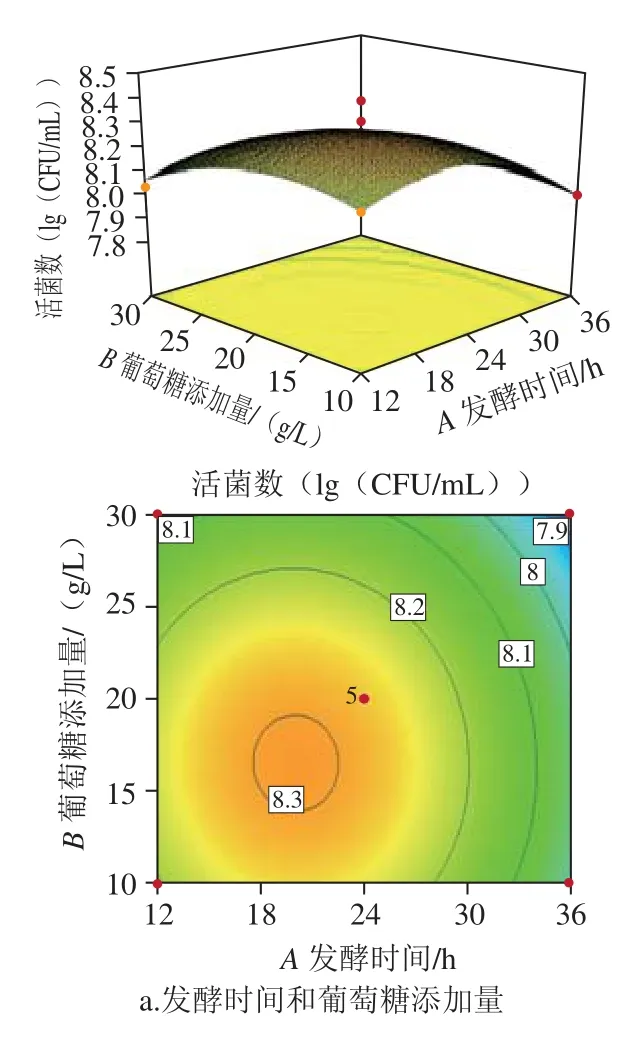
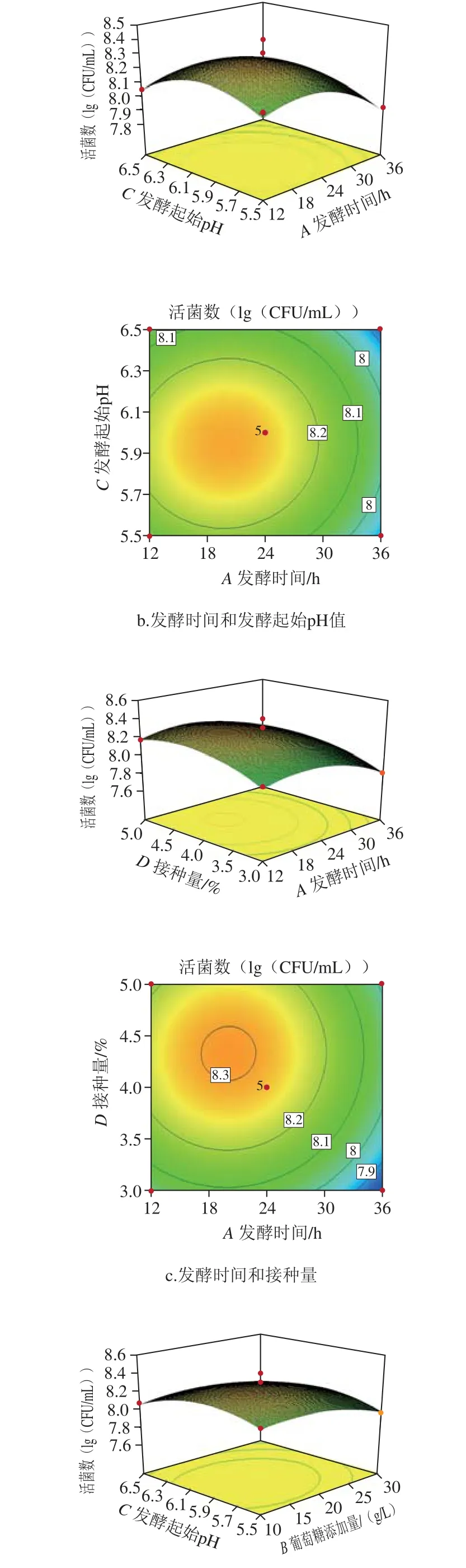

图2 各因素交互作用响应面和等高线图Fig. 2 Response surface and contour plots showing the interactive effect of variables on L. paraplantarum growth
所得二次回归方程的响应面图和等高线见图2,通过方程可知,二次项系数为负值,表明方程具有最大值。得到等高线呈椭圆状,抛物面朝下,说明模型存在最大值,模型建立良好。软件分析得到最优工艺为发酵时间20.07 h、葡萄糖添加量17.11 g/L、发酵起始pH 5.95、接种量4.27%,并预测在此条件下活菌数为2.09×108CFU/mL,按照此工艺进行验证实验,所得结果为3.55×108CFU/mL,与预测值基本吻合,说明模型很好地预测了实验结果。
2.3 扫描电镜观察发酵前后鲟鱼骨粉酶解液的微观结构变化

图3 酶解(a)及发酵后(b)鲟鱼软骨粉电镜形态图(×30 000)Fig. 3 Morphology of sturgeon cartilage powder after enzymatic hydrolysis (a) and fermentation (b)
图3a是酶解后的鲟鱼软骨粉,其边缘锐利,整体结构疏松分散,这可能是由于蛋白酶水解了骨粉中结构蛋白,导致骨的内部结构分离,呈现松散状态,这与秦娜娜等[27]探究木瓜蛋白酶水解骨粉最佳工艺条件时得到的骨粉粒径明显小于未酶解前的骨粉粒径的结果一致。发酵后的鲟鱼软骨粉(图3b)表面呈多孔状,致密结构被破坏,同时可见骨粉中活菌含量丰富。发酵后骨粉结构与刘丽莉等[28]对牛骨粉发酵前后的电镜观察所发现的结果相似,对比发现发酵过程对鲟鱼骨粉颗粒表面的微观结构影响显著,与未经发酵的鲟鱼软骨酶解粉的完整结构相比较,推测发酵过程促使骨粉表面发生“侵蚀”的原因,主要是由于菌体代谢产生胞外胶原蛋白酶降解了骨中的胶原蛋白,从而破坏了骨的完整结构,使结合紧密的骨粉颗粒变得疏松,骨中的胶原蛋白肽更好地溶出,发酵液中氮源更加充足,这也为类植物乳杆菌L-ZS9的生长提供了营养支持,起到促生长作用。
2.4 鲟鱼骨酶解液发酵前后营养成分
发酵前后功能成分及一般营养成分测定结果见表4。经测定,该产品活菌数可达(3.55±0.10)×108CFU/mL,满足益生菌在人体内发挥益生作用活菌数108~109CFU/mL的要求[29]。

表4 鲟鱼骨酶解液发酵前后营养成分测定结果Table 4 Changes in macronutrients of the hydrolysate before and after fermentation
钙、磷、镁是人体的重要组成物质,具有广泛的生理功能,由于日常生活的磷摄入过多,过多的磷经过会带体内的钙分子排出体外,造成缺钙现象的发生;镁是骨骼中钙进入血液的控制开关,单独摄取钙质可能造成镁的缺乏,同时,镁又可以与体内的游离钙结合,钙、磷、镁比例适宜,才更有利于人体消化吸收[30-31],达到补钙的目的。可溶性蛋白指可以以小分子状态溶于水或其他溶剂的蛋白,通常在微生物、食品加工等中作为重要指标,是重要的渗透调节物质和营养物质,具有提高细胞的保水能力、保护细胞及生物膜的作用。因此本研究对酶解液和发酵液中可溶性的钙、镁、磷以及可溶性蛋白质进行了营养指标测定。
如表4所示,发酵液中游离钙、鳞、镁含量较骨粉酶解液原料均有提高。说明在L-ZS9发酵过程中,代谢产物中的蛋白酶系进一步使酶解液中蛋白发生降解,使得一部分蛋白质溶出,可溶性蛋白含量略有所增加。也可以改变骨的结构,使更多的钙流出,同时发酵产酸,提供酸性环境,骨中的羟磷灰石态钙变成可溶的游离钙释放出来。同时发酵液中的钙、磷、镁约为4∶2∶1,符合中国营养学会提出的膳食钙磷镁比例,由此可见,利用类植物乳杆菌L-ZS9发酵鲟鱼软骨酶解液,可制得含益生菌的发酵鱼骨类补钙产品。
3 结 论
在单因素试验的基础上,设计响应面试验,优化出乳杆菌发酵鲟鱼骨酶解液的最佳工艺参数为发酵时间20.07 h、葡萄糖添加量17.11 g/L、发酵起始pH 5.95、接种量4.27%,在此条件下发酵液中乳杆菌活菌数可达(3.55±0.10)×108CFU/mL。同时,乳杆菌的发酵可显著提高鲟鱼骨酶解液中游离钙含量。本研究利用类植物乳杆菌L-ZS9对鲟鱼骨酶解液进行发酵,使其兼具了益生、补钙的特性,实现了鱼骨的高值利用,为相关功能产品的研发提供理论支持。
