青海土族、回族与藏族牙周病的可疑致病微生物差异分析
2018-12-12刘静石晴李志艳赵翀陈筠朱德锐
刘静 石晴 李志艳 赵翀 陈筠 朱德锐
口腔营养丰富,适宜的pH及温度是多种微生物(细菌、病毒和真菌)的栖息地[1]。细菌能保持口腔生态系统的平衡性,失去平衡时,龋病和牙周病等口腔疾病就会随之发生,且与高血压、类风湿性关节炎、糖尿病等系统性疾病密切相关[2]。因此,口腔疾病的研究对于其早期的预防、治疗及维护人体的健康有至关重要的作用。牙周病和龋病是危害人类口腔健康最普遍的疾病,受遗传、饮食、生活环境及文化背景等因素的影响[3]。目前,利用高通量测序技术进行微生物多样性检测、宏基因组学和微生物代谢组学研究口腔微生物与临床疾病的相关性,是国内外研究热点[4]。
据报道,对海拔4 000 m以上的2 400 名世居者及移居者进行牙周病学普查,发现移居者牙周病发病率高达98.7%,而世居者仅为42.3%,且久居高原者牙周病的患病率(高达70.2%)明显高于其他地区[5-7]。国内对于口腔疾病的研究主要是针对低海拔平原地区的居民,高海拔地区居民口腔疾病的流行病学研究甚少,且高原口腔微生物研究报道较少。青海地区地理条件特殊,少数民族众多,不同民族聚居生活,各民族之间生活方式存在较大差异。其中,互助县的土族是青海特有的一个少数名族,回族和藏族在青海地区又是人数比较多的两个少数民族,汉族大多是从全国各地移居而来。因此本研究选择了青海不同地区的土族,回族与藏族人群为研究对象,采用16S rRNA基因高通量测序技术探究不同人群口腔微生物的多样性、群落结构差异以及牙周病的可疑致病菌差异,为青海地区牙周病的预防和治疗提供理论依据。
1 材料与方法
1.1 研究对象和样本采集
通过对青海互助土族自治县威远镇土族、玉树州结古镇藏族、平安县古城乡回族居住10 年以上的部分居民进行口腔检查,选取28 例重度牙周炎患者,年龄在23~85 岁,玉树藏族(Tibetan,T)有10 例,平安回族(Hui,H)有10 例,互助土族(Monguor,M)8 例,其中男性13 例,女性15 例;对照组(Control,C)年龄40~85 岁,男性6 例,女性6 例。慢性牙周炎患者纳入标准:①牙周袋深度(PD)≥4 mm或附着丧失量(AL)≥2 mm;②X线片示牙槽骨吸收超过根长的1/3;③无其他口腔疾病。收集藏族、回族与土族牙周病患者,均无糖尿病、心血管病、甲亢等全身系统性疾病,无嗜烟酒史,3 个月内无抗生素使用史,就诊前6 个月内未做口腔治疗,无侵袭性牙周炎,无妊娠期或哺乳期。在采集样本前让受检者用温开水轻轻漱去口中的食物残渣,然后采集口腔自然排出的唾液于无菌试管内,唾液量0.5~1.0 ml,加入等量的50%灭菌甘油,标记后立即冻存于-4 ℃的转运箱中保存,送回实验室,-20 ℃冷冻备用。
1.2 总DNA的提取及质量控制
样本于0.22 μm 细菌滤膜上进行真空抽滤,将滤膜剪碎放入DNA试剂盒(QI Aamp Fast DNA Stool Mini Kit,Qiagen,德国),参照试剂盒步骤提取基因组DNA,2.0%琼脂糖凝胶电泳分析唾液样本DNA完整性。DNA质量纯度检测分析采用微量检测仪Microplate Reader(MD公司,USA),合格样品总DNA保存于-80 ℃。
1.3 PCR扩增16S rRNA和测序分析
细菌使用16S rRNA基因通用引物F341(5’-CCTACGGGAGGCAGCAG-3’)和R518(5’-ATTACCGCGGCTGCTGG-3’)进行V3-V4目的基因扩增。PCR反应条件为:95 ℃(5 min),94 ℃(45 s),55 ℃(30 s),72 ℃(90 s),共35 个循环,最后在72 ℃下延伸5 min。采用Axyprep DNA Gel Extraction Kit(Axygen scientific, Inc USA)进行PCR扩增产物纯化;采用Qubit®2.0荧光计(Invitrogen, USA)进行RNA精准定量分析。检测合格的PCR纯化产物由上海惠研生物科技有限公司进行16S rRNA基因量测序(MiSeq/454/Sanger, ABI, 3730xl,USA),每个样本获得双端序列数据为2~3 万个reads。根据测序reads之间overlap关系进行拼接(merge),同时对reads质量和merge效果进行质控过滤(Q30>80%),根据序列首尾两端的barcode和引物序列区分,优化有效序列。
1.4 测序结果分析
使用QIIME 1.8.0软件对原始数据进行处理,在相似度97%水平上聚类出可操作分类单元(operational taxonomic unit,OTU),进行OTU picking和物种注释分析。通过Alpha稀释曲线(Alpha rarefaction)计算样品的香农指数(Shannon)、谱系多样性(PD whole tree)、观察物种(Observed species)和菌种丰富度指数Chao1。根据软件Cluster 3.0,将属水平上菌种分别按照样品和分类进行聚类做出Heatmap图。根据分类学分析结果(属Genera)分析微生物的群落结构、物种组成比例及丰度。
2 结 果
2.1 测序数据分析
通过Illumina MiSeq测序平台对青海地区牙周病患者口腔唾液样本细菌16S rRNA基因(V3-V4区)生物多样性检测,共计获得青海土族12 838 条reads,回族17 640 条,藏族990 条。在相似度97%水平上聚类可操作分类单元OTU,并进行OTU picking,共计获得青海土族OTU数目为181、回族OTU 210 个、藏族38 个OTU,3 个民族每个样本的平均读长均为250 bp,健康对照组OTU共有14 个。物种多样性应用软件Mothur计算Chao1、Shannon指数、PD whole tree和Observed species(表 1)。土族的Observed species为(21~51 个),回族的为(28~88 个),而玉树藏族的为(7~15 个),对照组为(1~5 个),说明土族和回族的可观察物种数多,而藏族的物种数较少,对照组更是单一。Shannon指数和Chao1指数分析表明土族和回族的微生物多样性均较高,藏族的多样性相对较低,对照组的多样性均小于牙周病各亚组。PD whole tree指数显示,牙周病组的微生物系统发育距离总和(0.86-2.33)大于对照组(0.08-0.63),表明牙周病组的微生物群落结构较复杂且系统发育关系亦趋于复杂,而对照组微生物种群进化简单。

表 1 牙周病组和对照组各个样本微生物多样性指数
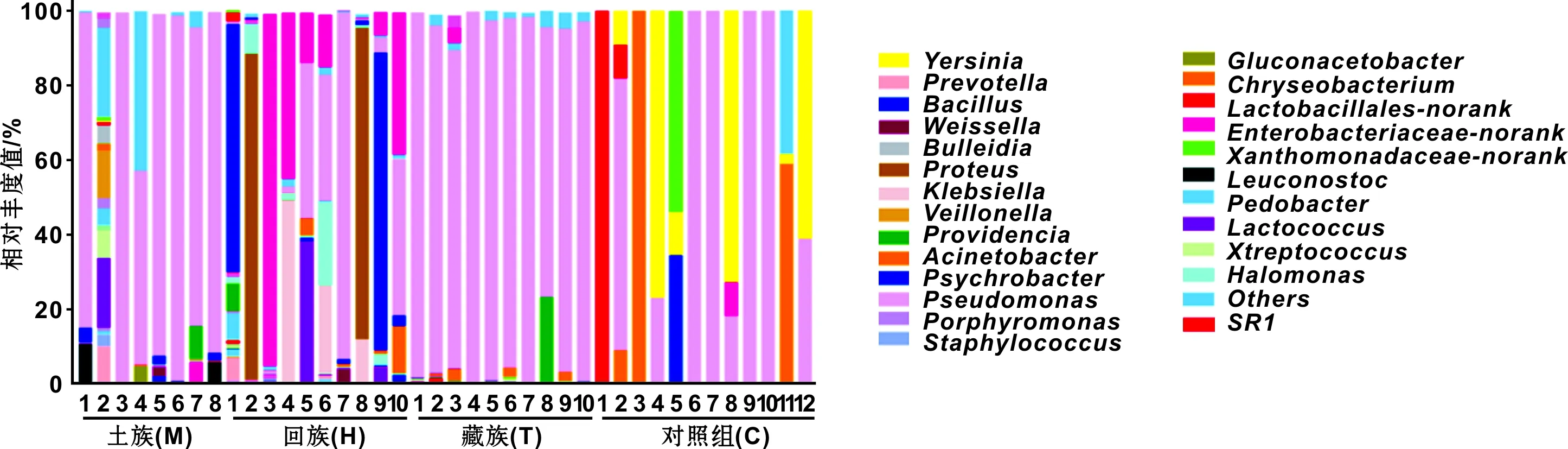
图 1 牙周病(土族、回族、藏族)与对照组的微生物相对丰度统计分析
2.2 种群结构差异分析
利用核糖体数据库(ribosomal database project,RDP)对97%相似水平的OTU代表序列进行分类学分析,并分别在属层次下对各样品物种丰度进行统计分析(图 1),获得土族类群11门19纲87属,回族13门21纲113属,藏族2门4纲21属,对照组分为4门5纲12属。土族和藏族的优势菌明显均为假单胞菌属(Pseudomonas),回族的优势菌种在不同样本中各不同,主要是未分类的肠杆菌科(Enterobacteriaceae-norank),嗜冷杆菌属(Psychrobacter),变形杆菌属(Proteus),乳球菌属(Lactococcus)和Pseudomonas。对照组的优势菌主要是耶尔森氏菌(Yersinia),不动杆菌属(Acinetobacter)和Pseudomonas。相比而言,牙周病组种群结构复杂多样,其中藏族组和土族组群落结构组成相对稳定,回族组成复杂,而对照组微生物种类较少且单一。
2.3 聚类分析
根据样本间的物种丰度和相似性聚类,构建牙周病组Heatmap图谱(图 2)。总体而言,不同样本间的优势类群明显不同,不同民族间亦存在差异,但主要聚类在γ-变形菌纲(Gammaproteobacteria),其中Pseudomonas主要聚集在藏族和土族的样本中,较单一;而回族的种群聚集较多,主要聚集在Enterobacteriaceae-norank、Proteus和Psychrobacter,其他种群在各个民族中含量均较少。表明牙周病患者口腔内的优势菌种因不同民族而不尽相同,其中土族和藏族相似,而回族与前两者相比有较大差异。

图 2 牙周病组聚类Heatmap图谱分析
2.4 致病微生物差异分析
统计分析牙周病与对照组的微生物相对丰度与致病微生物(表 2),土族组、回族组和藏族组的致病微生物各有差异,土族和回族种类较多且复杂,而藏族较单一。目前,已知的致病菌梭杆菌属(Fusobacterium)、普氏菌属(Prevotella)和卟啉单胞菌属(Porphyromonas)在土族组和回族组均有检出,致病菌消化链球菌(Peptostreptococcus)仅在土族组中检出,致病菌密螺旋体(Treponema)仅在回族组检出,然而上述已知的致病菌在藏族组均未曾检出。通过比较分析土族组、回族组、藏族组与对照组,牙周病3个亚组中检出的可疑致病菌主要有肉食杆菌属(Carnobacterium)、颗粒链球菌属(Granulicatella)、嗜血杆菌属(Haemophilus)、盐单胞菌属(Halomonas)和Lactococcus;土族和回族组检出的可疑致病菌主要有凝聚杆菌属(Aggregatibacter)、奇异菌属(Atopobium)、芽孢杆菌属(Bacillus)、拟杆菌属(Bacteroides)、Bulleidia、弯曲菌属(Campylobacter)、纤毛菌属(Leptotrichia)、明串珠菌属(Leuconostoc)、奈瑟菌属(Neisseria)、Oribacterium、小杆菌属(Dialister)、欧文氏菌属(Erwinia)、孪生球菌属(Gemella)、克雷白杆菌属(Klebsiella)、希瓦氏菌属(Shewanella)、葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)和Proteus。此外,藏族特有的可疑致病菌为梭菌属(Clostridium);土族特有的可疑致病菌为环丝菌属(Brochothrix)、卡托菌属(Catonella)、艾肯菌属(Eikenella)、肠杆菌属(Enterobacter)、微单胞菌属(Parvimonas)、嗜胨菌属(Peptoniphilus)和韦荣球菌属(Veillonella)。
3 讨 论
口腔微生物是一个有高度组织的生物膜群体,组成类群极其复杂,多以细菌为主,其生态系统平衡与人类健康密切相关。目前,已知人类口腔中存在有细菌700 余种,其中获得纯培养的有250 多种[8]。在口腔的不同部位,微生物通过共栖、竞争和拮抗等作用方式,在种群、数量和功能上构成了复杂的口腔微生物生态系统,通过协同或合作等方式引起一系列的口腔疾病,因此探究口腔微生物的群落组成及致病菌,是防止口腔疾病发生的关键。本研究利用高通量测序的方法,对牙周病组(土族、回族与藏族)和对照组的口腔微生物群落进行分析,发现牙周病组共计土族OTU181 个(11门19纲87属)、回族OTU 210 个(13门21纲113属)、藏族38 个OTU (2门4纲21属)和对照组OTU 14个(4门5纲12属),表明青海土族和回族的微生物种群结构组成多样化,藏族相对简单。此外,牙周病组的多样性指数Shannon、丰度指数Chao1和可观察物种数均高于对照组,说明牙周病组的微生物复杂多样且种群结构发生巨大变化。
牙周病是一种牙周组织慢性感染性炎症性疾病。已经确定的牙周致病微生物主要有牙龈卟啉单胞菌(Porphyromonasgingivalis)、齿垢密螺旋体(Treponemadenticola)、福赛斯坦纳(Tannerellaforsythensis)、中间普氏菌(Prevotellaintermedia)、具核梭杆菌(Fusobacteriumnucleatum)、伴放线放线菌(Actinobacillusactinomycetemcomitans)、缠结优杆菌(Eubacteriumnodatum)、牙髓卟啉单胞菌(Porphyromonasendodontalis)和Peptostreptococcus[9-11]。丁倩等[12]研究的关于新疆维吾尔族和汉族的牙周病致病菌主要是Porphyromonasgingivalis、Tannerellaforsythensis和Prevotellaintermedia。本研究中不同民族的牙周致病菌不同,土族组和回族组共有的已知致病菌有梭杆菌属(Fusobacterium)、普氏菌属(Prevotella)和卟啉单胞菌属(Porphyromonas),仅在土族组中的致病菌为Peptostreptococcus,回族中仅有的致病菌为Teponema,而藏族组未检出已知的致病菌。可知,青海三大民族牙周病的致病菌与其他地区的其他民族存在差异,可能是不同民族、生活习惯和居住环境不同引起的。
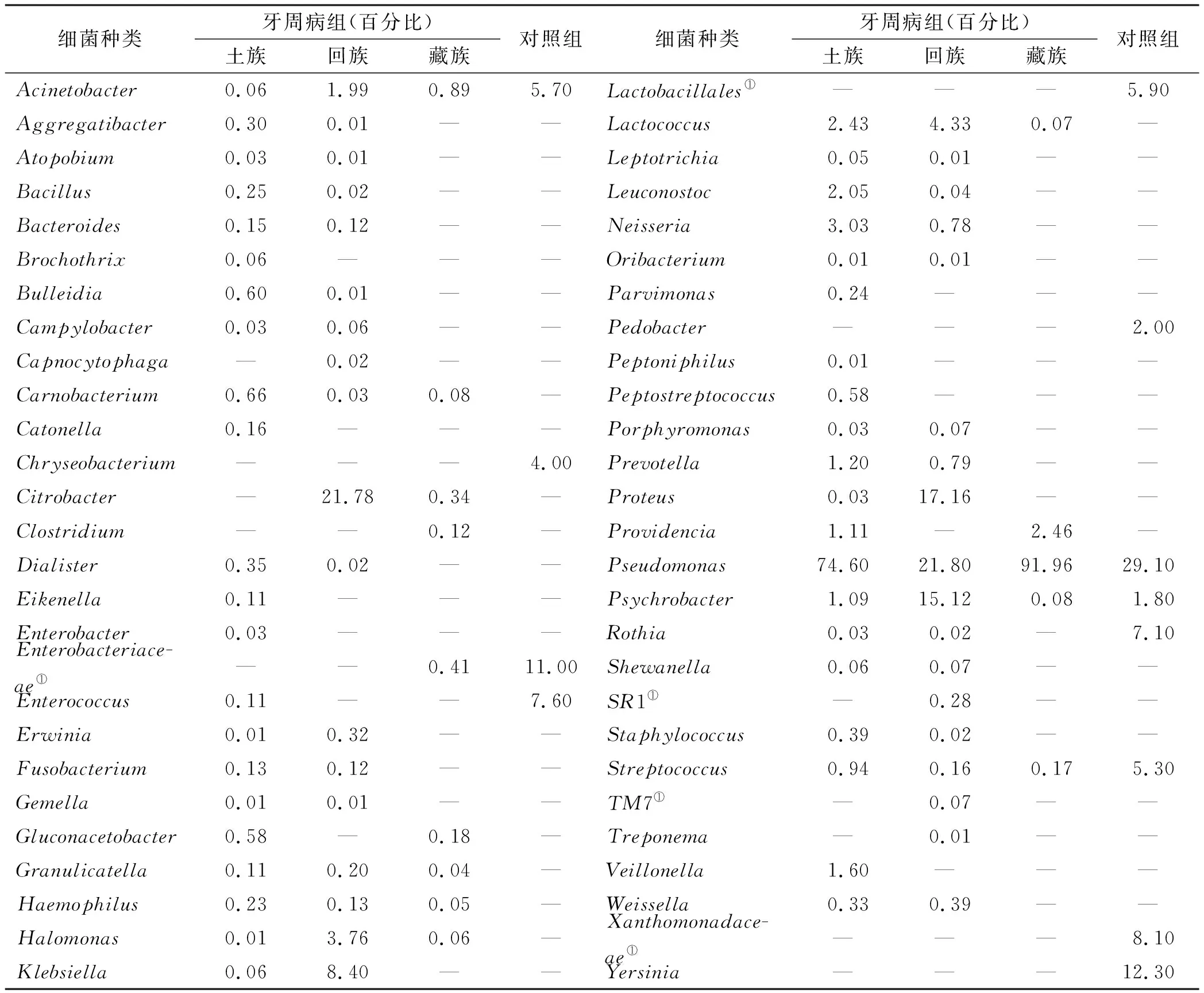
表 2 牙周病组与对照组的口腔微生物统计分析
注:①未明确分类的细菌;—:未检出
通过比较分析牙周病亚组(互助土族组、平安回族组、玉树藏族组)与对照组发现,牙周病3 个亚组中亦检出大量可疑致病菌,3 个民族间的可疑致病菌既有相似性,又有差异,且每个民族中还存在特有的可疑致病菌。土族和回族相同的可疑致病菌有18 种,而藏族与土族和回族的可疑致病菌之间存在较大差异,共有的致病菌仅有5 种。此外,土族检测的特有可疑致病菌有7 种,回族特有的为2 种,其余均与土族相同,而玉树藏族的特有可疑致病菌仅有1 种-Clostridium,该菌为厌氧菌,藏族生活在海拔较高的低氧环境中,利于厌氧菌的生长繁殖,因此Clostridium仅为藏族牙周病患者的可疑致病菌。对比发现,回族和土族的可疑致病菌存在相似性且复杂多样,而藏族的可疑致病菌与前两者相比不仅差别较大,而且种类较单一,这与他们的生活习惯和居住环境有密切关系。另外与乳制品有关的Lactococcus和Leuconostoc、与盐碱环境有关的Halomonas、Carnobacterium和Citrobacter是青海牙周病的特有可疑致病菌;Acinetobacter、Pseudomonas、Psychrobacter和Streptococcus存在牙周病组和对照组中为青海特有的口腔微生物,可能与不同民族间生活习惯和高原特殊环境不同有关。与刘莉等[13]和吴芳等[14]的研究结果相比,青海土族、回族与藏族的致病微生物及可疑致病菌更复杂多样且优势均属明显不同。
青海牙周病组(土族、回族、藏族)和对照组相比,口腔微生物的群落结构、丰度比例及致病菌存在明显差异,可能是生活习惯、居住条件、饮食、环境等因素对口腔微生物群落结构的变化产生重要的影响,导致各民族间的致病微生物产生较大差异[15-16]。如高原特殊环境使机体各系统各器官产生不同程度的缺氧,使厌氧菌生长繁殖加快,且在低氧环境下,口腔内唾液分泌减少,口腔自洁功能减弱,加速了厌氧细菌的生长和菌群的形成,从而引起牙周病[13,17]。玉树藏族人群世居于平均海拔4 000 m以上的青藏高原牧区,与外界接触较少,卫生条件差,以牛羊肉和奶制品为主食,这是导致口腔微生物群落结构与其他民族间产生差异的主要原因,亦是藏族口腔微生物群落结构简单的主要原因。土族和回族则以大杂居的生活方式为主,与外界接触较多,饮食以面食为主,居住环境海拔较低,这使他们形成了复杂多样的微生物群落结构。青海人群的饮食与生活习惯,居住环境等与平原地区民族存在明显不同,致使牙周病致病菌产生较大差异。环境因素和不同民族直接或间接地影响着口腔微生物的群落结构,是造成牙周致病菌产生差异的主要原因。
综上述,本研究中青海三大民族(土族、回族和藏族)牙周病相关微生物的群落结构及多样性均复杂于对照组;其次,3 个民族牙周病的致病菌、可疑致病菌之间亦存在差异,且每个民族均存在特有致病菌。本研究中的3 个民族均为少数民族,需要对其他民族和地区的牙周病患者进行系列研究进一步探讨牙周病与民族间的关系。另本研究取样仅选择唾液样本,而致病菌可能大量存在牙体的病损处,因此后续研究将进一步改进,进行多部位取样。
