大鼠腮腺主导管结扎损伤后再生的初步研究
2018-12-12唐学敏左金华丁长玲朱玉红王晶宋冰毛玉龙
唐学敏 左金华 丁长玲 朱玉红 王晶 宋冰 毛玉龙
为了研究腮腺组织的再生能力[1],本课题组采用了大鼠腮腺主导管结扎再通的模型[2],观察其在不同时间的结扎损伤后腮腺组织的再生能力,并初步探讨其机制,为临床研究由于慢性涎腺炎、舍格伦综合征、以及头面部放射治疗后引起的唾液分泌功能障碍疾病提供理论依据。目前治疗唾液腺机能减退的方法主要是刺激残余唾液腺的分泌能力和人工唾液代替,然而这些方法只能提供临时的作用不能恢复腺体的功能[3]。涎腺再生技术为各类原因导致的涎腺功能障碍提供了新的治疗观念,再生机制的研究也成近几年研究的热点[4]。
1 材料与方法
1.1 主要试剂
HE试剂盒、AB-PAS试剂盒(北京索莱宝科技有限公司);一抗:PDCD5多克隆抗体(兔抗大鼠)、AQP5多克隆抗体(兔抗大鼠)、二抗:山羊抗兔(北京中杉金桥生物技术有限公司),其余试剂购自碧云天生物技术公司。
1.2 动物模型
8 周龄Wistar大鼠54 只,随机分成9 组,每组6 只,4%水合氯醛1 ml/100 g腹腔注射麻醉下分离出腮腺主导管用3号丝线将导管结扎于1 mm钢丝,于结扎第7天再通,分别取再通后的第0、3、5、7、10、14、21、28 d的腮腺组织,部分用福尔马林固定制作蜡块,用于HE染色和AB-PAS染色;部分冷藏于-80 ℃冰箱做Western blot实验。
1.3 实验方法
1.3.1 HE染色和AB-PAS染色 各组腮腺组织在福尔马林固定24 h,经逐级脱水制成蜡块,切成4 μm厚的切片,经脱蜡后染色,分别按照试剂盒说明书操作。观察腮腺导管再通后腮腺组织镜下的形态学变化。
1.3.2 Western blot实验 将冷藏于-80 ℃的腮腺组织取80 g加入裂解液研磨,严格按说明书操作步骤测量蛋白浓度,将30 μg蛋白上样于10%SDS凝胶,恒压80 V 50 min,恒压100 V 50 min,电泳结束后,恒流250 mA 1 h,将蛋白转印至PVDF膜,PDCD5和AQP5一抗孵育,4 ℃过夜,TBST洗涤3 遍后,二抗室温下摇床孵育1 h,TBST洗涤3 遍后,经曝光检测目的蛋白的表达,GAPDH对照组,实验重复3 次。
1.4 统计学分析
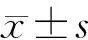
2 结 果
大鼠腮腺主导管结扎再通的模型构建成功,主导管结扎后腮腺组织萎缩,微观结构表现为腺泡细胞减少,导管系统扩张,导管再通后腺体形态逐渐恢复,腺泡细胞增多,导管系统萎缩,腺体功能逐渐恢复。
HE染色结果:对照组腺泡细胞紧密排列,占腺小叶的大部分,导管分布均匀,占腺小叶的小部分,闰管、纹管、分泌管大小形态明显容易分辨。再通0 d腮腺组织,腺泡细胞减少明显,镜下有少量残存腺泡细胞,炎症细胞明显;再通1 d腮腺组织腺泡细胞有增生的现象,导管萎缩不明显;再通3 d的腺泡细胞明显增多,导管萎缩明显,视野内腺泡细胞与导管的比例增大;再通7 d组织腺泡细胞明显增多,导管样结构较少;再通14 d组织,与正常对照组差别基本不大,腺泡细胞和导管基本恢复至正常水平,炎症细胞显著减少,腺泡排列紧密,导管形态较清晰。再通21 d和28 d组织镜下与正常组无差别,腺小叶及导管形态与正常组一致。结果如图 1。
AB-PAS结果:对照组见腺泡细胞内丰富的紫红色颗粒,导管内可见部分有紫红染色。再通0 d可见腺泡内紫红色颗粒减少,导管内几乎未见紫红染色,再通3 d紫红色颗粒明显增多,导管内鲜有紫红染色;再通7 d组,腺泡细胞丰富,紫红色颗粒丰富,导管内有较少的紫红色颗粒。再通14 d组镜下腺泡与再通21 d、28 d及正常组无明显差别,导管内可见有紫红色分泌颗粒。结果如图 2。
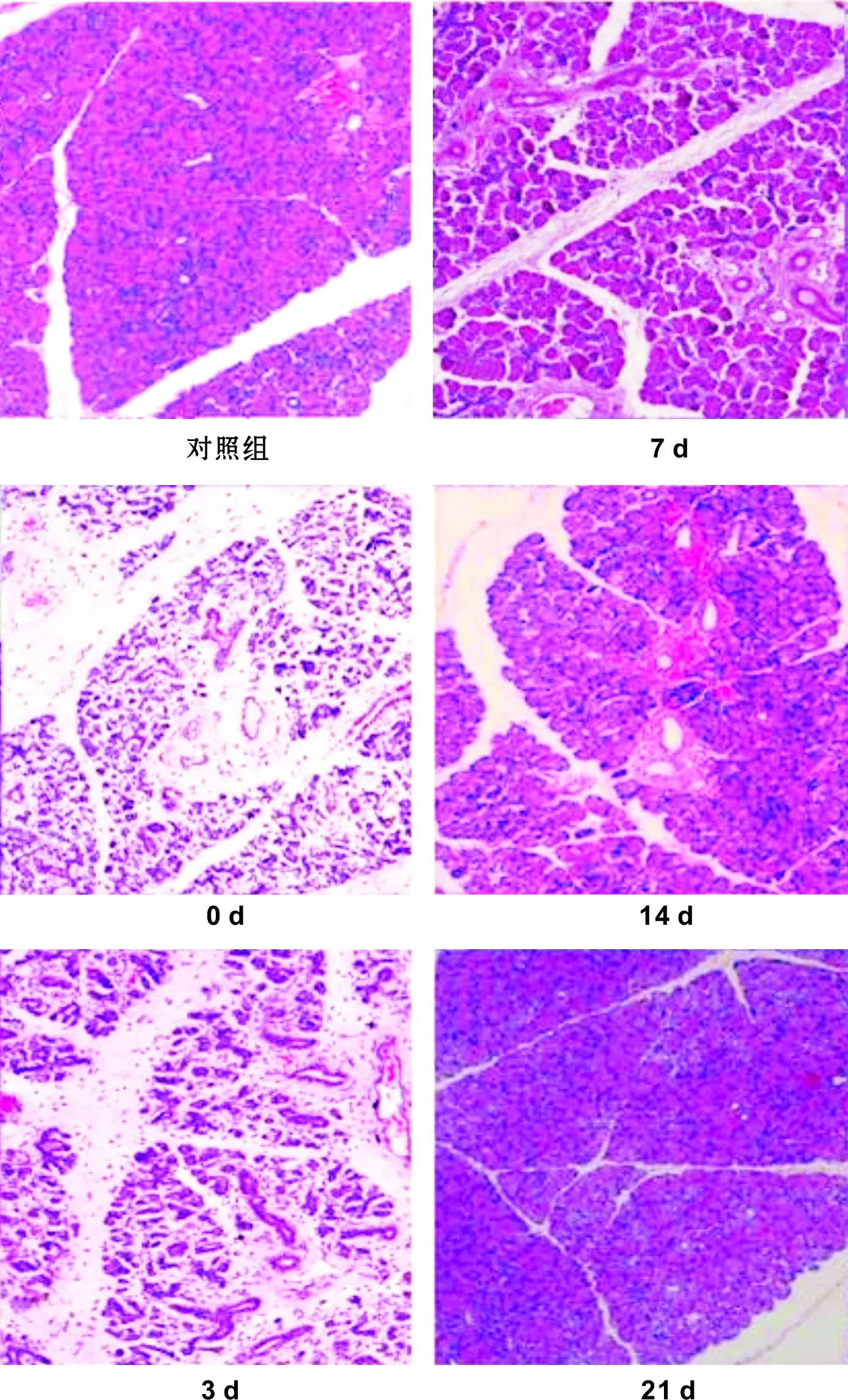
图 1 大鼠腮腺组织再通后不同时间点组织形态 (HE, ×200)
Western blot结果显示:AQP5蛋白表达逐渐增多趋势,至再通第7天时与对照组无明显差别,PDCD5蛋白表现为先增多后减少最后趋于稳定的趋势,第3天时达到最多,第10天后表达趋于稳定(图 3)。
3 讨 论
涎腺损伤的模型主要有腮腺导管结扎、涎腺辐射模型等,对于研究慢性涎腺炎、舍格伦综合征等腺体功能降低的疾病采用导管结扎的模型较多,Tamarin等[5]通过丝线直接结扎的方法将导管阻塞,Miyazaki[6]采用一种小镊子,钝性分离出腮腺主导管将导管夹住,达到结扎的目的。Maria等[7]采用3号丝线双结扎的方法结扎兔颌下腺主导管。Burford-Mason 采用一种微型的夹子,夹子呈V形,两臂长15 mm的不锈钢丝嵌入一个聚乙烯管的套筒中,通过显微手术将夹子放置在导管上,夹子的两臂紧紧的夹在一起,直到夹子不能沿着导管方向来回移动。本实验采用3号丝线将钝性分离后的导管结扎于直径1 mm的钢丝上,按时间将丝线及钢丝去除,结果显示结扎后腺体萎缩,再通后腺体再生,且通过HE、AB-PAS染色及Western blot分析显示,结扎7 d再通后腺体14 d后可基本恢复至正常,实验结果显示大鼠腮腺腺泡形态恢复的同时,其分泌功能也恢复。
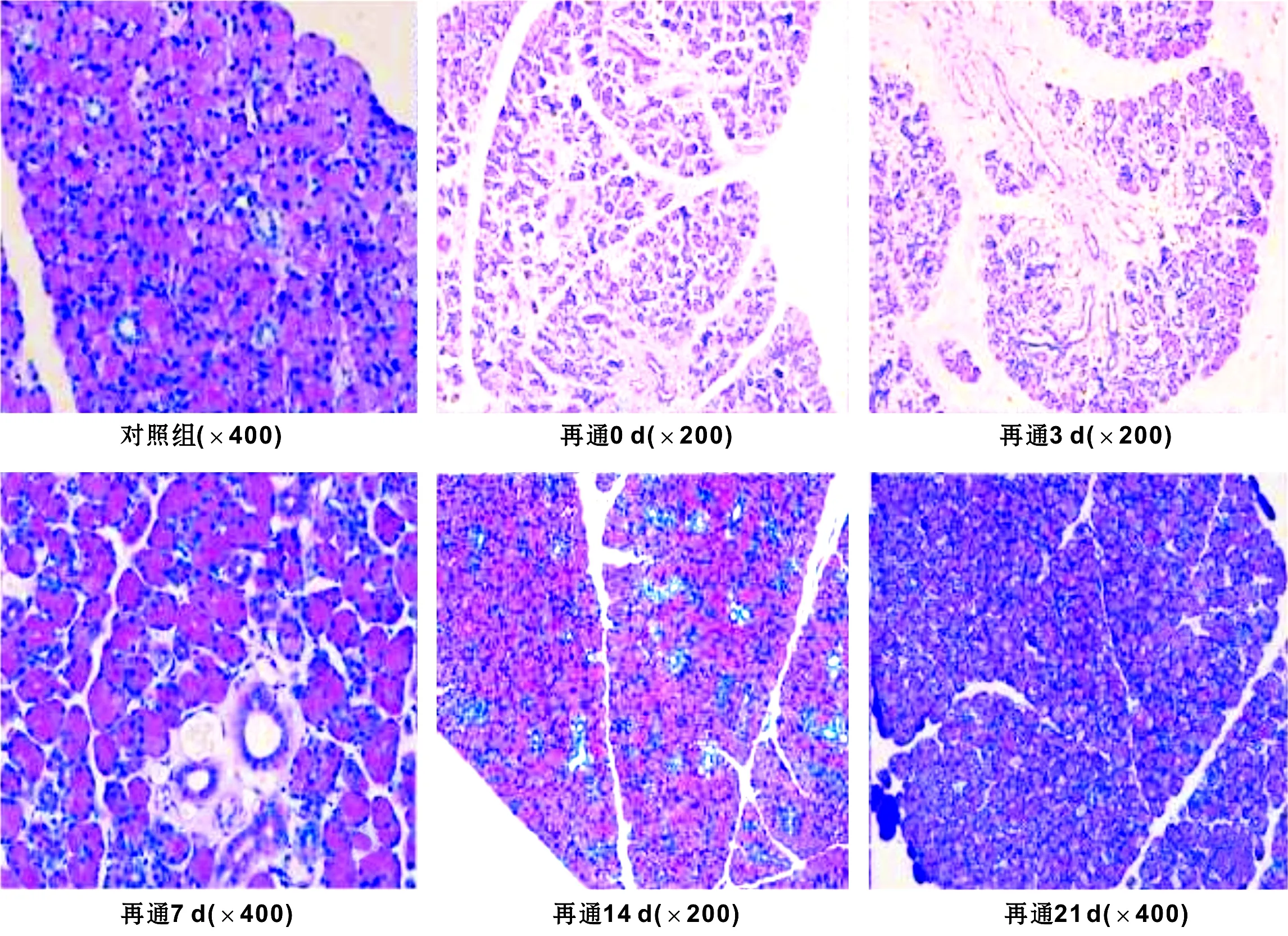
图 2 大鼠腮腺组织再通后不同时间点AB-PS染色
图 3 大鼠腮腺主导管再通后不同时间点AQP5和PDCD5的表达
AQP5是一族广泛存在于原核和真核细胞膜上选择性高效转运水分子的特异性通道,AQP5表达于上皮的顶质膜,在AQP5敲除的小鼠,匹洛卡品刺激的唾液分泌显著减少[8],唾液粘稠高盐,表明腺泡上皮顶质膜是唾液分泌的限速部位,AQP5的表达结果与PAS染色结果均显示导管再通第14天时腺体的形态及分泌功能恢复至正常水平,其形态恢复的同时,腺泡的分泌功能也同时恢复。PDCD5是凋亡的正调节分子,具有促进细胞凋亡的功能,在正常的腮腺组织中低表达,腮腺主导管再通0 d时由于腺泡细胞的凋亡PDCD5出现高表达,再通3 d时由于导管细胞的迅速凋亡,PDCD5出现表达的增多。实验结果说明腮腺导管再通后萎缩的腺体形态和功能都可基本恢复,腮腺主导管再通后扩张的导管系统由于失去了外在压力,增生的导管迅速凋亡,逐渐恢复至正常水平。
腮腺组织再生的腺泡细胞来源是近年来学者争论的焦点,Man等[9]认为位于闰管的干细胞是涎腺中所有细胞类型的来源。而Aure等[10]则通过示踪标记的干细胞6 个月发现干细胞的数量没有明显减少,因此他认为腺泡细胞数量的维持是由自身复制而来,干细胞的作用不大。Cotroneo等[11]认为再生的腺泡细胞是由于激活了残存导管中的干细胞分化而来。卢浩等[12]认为能够抵抗凋亡的腺泡细胞是再生腺泡的组织来源。Lombaert等[13]通过细胞家系追踪发现祖细胞群在胚胎时期能够分化成各类细胞,但在出生后的腺体未发现有明显证据。Rugle-Stahl等[14]通过研究干细胞表面因子Asc13发现分离出的成熟腺体中表达Asc13的细胞能够在试管中分化成腺泡细胞和导管细胞,但在活体内未被证实。Sugito等[15]通过将体外培养的涎腺上皮细胞移植到大鼠正常颌下腺和再生过程中的颌下腺中发现在生长中的颌下腺中可以存活4 周,而在正常颌下腺不能存活,因此他认为细胞的吸附和存活很大程度上依赖于腺体的内环境。Nair等[16]研究发现涎腺的功能恢复是多种因素综合作用的结果,多能干细胞在涎腺发育和再生过程中有促进分化的潜力。Ogawa等[17]认为几乎所有的器官都起源于上皮和间充质细胞,通过生物工程再造的技术可以准确地在试管内再生腺体。依据本实验的结果作者认为腮腺组织具有损伤后再生的能力,结扎7 d的腮腺组织再通后可恢复其形态与功能,表明腮腺组织在受到一定的损伤程度内可恢复至正常,但更严重的损伤是否能够恢复以及再生的腮腺组织来源于何处有待进一步的研究。
