p38-MAPK和STAT3信号分子靶点对微氧化应激下牙髓干细胞增殖、分化的影响
2018-12-12胡红梅廖家万李伟曾常爱
胡红梅 廖家万 李伟 曾常爱
牙髓微环境中具有分化潜能的细胞可在信号分子的诱导下发生分化并形成修复性牙本质。牙髓干细胞(dental pulp stem cells,DPSCs)是由Gronthos等[1]于2000 年提出的概念,在牙组织修复过程中起着重要作用。DPSCs在增殖过程中一些信号通路被激活,其中较为重要的是促分裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)家族的p38-MAPK和其下游基因信号传导转录活化蛋白3(Signal transducers and activators of transcription 3,STAT3),Lee等[2]和Wang等[3]研究发现p38-MAPK和STAT3参与了DPSCs 向成牙本质细胞分化,并介导牙髓干细胞内信号转导,对细胞的分化指标碱性磷酸酶活性具有调控作用,但是其中的具体分子机制并不清楚。本实验探讨了微氧化应激下p38-MAPK信号通路和STAT3信号靶点对DPSCs增殖和分化的分子调控机制。
1 材料与方法
1.1 主要试剂与主要仪器
DPSCs(保存于井冈山大学医学部中心实验室);DMEM培养基、胎牛血清(Gibco,美国);CCK-8试剂盒(Sigma,美国);PVDF膜(Bio-Rad,美国);ECL增强化学发光检测试剂盒(PIERCE,美国);TEMED(Amersham Pharmacia Biotech,美国);胰蛋白酶、蛋白裂解液(碧云天);SB203580、AG490(Selleck,美国);Trans-Blot®SD Cell半干转仪、电泳仪(Bio-Rad,美国);脱色摇床(海门市麒麟医用仪器厂);图像分析系统(LabworksTM Analysis Softwar,美国);GDS8000凝胶扫描系统(UVP,美国)。
1.2 方法
1.2.1 DPSCs微氧模型建立 DPSCs进行复苏,置培养板于无菌密闭容器,进气口通入含3%O2,92%N2,5%CO2混合气体,经出气口流出,使容器内保持微氧状态,在此条件下培养细胞到相应时间点后进行检测收样。实验分组情况:1组:常氧组(空气,21%O2);2组:常氧组+SB203580抑制(终浓度为20 μmol/L);3组:常氧组+AG490(终浓度为65 μmol/L);4组:微氧组;5组:微氧组+SB203580抑制(终浓度为20 μmol/L);6组:微氧组+AG490(终浓度为65 μmol/L)。加药处理组需在微氧前加入终浓度为20 μmol/L的SB203580抑制剂或者是加入终浓度为65 μmol/L的AG490抑制剂,然后再进行微氧处理。
1.2.2 CCK8检测DPSCs增殖 取生长状态良好的第3代DPSCs,制成单细胞悬液,计数调整细胞浓度至1×105/ml,待DPSCs贴壁以后,按照实验分组处理细胞,每组设3 个复空,将培养板分别置于常氧箱和缺氧箱内,继续培养DPSCs至12、24、36 h,每孔加入10 μl CCK-8溶液(注意不要产生气泡),于培养箱内孵育1~4 h,用酶标仪测定在450 nm处的吸光度值,同时设置空白孔(培养基、CCK),对照孔(未经处理的DPSCs、培养基、CCK)。
1.2.3 矿化结节形成检测 用浓盐酸调节PBS溶液pH至4.2,称取1 g茜素红溶于100 ml中的溶液中,完全溶解,培养细胞贴壁以后,按照实验分组处理细胞,PBS漂洗,4%多聚甲醛处理,茜素红染液,双蒸水冲洗,干燥,封片。
1.2.4 流式细胞仪检查细胞周期 收集1~5×105DPSCs,加入1 ml冰浴预冷70%乙醇中,吹打混匀,4 ℃固定2 h,离心,沉淀细胞,吸除上清,加入0.5 ml碘化丙啶染色液,用流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。
1.2.5 QRT-PCR检测人DPSCs中ALP表达 ALP引物设计由上海生工合成,其ID:249,hALPF:GTGGCAACTCTATCTTTGGTCTG,hALPR:CGCCTGGTAGTTGTTGTGAGC,长度158 bp;内参基因hactinf:TGACGTGGACATCCGCAAAG,hactinr:CTGGAAGGTGGACAGCGAGG,长度205 bp。提取RNA,将RNA 沉淀溶解于适量(20~50 μl)的无RNase水中。反转录反应体系的配制(总体积20 μl):2×RT buffer 10 μl,6 N随机引物(100 pmol/μl) 1 μl,RT-mix 1 μl,模板(RNA) 5 μl,DEPC水3 μl,条件的设置:25 ℃ 10 min,42 ℃ 50 min,85 ℃ 5 min;荧光定量PCR反应体系的配制:(总体积50 μl),2×PCR buffer 25 μl,Primers(25 pmol/μl)1 μl×2,Sybr green I(20*)0.5 μl,模板*(cDNA)2 μl,DEPC水20.5 μl,荧光定量PCR扩增条件的设置:94 ℃ 4 min,94 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s循环35 次,72 ℃检测信号。
1.2.6 WB检测人DPSCs中 PCNA表达 首先总蛋白提取,使用分光光度计测定562 nm处的吸光度值,测定时,使用1 ml比色皿,用ddH2O校零,尽可能在20 min内检测完毕所有样品,各浓度BSA标准品溶液的吸光度值减去Blank值的平均值,绘制 BSA 标准品溶液的标准曲线,SDS-PAGE电泳,电泳条件:120 V,10 min,200 V,30 min,将夹子打开使黑的一面保持水平,在上面依次垫海绵垫、滤纸、胶、PVDF膜(经甲醇活化)、滤纸、海绵垫,同时将电泳液换成转移液,取出膜,并做好正反面标记,在TBST中清洗1 min,然后用5%脱脂牛奶封闭液室温封闭2 h,用封闭液将对应的一抗稀释成一定的浓度(1∶500),内参一抗的稀释终浓度为1∶1 000,然后温育1.5 h或4 ℃孵育过夜。用TBST洗3 次,每次5 min,用封闭液将二抗稀释成一定的浓度(1∶1 000),然后温育1.5 h,曝光检测。
2 结 果
2.1 DPSCs形态学观察
DPSCs在培养21 d 后,倒置相差显微镜下可见细胞呈长梭形并贴壁生长,传代后的细胞增殖迅速且呈漩涡状排列,部分可出现集落生长,集落间细胞分散,形状类似成纤维细胞样,细胞较大,培养21 d的光镜照片,放大倍数为100 倍,细胞形态为长梭型,融合成单层细胞(图 1)。各组之间的细胞形态都呈长梭型,常氧各个组的细胞数量较密集,数量较多,微氧各个组的细胞相对数量较少,差别比较明显。

图 1 6组培养的细胞形态
2.2 CCK8检测牙髓干细胞增殖活性的结果
DPSCs在微氧微环境中生长时,较其在常氧微环境中生长的吸光度值低,尤其在培养36 h后更加明显,在12、24 h 各微氧组的光吸收度值变化幅度较小;而常氧组吸光度值增加较多(图 2),在36 h时抑制p38-MAPK时变化较明显,经SPSS 17.0分析,各微氧组的光吸收度值与常氧组的光吸收度值相比,在24、36 h均具有统计学意义(P<0.05),显示常氧环境下抑制p38-MAPK时更能促进 DPSCs细胞的增殖,而微氧环境下抑制STAT3致细胞增殖不明显,而且在各组牙髓干细胞不同时间段存活率显示(表 1),常氧环境及常氧环境下抑制p38-MAPK时DPSCs细胞的存活率也较高,且与各组比较具有统计学意义(P<0.05)。

图 2 各组DPSCs生长曲线图
2.3 矿化结节的形成情况
各微氧组及常氧组DPSCs均见橘红色矿化结节(即钙结节)形成(图 3),其中微氧各个组形成的矿化结节大小及数量较多,尤其微氧且抑制STAT3组显示有大量的细胞矿结节,常氧组抑制p38-MAPK组的细胞矿化结节较少,且细胞数量也较少。提示微氧环境可以更好的促进牙齿硬组织的形成,STAT3信号分子和p38-MAPK通路的激活在牙齿硬组织的形成中可能存在相反的作用。
2.4 流式细胞仪检测 DPSCs增殖周期情况
微氧各组和常氧各组的DPSCs的细胞周期、二倍体水平的流式细胞检测仪检测结果见表 2和图 4。由图可见,当DPSCs在常氧且抑制p38-MAPK通路时,在各组中细胞分裂最为旺盛;当DPSCs在微氧且抑制STAT3信号分子时,在各组中细胞分裂最不明显,通过SPSS 17.0软件分析,微氧且抑制STAT3信号分子组和其它各组的细胞分裂指数(PI)具有统计学差异(P<0.05),说明 DPSCs体外培养时,当培养微环境为常氧时,不论是抑制p38-MAPK通路还是STAT3信号分子时,都可以明显促进细胞的分裂。

表 1 6 组DPSCs不同时间段存活率

表 2 6 组DPSCs增殖周期的影响
注:①第6组与其它组比较,P<0.05
2.5 QRT-PCR检测DPSCs中ALP表达情况
各组的DNA溶液作为模板进行QRT-PCR 扩增,本实验扩增效率均在R2=0. 997 8,均方差=0.095 3,斜率-3.417 7,截距=46.422 6,说明扩增效率接近100%,提示不同梯度定量模板的对数值与循环数之间,相关关系较好,证明数据可靠性较高。表 3显示微氧组和微氧且抑制STAT3组的相对比值明显高于其它组,证明mRNA表达多,即ALP表达情况较高,通过单因素方差分析P<0.05,说明这几组之间的差别是有显著性。熔解曲线分析结果显示目的基因熔解曲线如图 5所示,ALP PCR产物以及标准品(内参)均在大于84 ℃以上获得单一熔解峰,说明在该反应条件下,扩增反应产物溶解温度较均一,目的基因具有很好的特异性,反应体系良好。
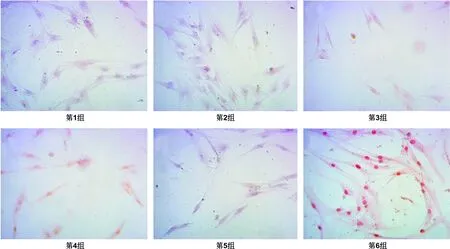
图 3 6 组的细胞茜素红染色

图 4 流式细胞分析图

表 3 ALP Q-PCR扩增数据
注:①第6组及第4组与其它组比较,P<0.05

图 5 ALP扩增曲线和熔解曲线

图 6 BSA 标准品溶液的标准曲线

图 7 Westernblot检测PCNA蛋白的表达
2.6 WB检测人DPSCs中PCNA表达
标准曲线的R值为0.995 3,说明本次曲线拟合度较好。通过DPSCs的蛋白质含量Western blot检测以及灰度值发现,在相同的实验条件下,各组均检测到目的基因的表达,显示常氧环境下抑制p38-MAPK时积分光密度较高,而微氧环境下抑制STAT3致积分光密度较低,说明常氧且抑制p38-MAPK时细胞增值率高,而微氧且抑制STAT3时细胞增值率低,且与各组比较具有统计学意义(P<0.05)(图 6~7,表 4)。

表 4 PCNA蛋白条带灰度值分析
3 讨 论
有关DPSCs增殖、分化的组织调控内外环境因素比较复杂,为了达到组织工程化应用的目的,国内一些学者进一步开拓了研究视野[4-5]。但是目前DPSCs大多是在体外氧张力为(18%~21%O2)的空气中培养,细胞没有受到自身牙髓中的微环境的控制,因此DPSCs的增殖分化效果难以评估。Kim等[6]认为微氧环境下细胞表现出生长速度加快,集落增多;Dos等[7]也认为氧浓度降低有助于维持细胞的活性,但有学者却认为持续性微氧环境抑制细胞增殖,低氧不利于细胞生长,表现为细胞的增殖能力受抑制、细胞周期停滞在G1期及侵袭能力降低[8-9]。因此本次实验选择了培养微氧组的DPSCs和常氧组的DPSCs来研究其中的差异,发现在培养过程中常氧组的细胞数量较密集,数量较多,微氧各个组的细胞相对数量较少,常氧环境中生长的DPSCs吸光度值更高,进一步研究细胞PCNA蛋白的表达,发现常氧组的目标蛋白表达较微氧组高,可以明显促进DPSCs的增殖,而微氧组DPSCs增殖不明显。由于细胞的增殖与分化受各种生长因子和其相应的受体组成的精密有序的信号通路网控制,p38-MAPK通路在转导细胞外信号通路中发挥着重要的作用,STAT3也广泛表达于不同类型的细胞和组织中,参与细胞生长,凋亡等功能的调控。因此我们采取抑制p38-MAPK通路和STAT3来进一步研究DPSCs的增殖和分化,结果发现培养环境为常氧且分别抑制p38-MAPK通路和STAT3时,p38-MAPK通路明显抑制DPSCs的增殖,STAT3信号分子促进DPSCs的增殖;在微氧且抑制p38-MAPK通路和STAT3时,实验结果与常氧环境竟然一致,由于STAT3是p38-MAPK的下游基因,研究结果提示p38-MAPK通路抑制可能激活STAT3信号分子,导致DPSCs的大量增殖,但是其中的具体分子机制并不清楚。在细胞的分化研究中,发现微氧组的细胞矿结节和更高的ALP表达,提示在微氧环境下DPSCs的分化能力更强,更能促进牙齿硬组织的形成。Lennon等[10]认为大鼠的骨髓间充质干细胞在低氧条件下,成骨能力会增强,Grayson[11]表达了相似的观点,这与本实验的结果也一致。同时在微氧且抑制STAT3组显示有大量的细胞矿结节和更高的ALP表达,常氧且抑制p38-MAPK组的细胞矿化结节较少,且细胞数量也较少,ALP表达,而且微氧组抑制STAT3组的相对比值明显高于其它组,证明mRNA表达多,即ALP表达情况较高,提示p38-MAPK通路在常氧和微氧环境下对DPSCs分化都起到促进作用,STAT3信号分子在常氧和微氧环境下对DPSCs分化都起到抑制作用。
综上所述,DPSCs在微氧环境下的增殖效果较差,但是分化能力更强,更能促进牙齿硬组织的形成,而且p38-MAPK通路抑制DPSCs的增殖,对DPSCs分化起到促进作用,STAT3信号分子促进DPSCs的增殖,对DPSCs分化起到抑制作用,对于p38-MAPK通路和STAT3信号分子之间在DPSCs的增殖和分化中的协同作用将进一步研究。
