不同植入扭矩对牙种植体-骨结合影响的动物实验研究
2018-12-12于惠柳忠豪许胜
于惠 柳忠豪 许胜
骨结合是种植体成功的标志,也是种植体承载各种负荷的基础[1-2]。骨结合不仅受种植体材料、种植部位等因素影响,种植手术时的植入扭矩也发挥重要作用[3-4]。适当的植入扭矩是种植体植入后,拥有良好初期稳定性的必要条件之一[5]。BLBⅢ牙种植体的最佳植入扭矩尚未见国内外报道。本实验以Beagle犬为研究对象,探讨不同植入扭矩对BLBⅢ种植体-骨结合的影响。
1 材料与方法
1.1 主要仪器试剂
BLBⅢ种植体(含螺纹的最大直径为3.3 mm,去除螺纹后的直径为2.8 mm,长8.0 mm,HA表面处理);盐酸四环素、茜素红(Amresco公司,美国);磨片机、EXAKT300CP切片机(EXAKT400,德国);IPP 6.0测量软件、图像分析仪Cell Sens(Olympus BX61,日本)。
1.2 实验方法
以Beagle犬为研究对象,每只犬选取4 个实验位点(双侧下颌第二、第四前磨牙),每个位点植入两枚种植体,进行植入扭矩≤15 N·cm(A组)、25 N·cm(B组)、35 N·cm(C组)、≥45 N·cm(D组)四组实验。根据拉丁方实验设计方法,可以确定每个位点的植入扭矩值。植入时间点不同,32 枚种植体随机分为Ⅰ、Ⅱ两组:全麻下拔除4 只犬8 个位点的牙齿进行牙种植术(Ⅰ组);Ⅰ组种植体植入1 月时进行另外8 个位点的种植术(Ⅱ组)。A组到D组的实验,终末成形钻直径均为2.8 mm,借助扭矩扳手植入种植体。BLBⅢ扭矩扳手的尾部清晰标明4 个刻度:15、25、35、45(单位:N·cm)。Ⅰ组植入2 个月时同时处死4 只犬。动物处死前第13、14天皮下注射四环素(30 mg/kg/d),处死前第3、4天皮下注射茜素红(30 mg/kg/d),进行双色荧光标记。
1.3 标本制备
32 枚种植体,Ⅰ、Ⅱ组各16 枚,将Ⅰ、Ⅱ组各分为A、B、C、D组,每组4 枚。硬组织切片机将每枚种植体等分两半:一半行脱钙标本制作,一半不脱钙制作带种植体的硬组织切片。
32 张脱钙标本,Ⅰ、Ⅱ组各16 张,Ⅰ、Ⅱ组各分为A、B、C、D组,每组4 张,行HE染色。
32 张硬组织切片标本,先行荧光观察再做特殊染色,Ⅰ、Ⅱ组各半,Ⅰ、Ⅱ组各分成A、B、C、D组,每组4 张。
1.4 研究方法
1.4.1 临床检查 术后1 周检查牙龈状况及种植体有无松动。
1.4.2 X线检查 观察种植体-骨界面新生骨质的密度。
1.4.3 光学显微镜观察 脱钙标本HE染色,硬组织切片亚甲基蓝-酸性品红染色。镜下对比不同实验组界面的反应。
1.4.4 荧光显微镜观察 以不同波长的光谱激发荧光后拍照,IPP 6.0软件测量两种荧光带的间距,计算骨平均矿化率。
1.4.5 骨计量学参数测定 20 倍镜下随机选取3 个螺纹近远中各6 个斜面作为观察区,IPP 6.0测量界面结合部分的长度及面积。计算:①种植体-骨结合率(bone ingrowth fraction,BIC)=(界面新骨面积/界面总面积)×100%;②骨结合指数(osseointegration index,OI)=(界面骨结合部分的长度/种植体-骨界面的总长度)×100%。
1.5 统计学分析
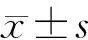
2 结 果
2.1 临床检查
实验动物无一患病、死亡。术区创口愈合良好,32枚种植体未见松动、脱落。
2.2 影像学
Ⅰ组种植体周围骨密度较Ⅱ组明显增高,骨小梁排列更加整齐致密,界面未见明显透射影。Ⅱ组种植体周围见线形密度略低区 (图 1)。
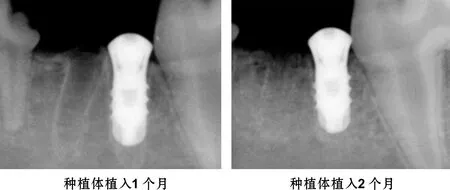
图 1 种植体植入后X线片
2.3 光镜观察
2.3.1 HE染色 Ⅰ组新骨较Ⅱ组明显增多。Ⅰ、Ⅱ组成骨均以B、C组较好(图 2)。A组界面偶见成骨细胞(osteoblast,OB)(图 3)。D组界面有大量成纤维细胞(fibroblast,FB),排列紊乱,破骨细胞(osteoclast,OC)明显可见(图 4)。B、C组界面见大量成骨细胞,部分区域出现骨基质(bone matric,BM),未见纤维组织。
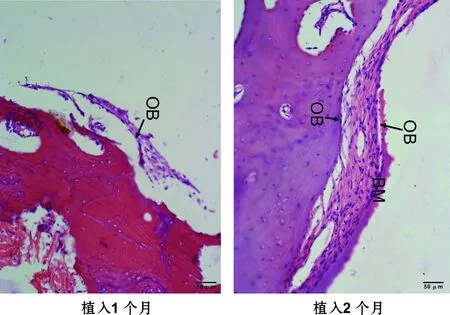
图 2 植入扭值25 N·cm (HE,×200)
2.3.2 特殊染色 Ⅰ组新骨较Ⅱ组明显增多(图 5)。A、D组种植体周围偶见矿化骨基质。D组界面有大量纤维组织出现,排列紊乱,破骨细胞明显可见(图 6)。B、C组板层骨形成,骨小梁结构较为粗大致密且连续性好,界面未见纤维组织(图 5A)。
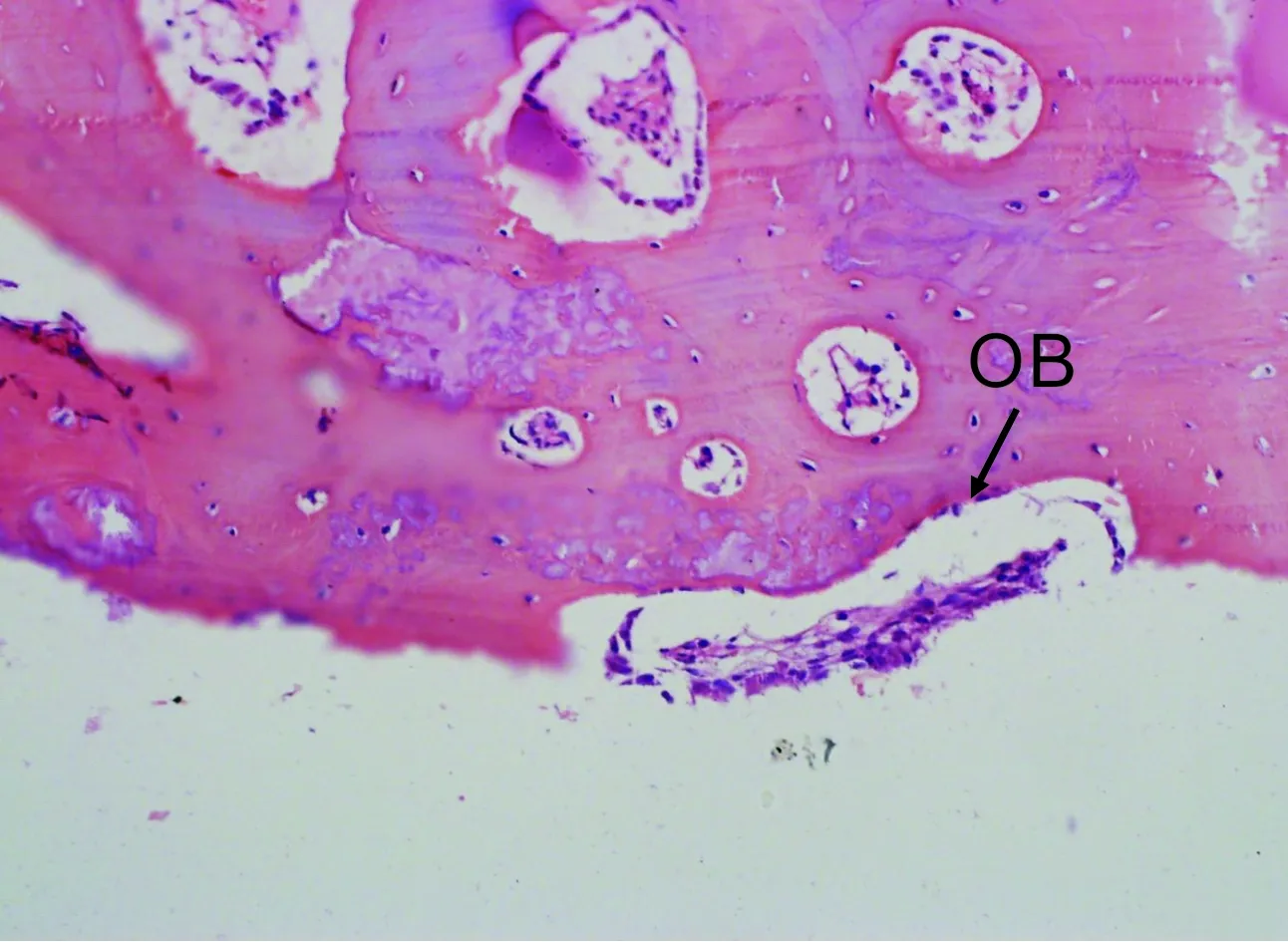
图 3 植入扭矩值15 N·cm植入后2 月 (HE,×200)
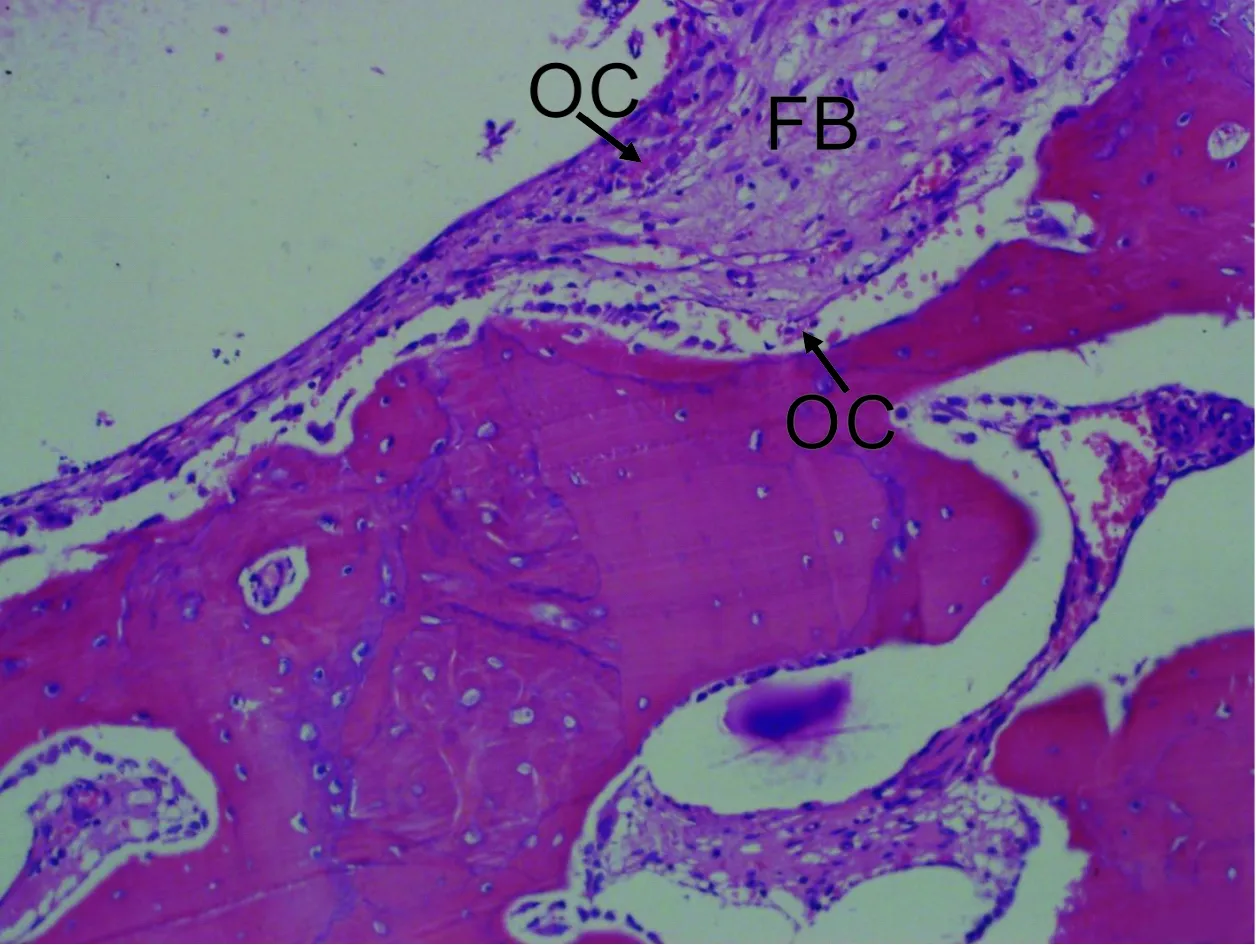
图 4 植入扭矩值45 N·cm植入2 月 (HE,×200)
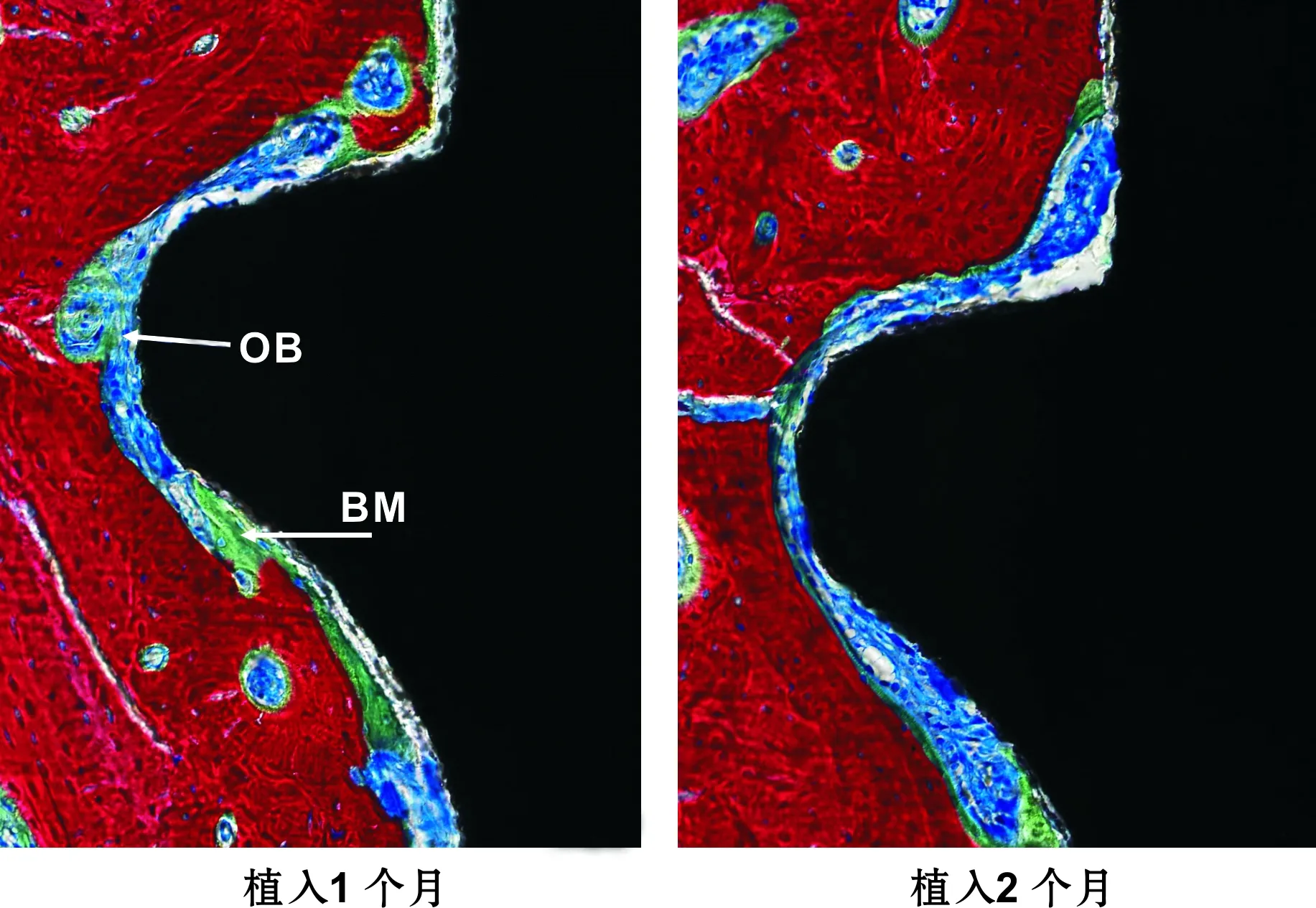
图 5 植入扭矩值25 N·cm (亚甲基蓝-酸性品红,×200)
2.4 荧光显微镜观察
各组均见到清晰明亮的2 条荧光带位于新生骨边缘:四环素呈现的金黄色及茜素红呈现的红色,两者间边界清晰,新骨先沉积于种植体表面再向外生长(图 7)。测量荧光带间距,计算矿化速率(图 8,表 1~3)。
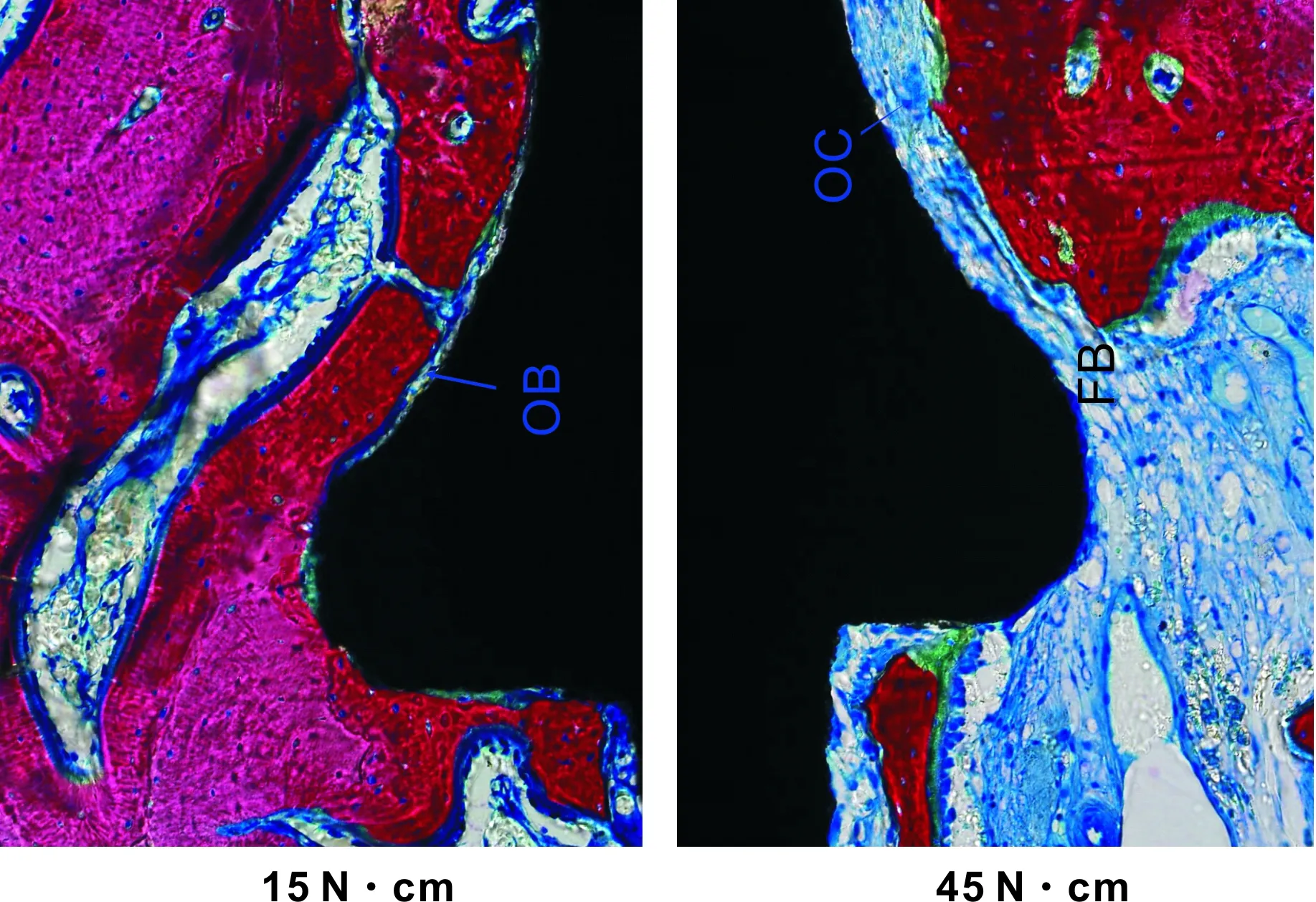
图 6 植入后2 个月 (亚甲基蓝-酸性品红,×200)

图 7 种植体-骨界面的骨质生长 (四环素-茜素红双色荧光, ×100)
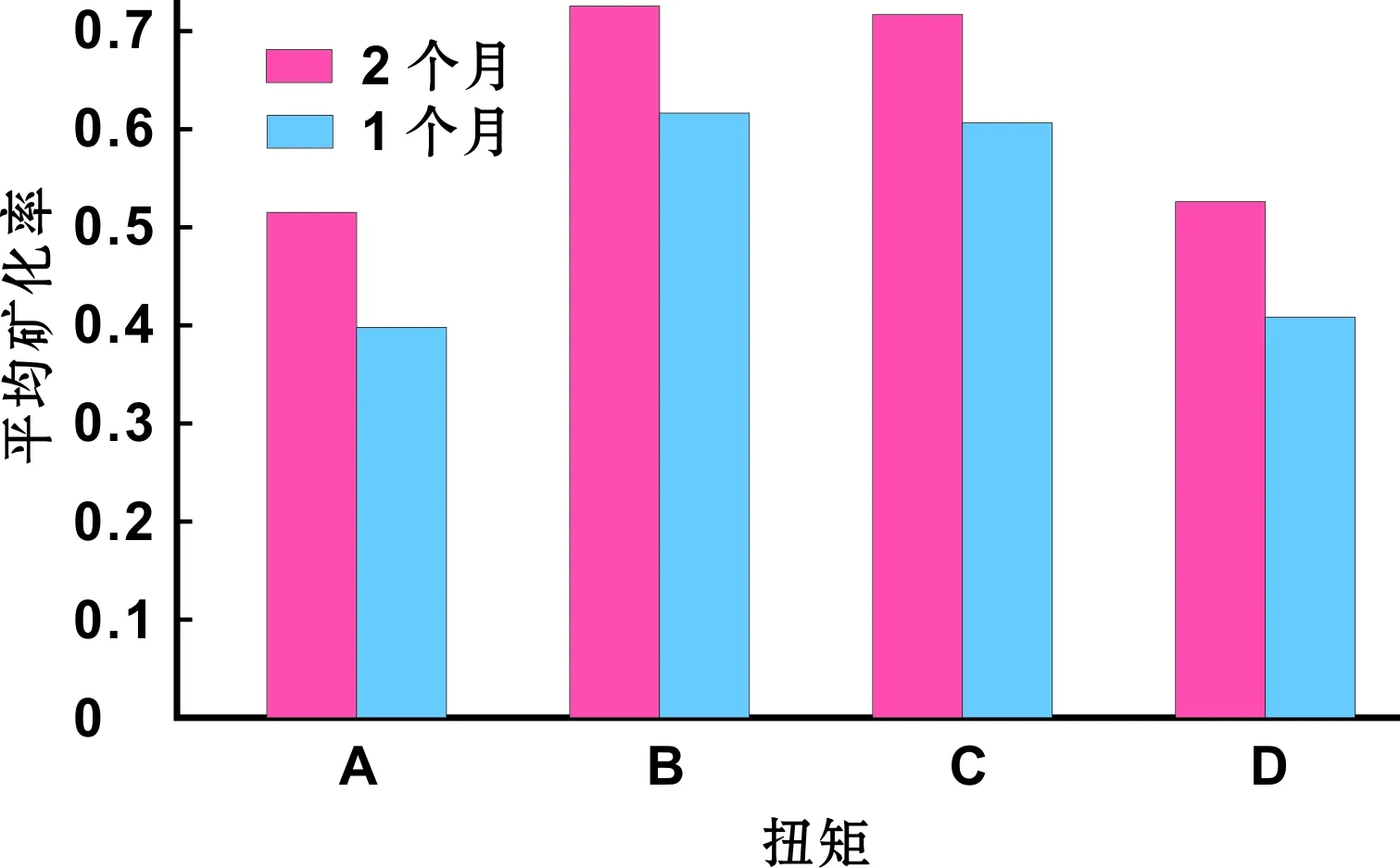
图 8 不同植入扭矩种植体-骨结合的平均矿化速率
2.5 骨计量学参数
Ⅰ组的BIC及OI明显高于Ⅱ组,B、C组明显高于A、D组,差异均有显著性(P<0.01)(图 9)。
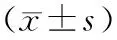
表 1 不同实验因素对骨结合指数的影响
注:t时间<0.01,Ⅰ、Ⅱ组有显著性差异;P扭矩<0.01,A、B、C、D有显著性差异;P犬>0.05、t左右>0.05、t牙位>0.05,尚不能认为实验犬及实验位点的不同会对实验结果造成影响
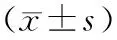
表 2 Ⅱ组1月时不同植入扭矩对骨结合的影响
3 讨 论
目前研究表明影响种植体-骨结合的因素很多,植入扭矩对骨结合的影响越来越受到关注[6]。种植体植入时,扭矩过大,骨过度受压,血管阻塞,不利于成骨;扭矩过小,界面会形成微动,纤维结缔组织趁机长入,亦不利于成骨。适当的植入扭矩可以促进种植体-骨结合,提高种植手术的成功率[7]。
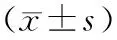
表 3 Ⅱ组2 月时不同植入扭矩对骨结合的影响

图 9 不同植入扭矩种植体-骨结合的BIC和OI
本实验选择1 龄以上健康雄性犬为研究对象,最大程度避免了激素水平的变化对骨结合的影响。下颌前磨牙区牙槽骨质量类似Ⅱ型,是理想的受植区,实验成功率高。统计学分析结果表明实验犬及位点的差异未对实验结果造成影响。文献中多采用拔牙窝愈合后再进行实验的方法[8-9],即刻种植的方法亦有采用[10]。BLBⅢ为螺纹柱状种植体,具有机械锁结固位作用,可以增加种植体的初期稳定性,因此本实验采用即刻种植的方法[10]。实验中牙槽窝直径小于种植体直径,均未植入骨替代物。此外,选用长度8.0 mm的种植体,超出牙槽窝底2~3 mm,也一定程度保证了初期稳定性。种植时机的不同是否会对实验结果产生影响,有待于进一步研究。BLBⅢ种植体为两段式,为了最大程度避免外界的干扰,实验采取潜入式种植方式。
组织学观察是骨组织研究最重要的手段[11]。种植体周围骨组织重建组织学变化的信息可以通过直接观察界面生长情况获得。亚甲基蓝-酸性品红染色方法可以清晰区分新生骨、骨基质等成骨情况。实验发现:B、C组界面深红色新生骨较A、D组明显增多,部分区域出现黄绿色骨基质,未见蓝色纤维组织。
荧光检查方法简便,已广泛应用于骨生长代谢、新骨形成定位和速率测定等研究中。实验中,无论是四环素还是茜素红荧光均清晰显示了新骨形成的部位,而且荧光的多少跟成骨量的多少完全一致,证明荧光标记的多少可以提示成骨活跃的程度[12]。近种植体处的金黄色荧光条带比远离种植体区的红色条带较宽,说明近种植体位置骨改建较活跃,新骨形成量较多,属于接触成骨,可见BLBⅢ种植体具有良好的生物相容性和骨引导作用。A、D组双色荧光标记的平均矿化速率明显低于B、C组,差异非常有统计学意义(P<0.01)。这说明25 N·cm、35 N·cm的扭矩值相较于<15 N·cm、>45 N·cm的扭矩值更利于BLBⅢ种植体-骨结合。
种植体-骨结合率反映的是种植体表面与骨结合的程度,是种植体维持长期稳定性的物质基础。有学者指出种植体表面与骨组织只达到部分骨结合,一般在30%~70%之间,以50%~60%居多[13-14]。从生物力学角度看,结合率大于50%的骨界面更为安全[15]。实验中,B、C组在骨结合1 个月即可达57%左右,2 个月达到大约72%。而A、D组1 个月均不足50%,2 个月才位于50%~60%。不难发现,种植手术时给予25 N·cm、35 N·cm的扭矩相较于<15 N·cm、>45N·cm的扭矩可以获得更理想地骨结合。得出这一结果,可以更好地指导临床工作。
