牙髓干细胞来源的外泌体对于巨噬细胞极化作用影响的实验研究
2018-12-12王巧云姑丽米日依马木林成
王巧云 姑丽米日·依马木 林成
牙髓干细胞(dental pulp stem cells,DPSCs)是一类具有间充质特性的干细胞,有着良好的增殖和分化能力,其被证实能够参与多种的组织修复,同时利用其制作的细胞聚合体结构也能够在大动物的神经修复中产生良好的治疗效果[1]。然而,DPSCs促进组织修复再生的机制尚不是十分的清楚。外泌体(EXO)是一类直径约为20~100 nm的由细胞分泌的球状囊泡,其中还有多种的物质,能够有效的进行细胞之间的物质交换和信息传导[2-3]。巨噬细胞在炎症环境及组织再生调控中扮演着重要的角色,目前的研究表明,其两种亚型分别起到促炎(M1)和抗炎(M2)的作用,能否实现促进巨噬细胞的极化由促炎的M1型向抗炎的M2型转化,对于实现调控组织再生显得尤为重要[4-6]。本实验旨在研究大鼠rDPSCs分泌的EXO在体内外对于巨噬细胞极化的影响,为进一步实现组织的再生调控提供支撑。
1 材料与方法
1.1 主要试剂与仪器
α-MEM培养液、谷氨酰胺、青链霉素(Gibco,美国);I型胶原酶、PKH-67荧光染料、β-甘油磷酸钠、地塞米松、胰岛素、维生素C、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、茜素红、油红O、吲哚美辛、Hoechst 33342(Sigma,美国);胎牛血清(FBS)(四季青);左旋谷酰胺、2-巯基乙醇(Invitrogen,美国);RAW264.7巨噬细胞株(ATCC,美国);外泌体分离提取试剂盒(System Bioscience,美国);蛋白提取定量试剂盒、Western Blot发光液、AlexaFlour 488、AlexaFlour 594荧光二抗、超速离心机、CO2恒温孵箱(Thermo,美国);Trizol试剂、Prime Script RT reagent Kit、SYBR Premix Ex TaqTM(TakaRa,日本);抗大鼠CD63、CD81及抗小鼠CD68、CD206抗体(Abcam,美国);皮肤修复透明敷料(3M,美国);超净工作台(苏州净化);倒置相差显微镜系统(Nikon,日本);激光共聚焦显微镜及照相系统(Olympus,日本);透射电镜(Hitachi-4800,日本);流式细胞仪(Beckman Coulter,美国);凝胶电泳成像拍照系统(上海Tanon有限公司)。
1.2 大鼠皮肤缺损模型的建立
取12 周龄SPF级雌性SD大鼠12 只,体质量180~220 g,购于新疆医科大学动物实验中心,用于皮肤缺损模型建立及观察治疗,动物实验程序符合新疆医科大学的动物使用管理条例及相关伦理标准。将SD大鼠随机分为2 组(n=6): PBS溶液对照组、EXO悬液治疗组。具体的操作步骤为:将大鼠称重后,采用腹腔麻醉,取俯卧位固定于手术操作台上,背部中央常规备皮消毒后,切取直径为2 cm的全层皮肤,然后分别在其表面涂布PBS溶液、EXO悬液后,利用3M皮肤敷料固定创面。最后采用荷包缝合术将模型区域固定,14 d后取材检测。
1.3 rDPSCs的分离与培养
利用脱颈法处死大鼠后,将其置于75%无水乙醇当中,5 min后取出置于超净工作台当中,然后取出其下颌骨。用无菌的含有双抗(青-链霉素)PBS溶液对组织进行清洗,然后在浸润的PBS中剥离颌骨表面的肌肉和结缔组织,并沿着下颌骨下缘去除骨组织,待暴露下颌牙之后,建立牙髓通道,然后小心将牙髓从根管中取出。用无菌齿镊将牙髓组织分离成小块(1 mm3)后,放入含有I型胶原酶的离心管中,37 ℃孵箱中消化40 min。收集细胞悬液,利用70 μm的滤器滤过后,加入到六孔板中(含有10%FBS的α-MEM培养液),在37 ℃、5%CO2恒温孵箱中培养,每3天换液1 次,待2 周后单克隆达到融合后常规传代使用。
1.4 rDPSCs的细胞表型鉴定
取处于生长对数期的P3代rDPSCs,经过细胞消化离心收集后,用PBS制备密度为1×106/ml的单细胞悬液,分装为不同离心管后,用抗大鼠CD14-PE、CD34-PE、CD45-PE、CD90-PE、CD105-PE、CD146-PE室温下避光孵育30 min, 然后用PBS溶液洗涤3 次后,重悬于200 μl的PBS溶液中。最后利用流式细胞仪检测细胞表面标志分子的阳性比率。
1.5 rDPSCs的成骨成脂、能力检测
将rDPSCs以1.5×105细胞/孔,接种于12 孔板当中,分别进行成骨和成脂诱导。成骨诱导液采用含有以下物质的α-MEM培养液:100 ml/L胎牛血清、 200 μmol/ml吲哚美辛、 0.5 mmol/ml IBMX、 10 μg/ml胰岛素、 1 μmol/L 地塞米松。成脂诱导液采用含有以下物质的α-MEM培养液:100 ml/L胎牛血清、5 mmol/L β-甘油磷酸钠、 100 nmol/L地塞米松、50 μg/ml维生素C。成骨诱导14 d后,用4%多聚甲醛溶液固定,10 g/L茜素红染色约10 min。利用PBS溶液清洗3 次后,观察钙化结节的形成情况,并进行拍照。成脂诱导14 d后,用4%多聚甲醛溶液固定,以油红O异丙醇溶液染色约30 min,PBS溶液清洗3 次后,显微镜下观察脂滴的形成情况,并进行拍照。
1.6 EXO的提取及鉴定
将第3 代的rDPSCs以5×105个/75 cm2的密度接种于培养瓶中,将用于rDPSCs培养的胎牛血清在100 000 g/min的条件下预先离心,去除其中的EXO,并配制不含有外泌体的条件培养液。加入10 ml条件培养液,常规培养3 d后收集培养液,将培养液以1 000 g/min的速度离心10 min,去除细胞残渣和杂质,吸取上清液,按每1 ml培养液加入200 μl的EXO提取试剂进行充分混匀,4 ℃孵育过夜后,以3 000 g/min离心30 min,沉淀即为EXO。加入200 μl PBS溶液重悬沉淀,然后-20 ℃保存备用。利用透射电镜观察并拍照,Western blot检测其表面抗原标志物表达。
取20 μl PBS重悬的EXO溶液,然后取悬浮液滴入富有支持膜的铜网上,待液体挥发后即可利用透射电子显微镜进行观察。将溶于PBS的EXO上样,经SDS-PAGE蛋白分离,然后将其转移到PVDF膜上,2 h之后,用60 g/L的脱脂奶粉室温下封闭1 h,然后分别用CD63(1∶200)、 CD81(1∶200)的抗体4 ℃孵育过夜,TBST液洗膜3 次,每次5 min,然后分别加入山羊抗小鼠(CD63)及山羊抗兔(CD81)IgG(1∶2 000)二抗,室温下孵育1 h,再次TBST液洗膜3 次,每次5 min。Tanon凝胶成像系统进行图像扫描和分析。
1.7 细胞免疫荧光染色
将细胞样本进行固定后,用PBS溶液清洗3 次,然后用5%BSA室温下封闭1 h,之后用抗CD68(1∶400)、CD206(1∶200)的一抗室温下孵育2 h,然后用PBS溶液清洗3 次,分别用抗羊(CD68)和抗兔(CD206)的AlexaFlour 488、AlexaFlour 594荧光二抗(1∶200)室温下孵育30 min,然后PBS溶液清洗3 次。最后用Hoechst 33342染料复染细胞核5 min,清洗后80%甘油溶液封闭观察后拍照。
按照说明书的方法用PKH-67荧光染料对EXO进行标记染色,然后以200 μg的总量加入到预先铺好细胞的孔板中,4 h之后用4%多聚甲醛溶液进行固定10 min,然后PBS溶液清洗3次。之后按照之前的方法,利用抗CD68一抗及对应的荧光二抗对细胞进行染色。PBS溶液清洗3 次后,利用Hoechst 33342染料复染细胞核5 min, 最后利用PBS溶液清洗3 次,80%甘油封闭观察后拍照。
1.8 实时荧光定量核酸扩增检测
取正常及成骨成脂诱导7 d之后的细胞、正常对照及加入rDPSCs来源的EXO 3 d后的巨噬细胞和正常对照及皮肤缺损治疗后14 d的皮肤组织,PBS溶液清洗之后利用Trizol法提取总RNA,反转录,实时荧光定量检测核酸扩增。基因对应的引物序列见表 1。

表 1 RT-qPCR引物序列
1.9 统计学分析
用SPSS 16.0软件进行统计分析。所有原始数据进行分析前均经正态分布和方差齐性的检验,分别用t检验和方差分析检验2 组或多组之间的差异是否具有显著性,同时在多组之间进行比较,利用Bonferroni法记性P值的矫正,P<0.05时,具有统计学意义。
2 结 果
2.1 rDPSCs的鉴定及多向分化潜能验证
经过流式细胞术检测,rDPSCs阳性表达CD90、CD105、CD146,阴性表达CD14、CD34、CD45,其结果说明rDPSCs均具有间充质特有表型,同时不表达造血系表型(图 1A)。分别通过成骨、成脂诱导7 d后,qPCR检测ALP和Runx2等成骨相关基因,PPARγ和LPL等成脂相关基因,可以看到诱导组相对对照组而言,表达量明显增加(P<0.05)(图 1B)。诱导14 d后,可以看出均可以染出茜素红和油红O阳性,证明rDPSCs具有多向分化潜能(图 1C)。
2.2 rDPSCs分泌的EXO的鉴定
经过EXO提取试剂盒收集到的白色沉淀,溶于PBS溶液后进行透射电镜的观察,可观察到其为50~100 nm的囊泡结构(图 2A)。同时,经过Western blot检测其CD63和CD81的蛋白表达水平,结果也显示样本相对于细胞强阳性表达2 种蛋白(图 2B)。
2.3 EXO对于巨噬细胞极化的作用
加入外源性的EXO之后,通过免疫荧光共染可以看出,相对于对照组加入的PBS溶液,EXO可以显著的促进巨噬细胞表达CD206分子,提高其向M2型极化的比例(图 3A)。同时在加入EXO 3 d后,相对于对照组,M1极化的相关分子(TNF-α、iNOS)的基因表达均下降(P<0.05),而相反的是,M2极化的相关分子(IL-4、IL-10、Arg-1)的基因表达均显著上升(P<0.01)(图 3B)。此部分结果证明,在体外环境中,rDPSCs来源的EXO能够有效的促进巨噬细胞表达向M2型极化的相关分子,并且提高其向M2型极化的细胞比例。

A:流式细胞术检测细胞表面标志物;B:形态及成骨成脂染色;C:rDPSCs的ALP、Runx2、PPAR-γ、LPL的mRNA表达
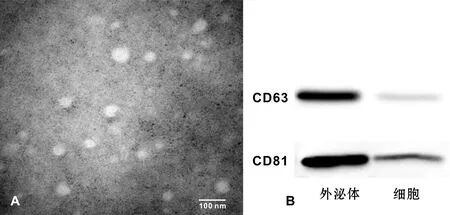
A:透射电镜观察;B:Western blot显示CD63和CD81
2.4 EXO对于皮肤创伤愈合中巨噬细胞极化的影响
皮肤缺损治疗14 d后进行皮肤取材。通过qPCR检测巨噬细胞极化的相关分子的基因表达水平可以观察到,与M1型极化的相关炎症因子TNF-α、TNF-1β、IL-6的表达水平均下降(P<0.05),其中IL-6最为显著(P<0.01)(图 4A)。与此同时,与M2型极化的相关分子表达均有显著的升高(P<0.01)(图 4B)。此部分证明,在皮肤缺损后的愈合再生过程中,EXO通过提高M2型相关分子IL-4、IL-10、IL-13的表达水平,同时抑制M1型相关炎症因子的表达水平,有效的提高M2型巨噬细胞的极化比例,从而更好地调控炎症微环境,促进局部组织的修复再生。
3 讨 论
组织再生一直都是医学中重点关注的科学问题,如何通过有效的调控促进组织再生是研究者们的长期诉求。间充质干细胞的应用已经被证明能够在多种的疾病和再生中产生疗效,然而其机制仍然不是十分明确。早期的研究表明,外源性移植的间充质干细胞能够在宿主体内直接分化成多种类型的体细胞,同时其具有良好的免疫调节功能,但是其真正发挥作用的细胞数量却小于1%[7-9]。后续的研究发现,间充质干细胞治疗的过程中,旁分泌发挥了关键的作用,近期的研究热点证实其主要为EXO[10-11]。然而间充质干细胞分泌的外泌体能够调节免疫微环境的机制尚不清楚。EXO内部含有丰富的蛋白质和RNA等物质,促进细胞和组织间的信息交流,其可以发挥多种的生物学功能[12]。本实验通过提取并鉴定rDPSCs分泌的EXO,发现其能够有效地促进巨噬细胞的极化,并提高其向利于组织再生的M2型的比例,丰富EXO的应用前景。本实验尚未揭示EXO具体是通过何种信号分子产生的促进巨噬细胞极化的作用的。因此,未来下一步研究中将聚焦rDPSCs来源的EXO促进巨噬细胞极化的具体分子机制上,为解释其单独的生物活性功能提供有力支撑。
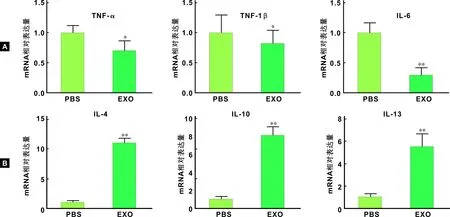
图 4 皮肤创伤愈合过程中EXO对于巨噬细胞极化的影响(*: vs PBS组,P<0.05;**: vs PBS组,P<0.01)
