高效液相色谱法同时测定水体中氧氟沙星及其手性异构体
2018-11-06仲小飞秦晓鹏张云慧
仲小飞, 秦晓鹏, 杜 平, 陈 娟, 张云慧, 何 赢, 刘 菲
(1.环境基准与风险评估国家重点实验室,土壤与固体废物研究所,中国环境科学研究院,北京100012;2.水资源与环境工程北京市重点实验室,中国地质大学(北京),北京100083)
抗生素是一大类用于治疗细菌感染的药物,广泛应用于临床医疗和畜禽养殖中。据统计,全球每年抗生素的使用量在10~20万吨[1],而根据Zhang等[2]的调查显示我国每年抗生素的使用量达到了9.57万吨。氧氟沙星(ofloxacin,OFL)作为第二代氟喹诺酮类抗生素因具有广谱抗菌性、最低抑菌浓度、低毒等优势被广泛应用[3]。氧氟沙星的手性异构体 S-(-)-氧氟沙星(levofloxacin,LEV,左氧氟沙星)为第三代氟喹诺酮类抗生素,被证明是R-(+)氧氟沙星抗菌性的8~128倍[4],且消除半衰期比氧氟沙星短[5]。工业上难以将两者分离,因此在临床应用的氧氟沙星中常含有大量的左氧氟沙星。抗生素在被使用后,大部分都会以原形排出体外,因此氧氟沙星或其手性异构体在环境中被频繁检出[6-9]。环境中大量的抗生素不仅对人体产生不良影响[10],还会影响生物群落,破坏生态平衡[11]。
目前比较常用的测定抗生素的方法是超高效液相色谱-串联质谱法(UPLC-MS/MS)[12-15],一般可以同时检测几十种抗生素,但是该方法无法区分氧氟沙星和左氧氟沙星[16]。氧氟沙星进入地下水中后的活性成分主要是左氧氟沙星[17]。因此,为了准确定量氧氟沙星及其手性异构体和评价其在地下水中的环境风险,需建立一种能同时将两种抗生素分离检测的方法。氧氟沙星及其手性异构体的检测方法主要有毛细管电泳法(CE)[18,19]、流体注射化学发光法(CL)[20]、手性配体交换色谱法[21-24]和高效液相色谱-手性色谱柱法[25,26]等。毛细管电泳法测试时间短,但制备能力差;流体注射化学发光法虽然精确迅速,但操作步骤复杂,成本高;HPLC-手性色谱柱法因手性柱的制作复杂、费用高且只能拆分一对或几对异构体而有所限制;手性配体交换色谱法利用C18柱手动添加手性流动相被认为是对氧氟沙星及其手性异构体分离最有效和最常用的方法[21,27],常见的配体主要包括 L-(-)-对甲基二苯甲酰酒石酸(L-DTTA)和L-(-)-二苯甲酰酒石酸(LDBTA)或者Cu2+和N-n-十二烷基-L-脯氨酸手性配体等[28,29]。手性流动相是含有一定浓度的氨基酸和CuSO4的混合溶液。配位交换高效液相色谱的原理是手性流动相中的Cu2+与氨基酸络合形成的二元配体再与氧氟沙星及其手性异构体络合形成具有手性差异的三元配体,在分离柱中具有不同的保留时间,从而将两种抗生素分离[30]。
尽管已有研究针对氧氟沙星及其手性异构体的分离,但是鲜少有研究环境中阴阳离子对测试影响的报道[21,22,31]。地下水等水体中的阳离子或溶解性有机物会与氧氟沙星发生络合作用[32,33],可能会对抗生素的测试产生影响。因此本文除了对氨基酸的种类、甲醇浓度、柱温、流动相pH值等参数进行优化外,还研究了地下水中常见阳离子以及腐殖酸(HA)对氧氟沙星及其手性异构体分离测试的影响。
1 实验部分
1.1 仪器、试剂与材料
LC-20AT高效液相色谱仪(日本Shimadzu公司);Milli-Q超纯水制备器(美国Millipore公司)。
氧氟沙星及其手性异构体和左氧氟沙星(纯度>98.0%)购自美国Sigma公司;氧氟沙星购自美国药典协会;异亮氨酸(L-isoleucine)、亮氨酸(leucine)、赖氨酸(valine)、缬氨酸(lysine)与无水硫酸铜(分析纯)均购自北京国药公司;甲醇(色谱纯)购自美国Baker公司;腐殖酸(主要为黄腐酸,纯度>90%)购自上海阿拉丁试剂有限公司。地表水样品采自中国环境科学研究院(北京),用SW表示;地下水样品分别采自贵州省贵阳市镇宁县和关岭县,用GW1和GW2表示。所有水样测试前均经0.22 μm水相滤膜过滤。
1.2 分析条件
分析柱为 C18柱(25 cm×0.46 cm,5 μm,美国Agilent公司);流动相为20%(v/v)甲醇水溶液(含4 mmol/L异亮氨酸(配体)和3 mmol/L CuSO4,pH 4.5);流速为1.0 mL/min;检测器为SPD-M20A二极管阵列检测器;检测波长为293 nm;进样体积为 20 μL。
2 结果与讨论
2.1 氧氟沙星及其手性异构体分离方法的优化
2.1.1 氨基酸种类的影响
选用4种氨基酸(异亮氨酸、亮氨酸、缬氨酸和赖氨酸)作为配位交换色谱中的配体,研究不同种类的氨基酸对氧氟沙星及其手性异构体分离效果的影响。其中,4种氨基酸和CuSO4的浓度分别为5 mmol/L和4 mmol/L,流动相中甲醇的体积分数为12%,柱温为40℃,流速为1.0 mL/min。由表1可知,缬氨酸、亮氨酸和异亮氨酸作为流动相配体时出峰时间略有差异,而赖氨酸作为配体时,在60 min内未见氧氟沙星及其手性异构体的色谱峰。
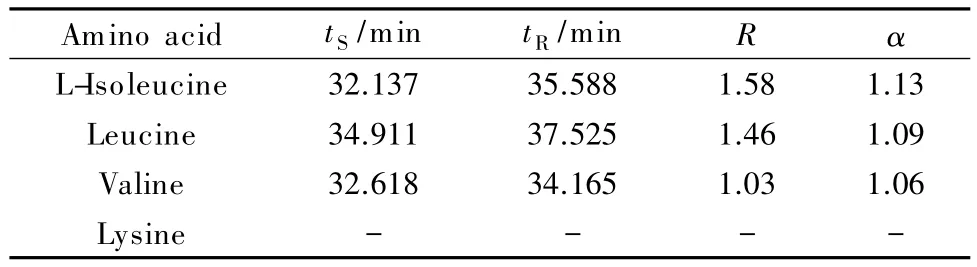
表1 采用不同氨基酸作为配体时氧氟沙星和左氧氟沙星的保留时间(tS、tR)、分离度(R)和手性拆分因子(α)Table 1 Retention times(tS,tR),resolutions(R)and chiral separation factor(α)of ofloxacin and levofloxacin usingdifferentamino acidsas ligands
可以看出,当缬氨酸作为配体时,氧氟沙星和左氧氟沙星的出峰时间相对较早,这是由于这对手性异构体的出峰时间受氧氟沙星/左氧氟沙星-铜-氨基酸(OFL/LEV-Cu-A)络合物分子结构和相对分子质量的影响。缬氨酸的相对分子质量最小,因此出峰时间相对最早。氧氟沙星和左氧氟沙星的分离度取决于OFL/LEV-Cu-A络合物分子结构及其在色谱柱中迁移速率的差异。异亮氨酸为配体时分离度最高,为1.58,而亮氨酸和缬氨酸为配体时分离度依次减小。氨基酸具有手性分离的条件是需要一个空间结构的侧链以及特定的亲脂性[27],与氧氟沙星及其手性异构体的亲和性不同,从而引起分离度有差异,而赖氨酸只有一个直链,并不具备手性选择性,因此本实验选择异亮氨酸作为配位交换色谱的配体。Bi等[22]研究发现,当异亮氨酸和CuSO4的浓度分别为4 mmol/L和3 mmol/L时,两种抗生素的分离度为1.63,因此后续实验的流动相中异亮氨酸和CuSO4的浓度分别采用4 mmol/L和3 mmol/L。
2.1.2 流动相中甲醇体积分数的影响
实验研究了流动相中甲醇的体积分数(14%~20%)对氧氟沙星及其手性异构体分离的影响(见图1)。结果表明,氧氟沙星和左氧氟沙星的tS、tR、α和R均随着甲醇体积分数的升高呈下降趋势。原因可能是甲醇的体积分数较高会使流动相中的电解质(氨基酸)生成沉淀[22,30],引起氨基酸、铜离子和抗生素三元配体发生变化,同时甲醇体积分数越高,洗脱能力越强,出峰时间变快,氧氟沙星及其手性异构体的α和R有所降低。虽然甲醇体积分数较低时,氧氟沙星及其手性异构体的R和α均较大,但是保留时间较长,而且影响氧氟沙星及其手性异构体的峰形,导致拖尾严重,且实验结果显示,在高比例的甲醇条件下,氧氟沙星及其手性异构体的响应值更高,更利于准确定量。同时有较多研究[21,22,31]结果显示,甲醇体积分数超过20%时,氧氟沙星及其手性异构体的R相对偏低。因此本实验选择甲醇体积分数为20%进行后续实验。
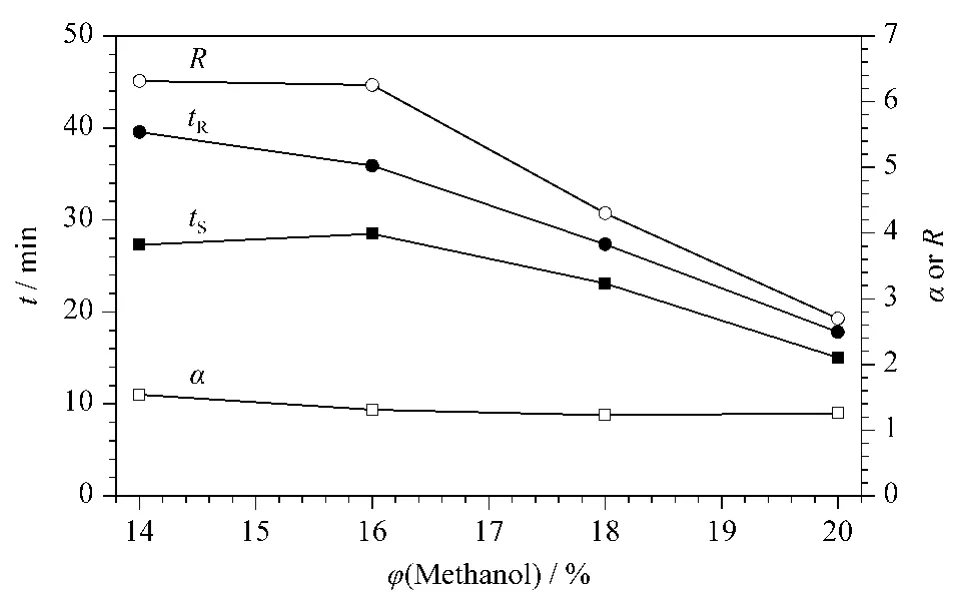
图1 甲醇体积分数对氧氟沙星及其手性异构体分离的影响Fig.1 Effect of volume percentage of methanol on the separation of ofloxacin enantiomers
2.1.3 流动相pH值的影响
流动相的pH值是影响分离度的一个重要因素,研究[21,30]表明分离度随着流动相 pH 值的增加而增加,但是Yan等[30]指出流动相pH值大于5.0时易形成Cu2+沉淀。因此本文考察了不同pH值(3.2~4.5)对手性分离的影响(见图2)。结果表明,氧氟沙星及其手性异构体的α和R随着流动相pH值的增加而增加。原因可能是随着流动相pH值的增加,溶液中氢离子浓度逐渐降低,氨基酸与氧氟沙星及其手性异构体之间的氢键作用降低,而与Cu2+离子形成的络合物趋于稳定[22]。流动相pH值为4.5时分离度达到2.7,且氧氟沙星及其手性异构体的峰面积较高,保留时间可以接受。因此本实验将流动相的pH值设为4.5。
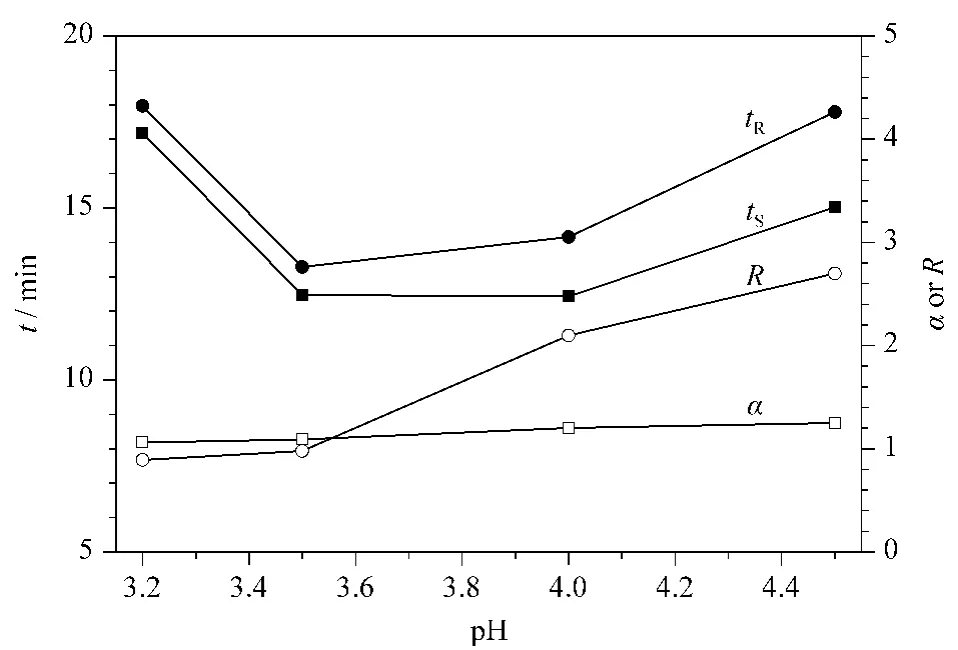
图2 流动相pH值对氧氟沙星及其手性异构体分离的影响Fig.2 Effect of pH value of mobile phase on the separation of ofloxacin enantiomers
2.1.4 柱温的影响
实验比较了不同柱温(25、30、35、40℃)对氧氟沙星及其手性异构体分离的影响(见图3)。结果表明,氧氟沙星及其手性异构体的tS、tR和R随着温度的增加而降低,α无明显变化。
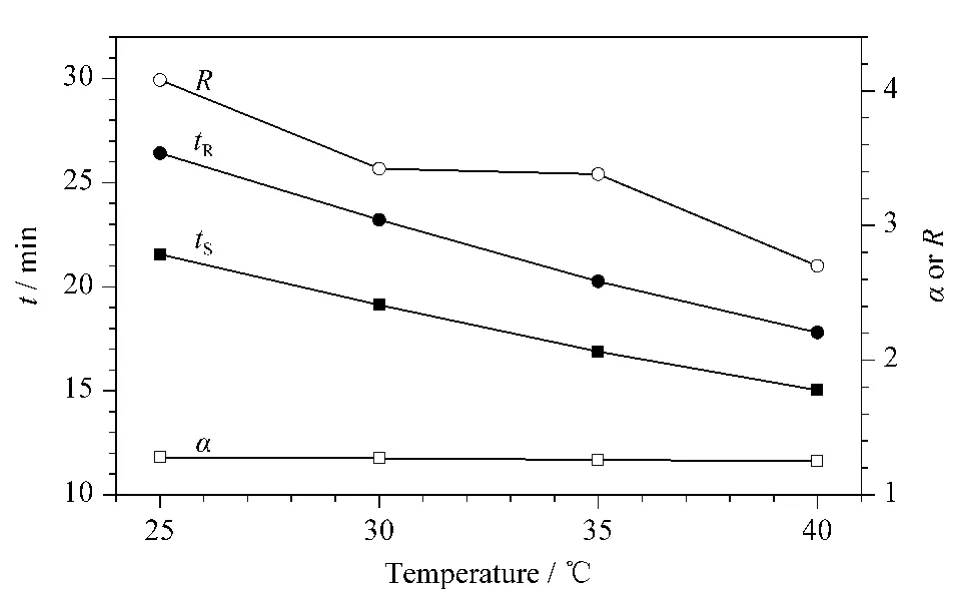
图3 柱温对氧氟沙星手性分离的影响Fig.3 Effect of column temperature on the separation of ofloxacin enantiomers
随着柱温的升高,LEV/OFL-Cu-A三元配体在C18柱上稳定性降低,导致停留时间减少,因此保留时间随柱温的升高而降低[22,30],而分离度也随之减小,但均能达到基线分离,氧氟沙星及其手性异构体的α无明显变化。通过实验可知,柱温对氧氟沙星及其手性异构体的峰形和峰面积影响不大,不会影响最终的测试结果,但是柱温一般不建议超过40℃,会影响待测物的稳定性。因此本实验选择柱温40℃作为后续的实验条件。
2.2 地下水中的其他因素对分离的影响
2.2.1 金属阳离子的影响
为研究地下水中金属阳离子对氧氟沙星及其手性异构体分离的影响,实验分别对添加了4种地下水中常见金属阳离子(Ca2+、Mg2+、Fe3+、Zn2+)的氧氟沙星与其手性异构体溶液进行分析,并与空白氧氟沙星与其手性异构体溶液进行比较。Ca2+、Mg2+、Fe3+和Zn2+的添加水平参考《地下水质量标准》(GB/T 14848-2017)标准,分别为 500、450、0.3 和 1 mg/L,氧氟沙星及其手性异构体的初始质量浓度分别为27.18 mg/L和22.78 mg/L。结果表明,添加了 Ca2+、Mg2+、Fe3+、Zn2+后,氧氟沙星及其手性异构体的分离度分别为2.67、2.66、2.69和2.66,与未添加时的2.70相比无明显变化,可以确定常见阳离子对氧氟沙星及其手性异构体的分离没有明显影响,但是氧氟沙星及其手性异构体的峰面积均有不同程度的降低(见图4),其中添加Fe3+时降幅最大。原因可能是4种金属离子都与氧氟沙星及其手性异构体络合[32],与Cu2+竞争络合,导致氧氟沙星及其手性异构体的紫外吸光度降低。由于4种阳离子与氧氟沙星及手性异构体的络合常数不同,如表2所示,Fe3+的络合常数明显高于Cu2+,并且会与表面羟基发生络合[33],因此对测试结果影响最大;其余3种离子影响较小,并且Zn2+的浓度较低,所以影响最不明显。同一金属离子对氧氟沙星和左氧氟沙星两种抗生素的影响也与其之间的络合常数呈正相关。
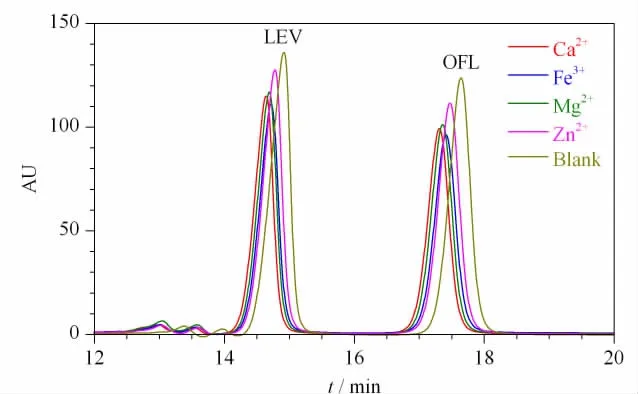
图4 不同金属阳离子对氧氟沙星及其手性异构体分离的影响Fig.4 Effect of different metal cations on the separation of ofloxacin enantiomersLEV:levofloxacin;OFL:ofloxacin.

表2 金属阳离子与氧氟沙星及其手性异构体的络合物常数Table 2 Constants of ofloxacin enantiomers complex with metal cations
2.2.2 腐殖酸的影响
腐殖酸是地下水中常见的溶解性有机物,实验考察了腐殖酸含量对氧氟沙星及其手性异构体分离的影响(见表3)。可以看出,腐殖酸含量对氧氟沙星及其手性异构体的手性分离影响不明显,但是含量越高氧氟沙星及其手性异构体的峰面积和检测浓度越低。原因可能是腐殖酸与氧氟沙星及其手性异构体发生络合[34,35],导致吸附在腐殖酸上的部分氧氟沙星或左氧氟沙星不能被色谱柱识别,从而未被检测出来;或者是腐殖酸与Cu2+络合[36],占据了氧氟沙星及其手性异构体的络合位点,导致未络合的抗生素不能被检测出来。
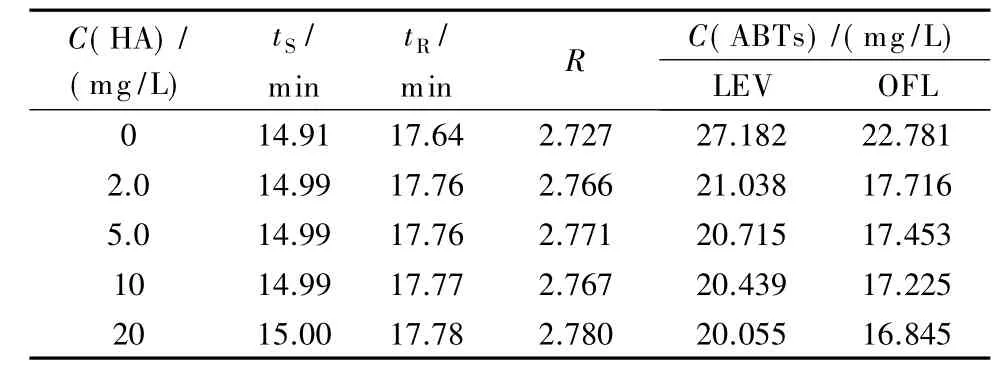
表3 腐殖酸含量对氧氟沙星及其手性异构体分离的影响Table 3 Effect of content of humic acid(HA)on the separation of ofloxacin enantiomers
2.3 方法学考察
2.3.1 标准曲线
对0.5~50 mg/L氧氟沙星和左氧氟沙星进行分析,以目标物的峰面积为纵坐标(y)、对应的质量浓度为横坐标(x,mg/L)绘制标准曲线。结果显示,氧氟沙星和左氧氟沙星在0.5~50 mg/L范围内具有良好的线性相关,线性相关方程分别为y=106 819x和 y=96 533 x,相关系数(r2)分别为0.999 4和0.999 3。在不连续的3天中对添加了3~5倍仪器检出限水平的空白加标样品进行分析(n=7),然后再用n=7的置信度乘以7个数据的标准偏差,最终得出氧氟沙星和左氧氟沙星的方法检出限分别为0.047 mg/L和0.040 mg/L。
2.3.2 准确度与精密度
在一天和不连续的3天中对含50 mg/L的氧氟沙星和左氧氟沙星混合标准溶液进行测定(n=3)。结果显示,氧氟沙星和左氧氟沙星的日内标准偏差为0.9%和1.6%,日间标准偏差为0.7%和1.1%。
对实际水样进行分析,结果显示,均未检测出氧氟沙星及其手性异构体。对SW、GW1、GW23个水样进行5 mg/L和40 mg/L的加标回收试验,结果如表4所示,氧氟沙星和左氧氟沙星在5 mg/L和40 mg/L加标水平下的回收率分别为95.6%~99.1%、95.4%~97.4%和102.2%~119.8%、91.8%~101.1%,所有样品的加标回收率均在合理范围内。
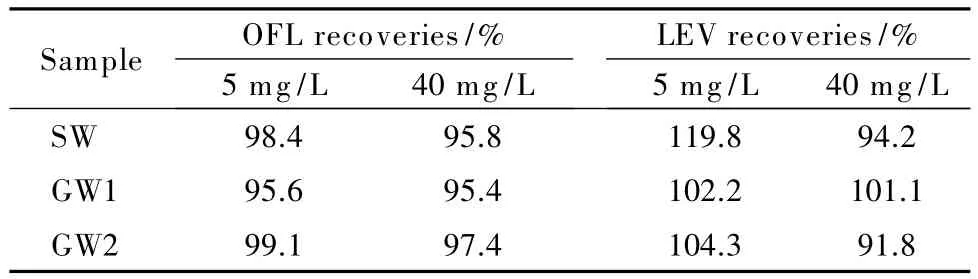
表4 不同加标水平下氧氟沙星和左氧氟沙星的回收率Table 4 Recoveries of OFL and LEV at the different spiked levels
3 结论
建立了配位高效液相色谱分离测定氧氟沙星及其手性异构体的方法,研究了地下水中常见阳离子与腐殖酸对氧氟沙星及其手性异构体分离测定的影响。后期实验也将建立氧氟沙星及其手性异构体的定量方法,深化研究如何降低方法的检出限,同时研究腐殖酸的影响机理,为研究腐殖酸影响地下水中抗生素的迁移原理打下基础。
