低温锌基脱硫剂研究进展
2018-05-24鲍柳旭任秀蓉常丽萍
鲍柳旭,李 挺,任秀蓉,常丽萍
(太原理工大学煤科学与技术省部共建国家重点实验室培育基地,山西 太原 030024)
锌基脱硫剂是以ZnO为主要活性组分,通过添加碱土金属或过渡金属氧化物等助剂来改善性能的精细脱硫剂,其特点是脱硫精度高且使用简便,在气体净化中占据着非常重要的地位。该脱硫剂主要用于脱除天然气、油田气、炼厂气、合成气(H2+CO)、二氧化碳等原料中的硫化氢及某些有机硫[1],以提高产品质量、防止设备腐蚀。
氧化锌脱硫剂在30~200℃低温和200~600℃中温温区内均具有较好的应用[2]。低温氧化锌脱硫剂的研究始于上世纪90年代,其在低温下硫容较低(大于或等于10%),远低于中高温脱硫剂的硫容(30%以上),但能获得更高的脱硫精度(出口φ(H2S)可达0.2×10-5以下)[3]。目前合成氨、制氢、合成甲醇、煤化工、燃料电池、石油炼制等行业中的工艺过程均需要在低温条件下精脱硫,而且环境中的大量含硫污染物也需要在低温脱除[4],因此开发适用于低温的高效精脱硫剂具有重要意义。锌基脱硫剂若能克服低温脱硫硫容低、再生困难等问题,则应用前景广阔。
1 氧化锌脱硫机理
氧化锌脱除硫化氢的反应方程式如下:
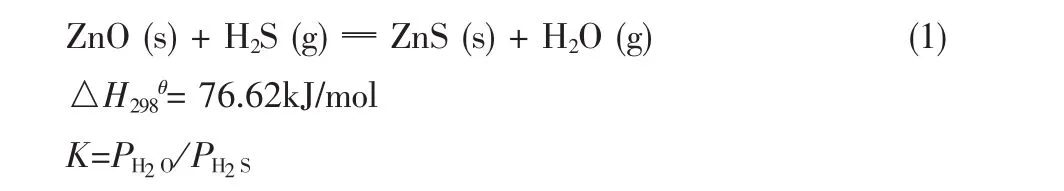
式中:K-气相平衡常数;PH2O,PH2S-H2O,H2S 的分压。
由于ZnO和ZnS均为固体,所以反应平衡常数仅与H2S和H2O(g)的分压 (PH2S、PH2O)有关。从热力学角度分析,氧化锌脱除H2S的反应平衡常数很大,为不可逆反应。且该反应为放热反应,升温不利于反应向产物方向移动,平衡常数减小,脱硫精度下降;反之,降温可以提高脱硫精度。
从动力学角度分析,氧化锌的脱硫过程是物理吸附和化学反应相结合的气-固非催化反应过程。反应过程中,H2S首先从气相主体扩散并吸附到脱硫剂表面;随后晶体表面的H2S发生去质子过程,表面电子浓度改变,生成S2-[5];S2-向ZnO晶体内层移动,与Zn2+反应生成 ZnS;同时O2-向外层,ZnO的六方晶系变成了较大体积的ZnS等轴晶系,使孔隙率显著降低。只有内层ZnO晶格上的O2-不断向外层移动,与外层的S2-进行交换才能使反应持续进行[6]。
2 锌基脱硫剂
Westmoreland等[7]从金属氧化物的热力学和动力学两方面性质考虑,通过计算其与H2S反应的自由能变化,得到金属氧化物与H2S反应的可能性大小顺序依次为:ZnO>CaO>CoO>MnO>Fe2O3>FeO>Fe3O4,可以看出氧化锌的脱硫优势最大。针对脱硫剂在低温下硫容较低的问题,通常采用以下两种途径进行改善:一是从孔结构入手,通过优化制备工艺增加孔容和比表面积,但同时也导致了脱硫剂机械强度的降低,而纳米氧化锌在结构上可以增大比表面积、改变脱硫剂表面特性进而提高硫容;二是添加助剂促进主活性组分的反应性能,有文献报道[8-10],添加一定量的碱土金属或过渡金属氧化物可改善低温锌基脱硫剂的硫容。
2.1 单组分纳米氧化锌脱硫剂
纳米氧化锌是近年来出现的一种粒径在1~100nm之间的具有优良性能的新型无机材料。由于细微的粒径及急剧增加的比表面积,使得纳米氧化锌产生了表面效应、量子尺寸效应以及宏观量子隧道效应[11]。粒径(比表面积)及颗粒形态的改变显著提高了其脱硫活性。
氧化锌脱硫剂的制备方法主要为两种:物理法和化学法。物理法是通过特殊的粉碎方法,将氧化锌固体粉碎[12]。但已有的物理法只能制备粒度为0.1μm的氧化锌颗粒,无法满足其在低温脱硫领域的要求。化学法是制备纳米氧化锌的主要方法,通过一定条件使原子或分子成核、生长或凝聚成粒度为1~100nm的氧化锌颗粒。常见的化学法有:沉淀法[13]、溶胶-凝胶法[14]、浸渍法[15]、喷雾热解法[16]、水热合成法[17]等。
Wang等[18]以介孔分子筛SBA-15为载体,通过湿法浸渍、超声处理等方式使纳米氧化锌颗粒均匀分布在介孔分子筛SBA-15的表面和孔道中,且保持了介孔分子筛有序、比表面积大、大量微孔和介孔存在等特点。研究表明:在25℃下,氧化锌负载质量分数为3.04%的脱硫剂硫容最高,为436mg S/g脱硫剂。硫化过程主要在一层薄的ZnO含氧晶格中进行,硫化后生成的产物ZnS分布在脱硫剂表面和介孔孔道中。氧化锌负载量过低会降低活性位数量,导致脱硫效率下降;但负载量过高会造成颗粒团聚,阻塞介孔,抑制H2S扩散,使得脱硫剂活性降低,脱硫能力下降。Sun等[19]研究比较了不同ZnO负载量的3种介孔分子筛脱硫剂的脱硫能力,分别以MCM-48、SBA-16、KIT-6 为载体,通过超声浸渍制备ZnO负载量为10%、20%、30%和40%的脱硫剂,25℃下的脱硫评价表明KIT-6/30%ZnO的脱硫能力最强,MCM-48/30%ZnO的次之,以SBA-16为载体的脱硫剂脱硫能力最差。作者认为:尽管SBA-16有最大的比表面积,但其众多微孔分布导致了孔堵塞;而KIT-6有最大的孔体积和孔径,介孔负载了更多ZnO且分散性良好,避免了孔堵塞,有效降低了传质阻力,显示了良好的脱硫效果。Liu等[20]通过溶胶-凝胶法制备了具有三维孔结构的ZnO/SiO2脱硫剂,20℃下硫化反应主要在微孔和介孔中进行,与负载ZnO的SBA-15主要在介孔中发生硫化反应不同。ZnO负载量和热处理温度对脱硫剂的物化性质有显著影响,而脱硫剂的物化性质(孔结构、比表面积和活性相颗粒尺寸)与脱硫效果有直接的关系[21]。作者通过实验得出,在400℃下进行热处理显著提高了脱硫剂的比表面积和孔体积,且负载质量分数为30%时ZnO颗粒尺寸较小,脱硫效果最好。
Lonk 等[22]以 Zn5(OH)8(CH3CO2)2·nH2O 为前驱体,通过冷冻成盐、热处理等方式原位制备了石墨烯/氧化锌脱硫剂。作者在30℃下进行脱硫评价实验,结果显示ZnO负载量质量分数为45%的脱硫剂活性最高,穿透硫容达114mg S/g脱硫剂,是纯纳米ZnO穿透硫容的2倍。作者认为纯纳米ZnO脱硫剂在硫化过程中活性组分体积膨胀,脱硫剂部分区域变紧凑甚至发生闭孔,阻碍了H2S到达内部活性位,脱硫剂利用率、脱硫能力下降。SEM、TEM表征表明ZnO与石墨烯结合过程中,ZnO的形状由六边形变为球形,大表面积的石墨烯使ZnO颗粒尺寸大幅下降(粒径为20nm)且能大量均匀负载,不受闭孔效应影响。石墨烯优良的表面特性与纳米ZnO的催化活性相结合有效提高了脱硫剂的总体脱硫性能。
已有研究[23]表明ZnO在低温下的硫化是不完全的,ZnO硫化成ZnS过程中分子体积增大,形成了连续致密的ZnS层,阻碍了H2S进一步扩散并与ZnO反应。为解决上述问题,Balichard等[24]选择了分子体积更大的ZnCO3,其在转化为ZnS过程中,分子体积减小,形成了不连续、致密性差的ZnS层。该ZnS层不同于前者的微孔结构,不会阻碍后续硫化反应进行,从而使ZnCO3能与H2S完全反应,并通过未反应收缩核模型得以验证[25]。ZnCO3纳米晶体的制备是以ZnSO4、NH4HCO3为主要原料,硅胶为载体,通过机械化学法合成。作者比较了ZnCO3纳米晶体与ZnO纳米粒子在低温下的脱硫能力,首先考察了ZnCO3纳米晶体作为脱硫剂在不同温度下的热力学稳定性,结果表明在180℃以下,ZnCO3的质量损失趋于稳定,并确定了ZnCO3完全转化的最低温度为140℃。随后比较了ZnCO3纳米晶体与ZnO纳米粒子在160℃下的脱硫性能,前者的穿透硫容为0.164g S/g脱硫剂,明显高于后者的硫容0.051g S/g脱硫剂。ZnCO3纳米晶体脱硫剂的缺点是不能再生,因而其应用范围有限。
2.2 多组分锌基脱硫剂
多组分锌基脱硫剂是在单组分锌基脱硫剂中加入助剂,以达到提高其脱硫性能的目的。助剂在脱硫剂中的含量一般相对较低,但会明显改善脱硫剂的性能。助剂一般分为两类,一为结构助剂,主要作用是提高脱硫剂的结构稳定性和机械强度。如在脱硫剂中加入二氧化钛可以提高脱硫剂的结构稳定性,加入氧化锆可以提高脱硫剂的机械强度。二为电子助剂,主要是在脱硫剂中加入少量不同金属或者非金属氧化物,通过改善脱硫剂的孔结构、活性组分形态及分散状态等来提高脱硫剂的脱硫性能[26]。
哈尔滨工业大学李琳琳等[11]通过直接沉淀法以一定浓度的Zn(NO3)2溶液在氨水、Na2CO3溶液作用下制得主要成分为 Zn(OH)2和 ZnCO3·2Zn(OH)2的前驱体混合物,经后续处理最终制得纳米ZnO脱硫剂。其活性组分平均粒径为8nm,颗粒均匀且分散性良好。脱硫剂煅烧温度为200℃,比已报道的纳米ZnO制备工艺的煅烧温度 (至少260℃以上)低很多,可有效减少能耗,降低经济成本。助盐Na2CO3的作用是防止沉淀颗粒增大,降低煅烧温度,保持晶粒形态。在25℃下进行活性评价发现其脱硫时间为200min,是分析纯ZnO的20倍;当脱硫温度升高至120℃,脱硫剂的活性最好,穿透硫容为29%,脱硫时间长达1010min,是利用其他方法制备的纳米ZnO脱硫剂活性的5~10倍。
Balsamo等[27]研究了活性炭AC负载不同比例ZnO、CuO的脱硫剂CuxZn1-x/AC,通过考察AC和两种不同比例脱硫剂的结构特性发现:活性炭载体存在微孔和介孔,CuxZn1-x/AC的比表面积相比AC下降,主要是由于负载金属氧化物所致,其孔径大小与Cu/Zn比例无关。活性组分高度分散,且浸渍和热处理过程中没有发生明显的闭孔或扩孔(塌陷)。CuxZn1-x/AC的总孔隙度下降主要是由于AC载体的微孔体积减小所致。脱硫剂活性评价中,Cu0Zn1.0/AC和Cu0.5Zn0.5/AC的穿透时间分别是AC的5倍和7.5倍,这可能是由于CuO比ZnO硫化速度快[28]。通过ICP考察不同比例脱硫剂的活性组分利用率,结果表明Cu0Zn1.0/AC的活性组分利用率为51%,随着CuO含量的升高,Cu0.5Zn0.5/AC的活性组分利用率达到76%,作者认为活性组分与AC载体存在协同效应,存在多组分脱硫的现象。CuO的加入主要是降低了H2S在固体中的扩散阻力,减小晶体ZnO的粒径,增加比表面积,进而提高了活性组分利用率。为了确定硫化产物组成和评价脱硫剂的热力学再生性质,在30~620℃进行TPD评价,结果显示在脱硫剂、活性炭中都没有检测到H2S,说明物理吸附可忽略不计。对于活性炭,其在170℃、280℃出现SO2峰,这是由于活性炭化学吸附的氧与硫化产物发生氧化反应[29]。 对于 Cu0Zn1.0/AC,其在 290℃、500℃出现SO2峰,而未负载的ZnSO4在700℃以上分解释放SO2,说明其与AC的强相互作用降低了ZnSO4的稳定性。随着CuO含量增加,Zn逐渐被Cu替代,在400℃下硫化产物与AC的强相互作用使得SO2的释放量增加,硫化后脱硫剂中CuSO4增多,其容易在400℃分解,因而脱硫剂在氧化条件下可通过热处理再生。Dhage等[30]通过浸渍法制备Cu-ZnO/SiO2脱硫剂,加入Cu使ZnO的利用率由64%提高为92%,脱硫剂在十次硫化再生循环中穿透硫容呈现振动变化的过程[31],而非平稳下降,十次循环失活后的脱硫剂存在大量不同化学组成的Cu2+。
Jiang等[32]通过分步沉淀制备不同比例的Cu-Zn-Al复合金属氧化物脱硫剂,Al的加入提高了CuO、ZnO的分散性[33],与Cu-Zn脱硫剂相比其比表面积增加一倍,活性组分颗粒尺寸显著降低,提高了脱硫剂的H2S吸附活性。随着Cu/Zn比增加,脱硫剂穿透硫容增大,结果显示40℃下80Cu-10Zn-10Al的穿透硫容最高,为23.4g S/100g脱硫剂。穿透硫容由总反应速率决定,而总反应速率由孔扩散和晶格扩散控制,其中晶格扩散是速率控制决定步骤,晶格扩散速率直接决定了穿透硫容大小,CuO在硫化中所需的离子晶格重排程度更低,且活性组分高度分散使其硫化产物层更薄,界面离子交换区域更大,因而大大提高了脱硫剂的穿透硫容。Zahid等[34]通过共沉淀制备了具有层状双金属氢氧化物结构的Cu-Zn-Fe-Al脱硫剂,Fe3+的引入使脱硫剂的比表面积增加10%,结构由水滑石转变为绿铜锌矿,脱硫剂的穿透硫容显著提高,达38.8g S/100g脱硫剂。
Polychronopoulou 等[35]以 Zn(CH3COO)2、Ti(i-Opr)4为前驱体,通过溶胶-凝胶法制备了M-Zn-Ti-O(M=Mn、Cu、Mo)脱硫剂。一般认为,TiO2的作用是增加ZnO的稳定性,形成尖晶石结构的混合金属氧化物Zn2TiO4[36],Cu和Mo会影响颗粒结晶形态和粒径。Mn、Cu、Mo加入到Zn-Ti-O中增加了易还原氢组分,提高了脱硫剂再生脱硫能力。10Mn-45Zn-45Ti-O再生后脱硫能力下降是由于部分SO42-、S2-存在于晶格中,特别是Mn的影响尤为严重。另外作者还研究了Fe-Mn-Zn-Ti-O脱硫剂的脱硫性能,其中5Fe-15Mn-40Zn-40Ti-O的脱硫性能最好,在25℃下加入体积分数1%H2O可显著提高脱硫剂的脱硫能力,再生效率达到了82%[37]。Dhage等[38]通过浸渍法制备了Fex-Mny-Zn1-x-yO/SiO2(x,y=0.025)脱硫剂,通过 XPS、ESR确定了 Fe3+存在于脱硫剂表面,Mn3+存在于ZnO纳米晶粒中。脱硫剂经过十次硫化再生循环后,脱硫性能良好,穿透硫容保持在初次硫化的90%左右,金属活性组分的负载形态基本保持不变。
近年来稀土元素(如铈)做脱硫剂的助剂受到了人们的普遍关注,李芬等[39,40]通过均匀沉淀法制备了铈掺杂纳米ZnO的Ce-ZnO脱硫剂,研究表明270℃焙烧的Ce-ZnO脱硫剂其室温脱硫性能要优于纳米ZnO脱硫剂,其粒径小于纳米ZnO,同时脱硫剂表面电子密度和碱性增加,有利于H2S的脱除。
3 结语
低温锌基脱硫剂中ZnO活性组分脱硫精度高,有较好的吸附活性,其中纳米氧化锌与适当的载体(如介孔分子筛、石墨烯、硅胶、活性炭等)结合而成的单组分氧化锌脱硫剂可以有效利用氧化锌的活性和载体的结构优势,显著提升脱硫剂的脱硫能力;氧化锌与碱土金属、过渡金属助剂结合而成的多组分脱硫剂可提高脱硫剂的机械强度和硫容,稀土金属做助剂也可改善脱硫剂的脱硫能力。目前脱硫剂的再生能力有待提升,借助合适的载体和助剂,进一步优化操作条件,开发高反应活性,能持久再生,特别是再生后直接生成硫单质的脱硫剂对于未来的低温锌基脱硫剂发展有重要意义。
参考文献
[1] 冯续.氧化锌脱硫剂研究动向[J].化学工业与工程技术,2008,29(2):31-35.
[2] 上官炬,常丽萍,苗茂谦.气体净化分离技术[M].北京:化学工业出版社,2012:94.
[3] 冯续,赵素云,李博,等.影响氧化锌脱硫的因素[J].化学工业与工程技术,2010,31(4):31-34.
[4] 江德恩,赵璧英,谢有畅.H2S、SO2的吸附(干法)脱除研究进展 [J].化学通报,2000,63(2):25-31.
[5] 李维华,张文慧,汤效平,等.氧化锌的脱硫性能及其在工业中的应用[J].齐鲁石油化工,2004,32(2):100-102.
[6] 李芬,张杰,闫波,等.低温脱硫剂的研究进展 [J].化工进展,2007,26(4):519-525.
[7] Westmoreland PR,Harrison D P.Evaluation of candidate solids for high-temperature desulfurization of low-btu gases[J].Environ Sci Technol,1976,10:659-661.
[8] 陈子江,弋飞.低温氧化锌脱硫剂的研究进展 [J].沈阳化工,1999,28(6):16-18.
[9] Xue M,Chitrakar R,Sakane K,Ooi K.Screening of adsorbents for removal of H2S at room temperature[J].Green Chem,2003,5:529.
[10]Yang Hongyun,Tatarchuk B.Novel doped zinc oxide sorbents for low temperature regenerable desulfurization applications[J].AIChEJ,2010,11:2898-2904.
[11]李琳琳.常温纳米ZnO脱硫剂制备方法及脱硫性能的研究 [D].哈尔滨:哈尔滨工业大学市政环境工程学院,2006.
[12]祖庸,刘超峰,李小娥.超细氧化锌的合成技术进展[J].化工新型材料,1997,25(8):11-15.
[13]Skrzypski J,Bezverkhyy I,Heintz O.Low temperature H2S removal with metal doped nanostructure ZnO sorbents:study of the origin of enhanced reactivity in Cu-containing materials[J].Ind Eng Chem Res,2011,50:5714-5722.
[14]Znaidi L.Sol-gel deposited ZnO thin films:a review[J].Mater Sci Eng B,2010,174:18-30.
[15]Zhang F M,Liu B S,Zhang Y,et al.Highly stable and regenerable Mn-based/SBA-15 sorbents for desulfurization of hot coal gas[J].JHazard Mater,2012,233:219-227.
[16]Li Dan,Qin Longgui,Liu Fengmin.Preparation and gassensing performances of ZnO/CuO rough nanotubular arrays for low-working temperature H2Sdetection[J].Sens Actuators B,2017,110:20-27.
[17] Bandarchian F,Anbia M.Conventional hydrothermal synthesis of nanoporous molecular sieve 13X for selective adsorption of trace amount of hydrogen sulfide from mixture with propane[J].J Nat Gas Sci Eng,2015,26:1380-1387.
[18]Wang X H,Sun T H,Yang J.Low temperature H2S removal from gas streams with SBA-15 supported ZnO nanoparticles[J].Chem Eng J,2008,142:48-55.
[19]Li L,Sun T H,Shu C H,Zhang H B.Low temperature H2S removal with 3-D structural mesoporous molecular sieves supported ZnO from gas stream[J].JHazard Mater,2016,311:142-150.
[20]Liu G Q,Huang Z H,Kang F Y.Preparation of ZnO/SiO2gel composites and their performance of H2S removal at room temperature[J].JHazard Mater,2012,215:166-172.
[21]Goswamee E R L,Bosc F,Cot D,et al.Sol-gel derived nanocomposites and nanoporous oxide powders and related coatings for the reversible chemisorption of hydrogen sulfide[J].JSol-Gel Sci Technol,2004,29:97-105.
[22]Lonkar SP,Pillai V,Abdala A.In situ formed grapheme/ZnO nanostructured composites for low temperature hydrogen sulfide removal from natural gas[J].RSC Adv,2016,6:81142-81150.
[23]Samokhvalov,Tatarchuk B J.Characterization of active sites,determination of mechanisms of H2S,COS and CS2sorption and regeneration of ZnO low-temperature sorbents:past,current and perspectives[J].Phys Chem Chem Phys,2011,13:3197-3209.
[24]Balichard K,Nyikeine C,Bezverkhyy I.Nanocrystalline ZnCO3-a novel sorbent for low-temperature removal of H2S[J].JHazard Mater,2014,264:79-83.
[25]Szekely J,Evans J W,Sohn H Y.Gas-solid reactions[M].New York:Academic Press,1976.
[26]杨泽.钴添加剂对以褐煤半焦为载体锌基中温煤气吸附剂硫化性能的影响[D].太原:太原理工大学化学与化工学院,2016.
[27]Balsamo M,Cimino S,Falco G.ZnO-CuO supported on activated carbon for H2Sremoval at room temperature[J].Chem Eng J,2016,304:399-407.
[28]Jiang D,Su L,Ma L.Cu-Zn-Al mixed metal oxides derived from hydroxycarbonate precursors for H2S removal at low temperature[J].Appl Surf Sci,2010,256:3216-3223.
[29]Guo J,Luo Y,Lua A C,et al.Adsorption of hydrogen sulphide(H2S)by activated carbons derived from oil-palm shell[J].Carbon,2007,45:330-336.
[30]Dhage P,Samokhvalov A,Repala D.Copper-promoted ZnO/SiO2regenerable sorbents for the room temperature removal of H2S from reformate gas streams [J].Ind Eng Chem Res,2010,49:8388-8396.
[31]Stephanopoulos F,Sakbodin M,Wang Z M.Regenerative adsorption and removal of H2S from hot fuel gas streams by rare earth oxides[J].Science,2006,312:1508-1510.
[32]Jiang D H,Su L H,Li X N.Cu-Zn-Al mixed metal oxides derived from hydroxycarbonate precursors for H2Sremoval at low temperature[J].Appl Surf Sci,2010,256:3216-3223.
[33]Klier K.Methanol synthesis[J].Adv Catal,1982,31:243-313.
[34]Zahid W M,Othman M A,Abasaeed A E.Enhanced sulfur removal by a tuned composite structure of Cu,Zn,Fe and Al elements[J].J Hazard Mater,2017,331:273-279.
[35]Polychronopoulou K,Fierrob J L G,Efstathiou A M.Novel Zn-Ti-based mixed metal oxides for lowtemperature adsorption of H2Sfrom industrial gas streams[J].Appl Catal B,2005,57:125-137.
[36]Lew,Sarofilm A F,Stephanopoulos M F.Modeling of the sulfidation of zinc-titanium oxide sorbents with hydrogen sulfide[J].AIChE J,1992,8:1161-1169.
[37]Polychronopoulou K,Galisteo F C,Efstathiou A M.Novel Fe-Mn-Zn-Ti-O mixed-metal oxides for the lowtemperature removal of H2S from gas streams in the presence of H2,CO2,and H2O[J].JCatal,2005,236:205-220.
[38]Dhage P,Samokhvalov A,Repala D.Regenerable Fe-Mn-ZnO/SiO2sorbents for room temperature removal of H2S from fuel reformates:performance,active sites,Operando studies[J].Phys Chem Chem Phys,2011,13:2179-2187.
[39]李芬,闫波,邵纯红,等.铈掺杂纳米ZnO结构与室温脱硫性能的相关性研究[J].无机化学学报,2006,22(10):1895-1898.
[40]Li F,Yan B,Zhang J,Jiang A X,et al.Study on desulfurization efficiency and products of Ce-doped nanosized ZnO desulfurizer at ambient temperature[J].J Rare Earths,2007,25:306-310.
