α1整合素活化在β淀粉样蛋白诱导神经细胞死亡中的作用
2017-09-27王华民齐平建董虹廷及时雨李钦涛
王华民 齐平建 于 东 董虹廷 史 进 及时雨 刘 睿 李钦涛
(郑州大学附属南阳医院 南阳市中心医院神经外科,河南 南阳 473000)
α1整合素活化在β淀粉样蛋白诱导神经细胞死亡中的作用
王华民 齐平建 于 东 董虹廷 史 进 及时雨 刘 睿 李钦涛
(郑州大学附属南阳医院 南阳市中心医院神经外科,河南 南阳 473000)
目的探讨神经母细胞瘤细胞(SH-SY5Y)中β淀粉样蛋白(Aβ)诱导丝裂原活化蛋白激酶(MAPK)信号通路活化的上游影响因素。方法选择SH-SY5Y为靶细胞,首先用MAPK信号通路上游抑制剂处理细胞,待细胞培养1 h之后,加入Aβ42纤维聚集体,细胞培养24 h后进行检测。首先采用甲氮甲唑蓝(MTT)法测定了细胞的存活率,然后利用Western印迹检测磷酸化细胞外信号调节蛋白激酶(p-ERK)和ERK的蛋白表达水平,从而检测MAPK信号通路的激活水平。结果用锯鳞血抑肽或α1整合素蛋白封闭性抗体可以有效抑制Aβ引起的细胞死亡,并且阻止Aβ成纤维诱导MAPK的激活水平的提高(P<0.05)。用α1和β1整合素蛋白封闭抗体同时作用细胞时,得到了相似的结果。但是如果只用β1整合素蛋白封闭抗体单独作用细胞时,不能阻止Aβ成纤维诱导细胞死亡和MAPK的激活水平的提高。结论α1整合素,α1和β1整合素复合体是Aβ诱导SH-SY5Y细胞中MAPK信号通路激活从而介导细胞死亡的重要因素。推测α1整合素蛋白和α1、β1复合体可以作为治疗性干扰Aβ信号通路的靶点。
整合素;黏着斑激酶;神经突变性;细胞死亡
淀粉样蛋白(Aβ)在细胞外的沉积与tau蛋白的过度磷酸化有着密不可分的关系。研究发现,Aβ在作用多种细胞引入神经毒性的同时伴随着丝裂原活化蛋白激酶(MAPK)的激活〔1〕。同时,当成熟的海马神经元与MAPK抑制因子共同孵育,可以抑制tau蛋白的过度磷酸化和神经突触退变〔2〕。本文采用了α1整合素蛋白抑制因子,β1整合素蛋白抑制因子和α1、β1整合素复合物蛋白抑制因子分别作用细胞,从而进一步研究这些整合素蛋白在Aβ诱导MAPK信号通路激活中的作用。
1 材料与方法
1.1主要试剂及仪器 Aβ(1~42)肽、六氟异丙醇(HFIP)购自Sigma公司;整合素α1封闭抗体(α1整合素抑制剂)和整合素β1封闭抗体(β1整合素抑制剂)购自Santa Cruz;鼠抗人细胞外信号调节蛋白激酶(ERK)抗体和兔抗人p-ERK抗体购自Santa Cruz;鼠抗人黏着斑激酶(FAK)抗体和兔抗人p-FAK抗体购自Santa Cruz;抗兔IgG(抗p-ERK抗体和抗p-FAK抗体)和抗鼠IgG(抗ERK抗体和抗FAK抗体)购自Santa Cruz;Tubulin购自Santa Cruz;辣根过氧化物酶标记的增强型化学发光试剂(碧云天);甲氮甲唑蓝(MTT)购自Sigma公司;锯鳞血抑肽(E)购自Sigma公司;SH-SY5Y细胞购于German Collection of Microorganisams and Cell Cultures;青霉素和链霉素购自Sigma公司;胎牛血清和DMEM培养基购于GIBCO。
1.2细胞培养 神经母细胞瘤细胞(SH-SY5Y)培养于添加10%胎牛血清,1%青霉素和链霉素双抗的DMEM培养液中,放入5%CO2,37℃培养箱中培养。待细胞长到80%左右进行细胞传代培养,加入适量的磷酸盐缓冲液(PBS)清洗除去未贴壁的细胞,加入1 ml 0.25%的胰蛋白酶室温消化,细胞变圆后用弯头滴管加入新鲜的培养液吹打瓶壁进行细胞重悬,按1∶3比例进行传代以备后续实验所用。根据所做实验对细胞量的要求计数后分别把细胞传到培养瓶,96孔板、24孔板或6孔板进行培养。
1.3Aβ纤维聚集体的制备及鉴定 将Aβ1~42无菌条件下溶解于1 mg/ml的HIFP,水浴超声10 min,真空干燥,-20℃冻存。使用时现将Aβ42用二甲基亚砜(DMSO)溶解至1 mg/ml,再将Aβ42稀释到终浓度为10 μmol/L的PBS中,终浓度为20 mol/L,在37℃孵育6 d形成纤维聚集状态。然后通过透射电子显微镜观察确认其聚集状态。Aβ42纤维聚集体的制备和聚集体结构的透射电镜形态参考文献〔3〕。由于Aβ42形成聚集体的不可逆性,Aβ42纤维的使用均为先用先制备,若短期使用置于-80℃储存。
1.4MTT法检测细胞的存活率 取对数生长期细胞,以每孔 2×103个细胞(100 μl)的数量接种在96孔板培养24 h,根据实验要求分别将锯鳞血抑肽(整合素的一个抑制子),α1整合素抑制剂,β1整合素抑制剂,α1+β1整合素抑制剂加入不同的培养孔中(设置两组平行实验:实验组1和实验组2),终浓度为2 μmol/L,5%CO2条件下培养1 h。向实验组1和实验组2中分别加入相同体积的Aβ纤维聚集体和含10%胎牛血清的DMEM。其中,实验组1中Aβ纤维聚集体的终浓度为20 μmol/L,5%CO2条件下培养24 h。同时设置不含有整合素抑制剂、Aβ纤维聚集体和只加入20 μmol/L Aβ纤维聚集体的对照实验组。细胞在处理完毕后,每孔加入5 g/L MTT 20 μl,继续培养4 h,吸出培养液,加入DMS 150 μl充分溶解,待甲臜完全溶解后,用酶标仪(Bio-Tek,ELX800)在波长490 nm处读取吸光度(A490)值。
1.5抑制整合素的活性 首先,将锯鳞血抑肽(整合素的一个抑制子)加入达到对数生长期的SH-SY5Y细胞中,调节终浓度2 μmol/L,孵育1 h后时加入Aβ纤维聚集体(20 μmol/L),孵育24 h。另设一实验组,将锯鳞血抑肽换成整合素封闭抗体作用于达到对数生长期的SH-SY5Y细胞,调节终浓度2 μmol/L,孵育1 h时后加入Aβ纤维聚集体(20 μmol/L),孵育24 h。通过MTT实验和免疫印迹实验分别检测细胞的存活率和分析蛋白ERK和p-ERK的表达量。
1.6Western印迹检测目的蛋白 SH-SY5Y细胞经2 μmol/L锯鳞血抑肽,2 μmol/L α1整合素抑制剂,2 μmol/L β1整合素抑制剂,2 μmol/L α1+2 μmol/L β1整合素抑制剂作用1 h和2 μmol/L锯鳞血抑肽,2 μmol/L α1整合素抑制剂,2 μmol/L β1整合素抑制剂,2 μmol/L α1+2 μmol/L β1整合素抑制剂作用1 h,20 μmol/L Aβ纤维聚集体作用24 h后 ,提取细胞蛋白,二喹啉甲酸(BCA)法测定蛋白质浓度。各组取50 μg总蛋白上样,经 12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转至聚偏氟乙烯(PVDF)膜上,80 V转膜 90 min。5%脱脂牛奶-PBST 封闭 2 h;分别加入以下一抗:ERK(1∶800),p-ERK(1∶1 000),FAK(1∶800),p-FAK(1∶1 000)和Tubulin(1∶5 000 稀释),4℃摇床上孵育过夜。次日洗膜,加入二抗(羊抗兔和羊抗鼠,1∶10 000 稀释),室温孵育2~3 h。洗膜后,采用辣根过氧化物酶标记的增强型化学发光法显色,显影于X光片上。采用 LabWorks4.6软件对目的蛋白和Tubulin 条带行灰度值分析。
1.7统计学方法 使用SPSS软件进行单因素方差分析、t检验。
2 结 果
2.1锯鳞血抑肽对Aβ42纤维诱导SH-SY5Y细胞死亡的影响 以20 μmol/L Aβ42纤维处理细胞24 h后,与未经处理的细胞相比,细胞的存活率明显降低。如果用2 μmol/L的锯鳞血抑肽作用细胞1 h,20 μmol/L的Aβ42纤维处理细胞24 h后,细胞的存活率(73.54±0.02)与单独用20 μmol/L Aβ42纤维作用的对照组(29.23±0.01)相比发生明显提高,这说明通过抑制MAPK信号通路可以有效抑制Aβ42纤维所诱导的细胞死亡。
2.2MAPK在SH-SY5Y中的表达水平 与对照组(锯鳞血抑肽和Aβ42纤维聚集体浓度为0)比较,单独用Aβ42纤维聚集体作用细胞24 h后,细胞中p-ERK水平要高于对照组(54.32±0.001)%(P<0.05)。用2 μmol/L锯鳞血抑肽单独作用细胞1 h,用2 μmol/L锯鳞血抑肽和20 μmol/L Aβ42纤维聚集体分别作用细胞1 h和24 h后,细胞中p-ERK水平相近,分别为(49.84±0.01)%和(55.47±0.02)%均低于对照组(P<0.05)。见图1。

图1 锯鳞血抑肽(E)抑制Aβ诱导 SH-SY5Y细胞中MAPK的激活
2.3MTT检测整合素封闭抗体对SH-SY5Y细胞存活率的影响 当以20 μmol/L Aβ42纤维聚集体为细胞胞外基质作用细胞24 h,细胞的存活率为对照组的(0.30±0.01)倍(P<0.05)。所得的实验结果与2 μmol/L β1整合素封闭抗体和20 μmol/L Aβ42纤维聚集体分别作用细胞1 h和24 h得到的实验结果相近。但是,如果单独用2 μmol/L β1整合素封闭抗体作用细胞1 h,细胞的存活率为照组的(0.70±0.02)倍(P<0.05)。明显高于以Aβ42纤维聚集体,β1整合素封闭抗体和Aβ42纤维聚集体为胞外基质时细胞的存活率。用2 μmol/L α1整合素封闭抗体孵育细1 h,2 μmol/L α1整合素封闭抗体孵育细胞1 h和20 μmol/L Aβ42纤维聚集体孵育细胞24 h得到的细胞存活率分别为照组的(0.80±0.02)倍和(0.77±0.03)倍(P<0.05)。与β1整合素封闭抗体单独作用细胞得到的结果相似。当用2 μmol/L α1整合素封闭抗体和β1整合素封闭抗体共同孵育细1 h所得的结果与用2 μmol/L α1+2 μmol/L β1整合素封闭抗体共同孵育细1 h和20 μmol/L Aβ42纤维聚集体孵育细胞24 h得到的细胞存活率相近,分别为照组的(0.99±0.03)倍和(0.97±0.03)倍(P<0.05)。
2.4α1整合素在Aβ42寡聚体所诱导MAPK激活中的作用 独用Aβ42(20 μmol/L)作用细胞24 h后,细胞中p-ERK的蛋白表达量最高,而用2 μmol/L α1+2 μmol/L β1整合素封闭抗体共同孵育细1 h后,细胞中p-ERK的蛋白表达量最低。以p-ERK/ERK的蛋白比值为标准,各组数据分别为100%,(149.23±0.01)%,(48.34±0.02)%,(45.45±0.02)%,(47.21±0.03)%,(45.67±0.01)%,(19.45±0.04)%,(21.54±0.02)%。见图2。
FAK通常与整合素共定位,并通过与特异性的配体结合而活化。活化的FAK中397位的酪氨酸会发生磷酸化。根据免疫印迹的实验结果,发现实验组的FAK磷酸化水平与对照组相比没有明显变化。见图3。
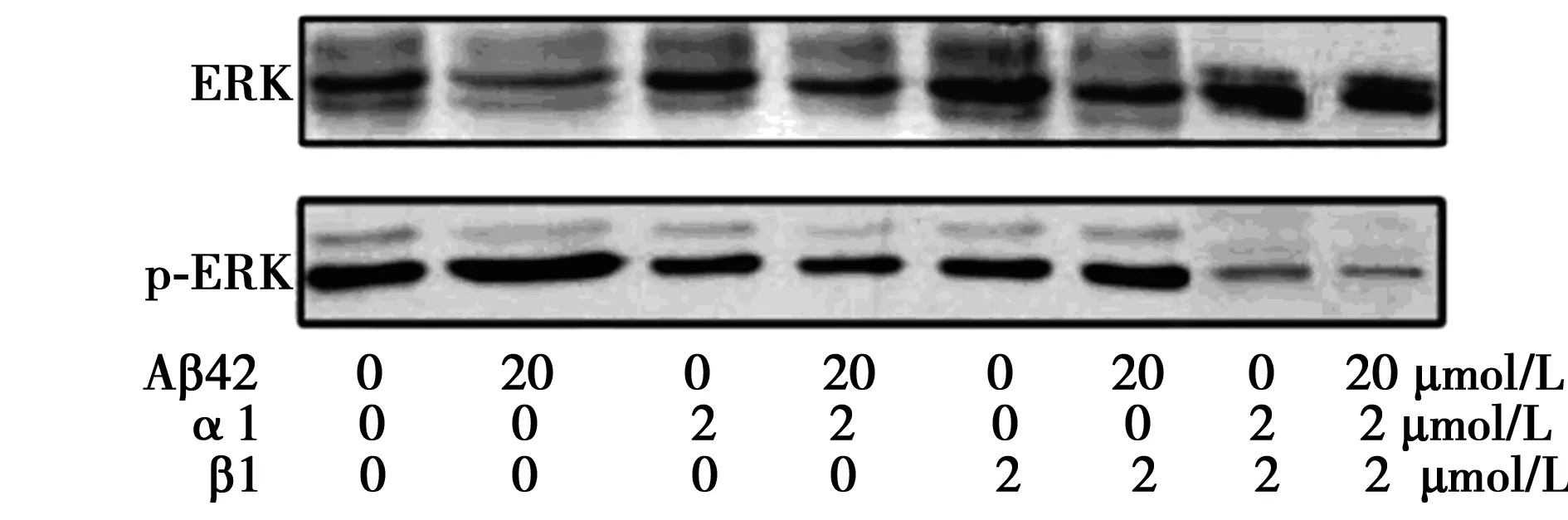
图2 整合素封闭抗体抑制Aβ诱导 SH-SY5Y细胞中MAPK的激活

图3 Aβ42纤维对SH-SY5Y中FAK活化水平的影响
3 讨 论
整合素是细胞表面受体的主要家族。对细胞和细胞外基质的黏附起介导作用。在受损伤的神经细胞中发现淀粉样前体蛋白(APP)和整合素在神经细胞中有共定位。例如,在海马神经元中,APP与α1β1整合素异二聚体存在共定位。整合素异二聚体是由α1,α3,α5,α6和β1整合素所形成的〔4〕。Bi等〔5〕研究表明,抑制海马神经元整合素的表达将会引起Aβ的大量积累,对不同的细胞模型进行研究时发现,整合素在Aβ介导的细胞凋亡过程中也起到重要的作用。在神经胶质细胞中,通过对β1整合素的抑制可以抑制Aβ刺激产生的活性氧〔6〕。在成熟的神经细胞中,Aβ纤维引起MAPK活化的峰值在细胞暴露给Aβ纤维24 h之后,这与生长因子所引起的瞬间激活不同〔7〕。同时在MAPK激活之后的1 h仍然处于活化状态〔8〕。这表明Aβ引起的MAPK活的活化是渐进的并且具有持续性。这种MAPK的激活模式是由于细胞外基质中的蛋白与细胞上的受体结合所介导的。Zhu等〔9〕研究发现纤连蛋白与3T3细胞的整合素结合可以引发MAPK持久性激活。
本研究结果表明MAPK在Aβ42诱导的神经细胞死亡过程中发挥用。实验中所采用的MAPK抑制剂-锯鳞血抑肽是通过抑制整合素的活化从而抑制MAPK信号通路的活化。这表明整合素蛋白在Aβ42介导的MAPK信号通路活化的过程中发挥作用。为了进一步确定发挥作用的整合素蛋白,分别采用α1整合素抑制剂,β1整合素的抑制,α1+β1整合素抑制剂,Aβ42纤维分别作用细胞。结果发现,α1整合素抑制剂和α1+β1整合素抑制剂可以有效降低Aβ42纤维所诱导产生的细胞死亡,但是单独用β1整合素抑制剂作用细胞将不会有效降低细胞的死亡率。通过进一步检测不同实验条件下MAPK通路的活化程度,发现当用α1、β1、α1+β1整合素抑制剂分别作用细胞时,细胞中p-ERK/ERK蛋白比值明显降低,这说明细胞中MAPK信号通路的激活被抑制。如果在加入α1、α1+β1整合素抑制剂后,用Aβ42纤维聚集体作用细胞,细胞中p-ERK/ERK蛋白比值也发生明显降低。其中以α1+β1整合素抑制剂为胞外基质与以α1+β1整合素抑制剂和Aβ42纤维聚集体为胞外基质时,细胞中p-ERK/ERK蛋白比值最低。这说明α1整合素和α1+β1整合素复合体对MAPK信号通路的激活具有十分重要的作用。而如果先后以β1整合素抑制剂和Aβ42纤维聚集体作用细胞,细胞中p-ERK/ERK蛋白比值与对照组相比变化不大。这说明单独的β1整合素对Aβ42纤维诱导MAPK信号通路激活导致细胞死亡的过程中没有发挥显著作用。
对于Aβ激活α1整合素的分子机制至今仍然不清楚。其中一个可能的机制是Aβ直接与整合素相结合。这种结合可能是由Aβ的5~8个氨基酸所介导的。 这个序列包含了一个潜在的整合素结合位点(RHDS)〔10〕。另一种方式可能是Aβ可以间接结合到整合素上。整合素可能是Aβ纤维与细胞表面受体分子作用的一部分〔11〕。最近在神经胶质细胞中得到了这种机制的证据。Aβ纤维黏附到神经胶质细胞是由CD36,CD37和α6整合素异二聚体形成的复合物所介导的〔12〕。但是对于这种Aβ接受子复合物的了解不是很充分,不过最近有研究表明NMDA接受子也和整合素一样在Aβ介导的神经毒性中有着重要的作用。
Zhang等〔13〕发现当培养的神经元暴露在Aβ(1~42)和Aβ(25~35)的条件下,FAK的磷酸化水平上升。但是根据本研究结果,与Aβ共同孵育的SH-SY5Y细胞中磷酸化的FAK水平并没有升高。这可能是由于所采用的细胞系不同,导致实验结果出现不同。但是对于FAK的具体变化我们仍然需要更多的实验证据。
1Rapoport M,Ferreira A.PD98059 prevents neurite degeneration induced by fiorllar beta-amyloid in mature hippocampal neurons〔J〕.J Neurochem,2000;74(1):125-33.
2Rapoport M,Dawson HN,Binder LI,etal.Tau is essential to beta-amyloid-induced neurotoxicity〔J〕.Proc Natl Acad Sci U S A,2002;99(9):6364-9.
3Zhu X,Ye L,Ge H,etal.Hopeahainol A attenuates memory deficits by targeting β-amyloid in APP/PS1 transgenic mice〔J〕.Aging Cell,2013;12(1):85-92.
4Grace EA,Busciglio J.Aberrant activation of focal adhesion proteins mediates fibrillar amyloid β-induced neuronal dystrophy〔J〕.J Neurosci,2002;23(2):493-502.
5Bi X,Gall CM,Zhou J,etal.Uptake and pathogenic effects of amyloid beta peptide 1-42 are enhanced by integrin antagonists and blocked by NMDA receptor antagonists〔J〕.Neuroscience,2002;112(4):827-40.
6Wei ZJ,Tao ML,Zhang W,etal.Up-regulation of microRNA-302a inhibited the proliferation and invasion of colorectal cancer cells by regulation of the MAPK and PI3K/Akt signaling pathways〔J〕.Int J Clin Exp Pathol,2015;8(5):4481-91.
7Wang S,Zhang C,Sheng X,etal.Peripheral expression of MAPK pathways in Alzheimer's and Parkinson's diseases〔J〕.J Clin Neurosci,2014;21(5):810-4.
8Feld M,Krawczyk MC,Sol Fustiana M,etal.Decrease of ERK/MAPK overactivation in prefrontal cortex reverses early memory deficit in a mouse model of Alzheimer's disease〔J〕.J Alzheimers Dis,2014;40(1):69-82.
9Zhu X,Assoian RK.Integrin-dependent activation of MAP kinase:a link to shape-dependent cell proliferation〔J〕.Mol Biol Cell,1995;6(3):273-82.
10Sabo S,Lambert MP,Kessey K,etal.Interaction of beta-amyloid peptides with integrins in a human nerve cell line〔J〕.Neurosci Lett,1995;184(1):25-8.
11廖 锋,李 友,赵 斌.去整合素和金属蛋白酶10与阿尔兹海默病的研究进展〔J〕.中华临床医师杂志(电子版),2013;7(6):2653-6.
12Bamberger ME,Harris ME,McDonald DR,etal.A cell surface receptor complex for fibrillar beta-amyloid mediates microglial activation〔J〕.J Neurosci,2003;23(7):2665-74.
13Zhang B,Bian X,He P,etal.The toxicity mechanisms of action of Aβ25-35 in isolated rat cardiac myocytes〔J〕.Molecules,2014;19(8):12242-57.
〔2017-02-19修回〕
(编辑 袁左鸣)
R74
A
1005-9202(2017)18-4486-03;doi:10.3969/j.issn.1005-9202.2017.18.024
齐平建(1971-),男,主任医师,主要从事神经外科研究。
王华民(1983-),男,硕士,主治医师,主要从事神经外科研究。
