强制性运动疗法对脑卒中大鼠神经功能的影响
2017-09-27王淑玲邓景贵方翠霓刘楚娟
王淑玲 刘 佳 邓景贵 宋 涛 方翠霓 刘楚娟 陶 希
(湖南省人民医院老年医学研究所,湖南 长沙 410016)
强制性运动疗法对脑卒中大鼠神经功能的影响
王淑玲 刘 佳1邓景贵 宋 涛 方翠霓 刘楚娟 陶 希
(湖南省人民医院老年医学研究所,湖南 长沙 410016)
目的制作脑卒中大鼠模型,给予强制性运动疗法(CMIT)干预,观察干预后大鼠相关神经功能的变化。方法选取SD大鼠,随机分为假手术组、模型组和CMIT训练组,观察各组大鼠行为障碍、组织病理学改变、天冬氨酸特异性半胱氨酸蛋白酶(Caspase)-3及程序化死亡基因(PDCD)-5表达情况、超氧化物歧化酶(SOD)及丙二醛(MDA)含量变化及神经元特异性烯醇化酶(NSE)及S-100β表达情况。结果与假手术组相比,模型组及CMIT训练组神经功能评分显著升高(P<0.05);与模型组相比,CMIT训练组的神经功能评分显著降低(P<0.05)。假手术组大鼠脑组织细胞结构完整,细胞核、核膜及核仁结构完整;模型组细胞排列紊乱,水肿严重,核膜界线不清晰,血管充血严重;相比于模型组,CMIT训练组脑组织结构较完整,且坏死较模型组显著降低,间质水肿较大缓解。假手术组基本未见Caspase-3及PDCD-5阳性细胞;模型组随处可见大量Caspase-3及PDCD-5阳性细胞;但相对于模型组,CMIT训练组Caspase-3及PDCD-5阳性细胞含量明显降低。与假手术组相比,模型组及CMIT训练组Caspase-3及PDCD-5 mRNA表达量显著升高(P<0.05);与模型组大鼠相比,CMIT训练组大鼠的Caspase-3及PDCD-5 mRNA表达量显著降低(P<0.05)。相比于假手术组,模型组及CMIT训练组SOD含量表达显著降低MDA含量表达显著升高(P<0.05);相比于模型组,CMIT训练组SOD含量表达显著升高MDA含量表达显著降低(P<0.05);CMIT训练组(P<0.05)。相比于假手术组,模型组及CMIT训练组NSE、S-100β含量表达显著升高;相比于模型组,CMIT训练组NSE、S-100β含量表达显著降低(P<0.05)。结论CMIT疗法可以通过抑制Caspase-3及PDCD-5凋亡因子,升高SOD,减少MDA、NSE及S-100β含量,从而达到改善脑卒中后神经功能障碍。
强制性运动疗法(CMIT);脑卒中;Caspase-3;PDCD-5;SOD;MDA;NSE;S-100β
脑卒中后常因神经功能损伤而造成较高的致残率,给家庭和社会造成严重的负担。临床上多运用药物、手术、康复治疗等干预手段缓解脑卒中病情,改善神经功能恢复〔1〕。强制性运动疗法(CMIT)通过限制健侧上肢、强化训练患肢,达到强制使用和强化训练患肢的目的,多用于脑卒中后恢复期的上肢功能训练〔2〕。然而,有关其对神经功能改善的基础研究暂时缺如。本研究拟观察CMIT干预改善大鼠神经功能的作用。
1 对象与方法
1.1动物及分组 从北京华阜康生物公司购置Wistar大鼠120只,随机分为假手术组、模型组和CMIT训练组,每组40只。模型组和CMIT训练组均构建脑卒中大鼠模型,CMIT训练组给予强制性运动康复。
1.2动物模型构建 参考相关文献〔3〕建立脑卒中模型。7.2%水合氯醛腹腔注射麻醉大鼠,剪开鼠头部皮肤,颈正中切口,分离颈外动脉(ECA)、右侧颈总动脉(CCA)及颈内动脉(ICA)。结扎ECA及CCA近心端。在CCA近分叉处插入备用鱼线,将栓线送至大脑中动脉分叉处,平均进线(18.5±0.5)mm(ECA与ICA分叉处为起点),栓线尾端留于皮肤外,栓塞90 min后抽线实现再灌注。以动物清醒后爬行时右转圈,提尾时右前肢内收屈曲为入选标准。假手术组操作同上,仅暴露各组血管,而不进行线栓插入。
1.3CMIT训练 参照相关文献〔4〕,CMIT训练组大鼠于造模后第7天行强制性训练。大鼠给予7.2%水合氯醛腹腔注射麻醉,将健肢置于自然屈曲的位置,然后用石膏缠绕固定该肢体,限制该肢体活动,同时应用改良托盘试验的训练,每天训练时间上下午各15 min。此项训练可强迫大鼠进行患侧肢体的运动。30 d后训练停止,取脑组织及血清进行后续实验。训练过程无死亡率,存活率为100%。
1.4行为障碍评分 造模后30 d,对大鼠进行行为障碍评分,评分标准参照相关文献〔3〕,采用4分制。0分,未见相关障碍;1分,左侧前爪无力;2分,推手术侧肩部,可发觉对侧的移动阻力降低;3分,大鼠出现旋转、转圈及行动歪倒;4分,无肢体活动。分值越高说明行为障碍越重。
1.5脑组织病理形态检测 造模后30 d,水合氯醛腹腔注射麻醉大鼠处死,断头取大鼠脑组织,4%多聚甲醛固定24 h,梯度乙醇脱水,包埋,切片后进行苏木素-伊红(HE)染色,光镜下观察脑组织形态。
1.6免疫组化检测天冬氨酸特异性半胱氨酸蛋白酶(Caspase)-3及程序化死亡基因(PDCD)-5的表达 将石蜡切片脱蜡,二甲苯透明,梯度酒精脱水,磷酸盐缓冲液(PBS)清洗,抗原修复,添加Caspase-3及PDCD-5一抗(购于CST公司)过夜孵育,第2天二抗孵育,室温静置2 h,PBS清洗,DAB及苏木精染色,清洗后封片显微镜观察。
1.7RT-PCR检测Caspase-3及PDCD-5 mRNA表达 造模后30 d,水合氯醛腹腔注射麻醉大鼠并处死,断头取大鼠脑组织。实验所需器械均经高压去RNA酶处理,并经0.1%焦碳酸二乙酯(DEPC)水处理,且实验均在冰块上操作,降低温度对结果的影响。取组织块,加入1 ml TRIZOL,应用匀浆机裂解5 min,然后依次加入三氯甲烷、异丙醇及75%乙醇进行获取RNA,10 μl DEPC水溶解RNA沉淀,紫外分光光度仪测定浓度及纯度。应用逆转录试剂盒(购于Takara公司),严格按照说明书,将提取的RNA逆转录为cDNA,并严格按照扩增试剂反应要求进行PCR体系的扩增及反应。引物序列:Caspase-3上游引物5′-ATGGAAGTGTCTCTATTAA-3′,下游引物5′-AGAACGGATTGGGTATGCC-3′;β-actin上游引物5′-CCATAAGCATTTAAACCCTC-3′,下游引物5′-AGTGGGTCATTTCAATACG-3′;PDCD-5上游引物5′-TTGAATGTCTGACTGAAAA-3′,下游引物5′-CAGCCTTTTGTGTTAGACC-3′。
1.8神经元特异性烯醇化酶(NSE)及S-100β蛋白含量检测 造模后30 d,对大鼠进行眼球取血,静置2 h后高速离心取血清置于深冻冰箱备用。应用酶联免疫吸附(ELISA)测定NSE及S-100β含量,取冷冻血清,4℃解冻,应用NSE试剂盒及S-100β试剂盒(均购于R&D公司)。操作严格按照试剂盒说明书,预包被孔板,将稀释后的标准品加入标准品孔,将样品血清加入样品孔,加检测抗体,加生物素标记抗体,室温孵育,洗板,加入抗生物素蛋白链菌素-辣根过氧化物酶,室温孵育,洗板,显色液加入,室温避光孵育15 min,加入终止液,酶标仪读数,检测血清中两种蛋白含量。
1.9超氧化物歧化酶(SOD)检测 血清制备同1.8。应用SOD试剂盒(碧云天试剂公司),严格按照说明书及文献配置多种试剂及显色剂及操作〔3〕,并应用仪器检测吸光度。SOD(U/ml)=(对照管吸光度-测定管吸光度)/对照管吸光度×50%×稀释倍数。
1.10丙二醛(MDA)检测 血清制备同1.8。应用MDA试剂盒(碧云天试剂公司),采用荧光检测法,严格参照说明书及相关文献配置试剂及标准品〔3〕,试剂混匀后95℃水浴40 min,再流水一旁冲洗,3 500 r/min离心10 min,取上清后测定吸光度。MDA(nmol/ml)=(测定管吸光度-测定空白管吸光度)/(标准吸光度-标准空白管吸光度)×标准品浓度×稀释倍数。
1.11统计学方法 应用SPSS17.0软件行t检验。
2 结 果
2.1行为障碍评分 与假手术组(0分)大鼠相比,模型组〔(3.53±0.76)分〕及CMIT训练组〔(2.51±0.69)分〕各大鼠的神经功能评分显著升高(P<0.05);与模型组大鼠相比,CMIT训练组大鼠的神经功能评分显著降低(P<0.05)。
2.2脑组织病理学改变 假手术组大鼠脑组织细胞结构完整,细胞核、核膜及核仁结构完整;模型组细胞排列紊乱,水肿严重,核膜界线不清晰,血管充血严重;相比于模型组,CMIT训练组脑组织结构较完整,且坏死较模型组显著降低,间质水肿较大缓解,见图1。
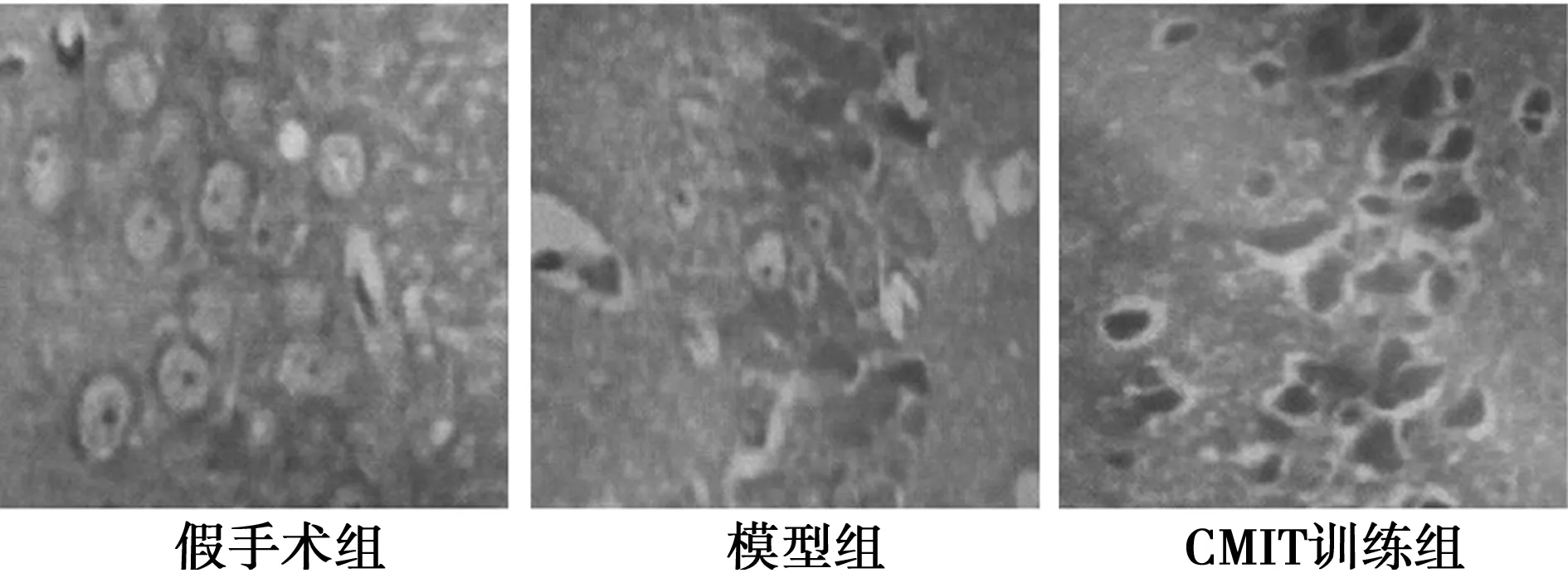
图1 各组大鼠HE染色(×400)
2.3Caspase-3及PDCD-5表达变化 光镜下,Caspase-3阳性细胞呈现棕黄色或黄褐色。假手术组基本未见Caspase-3阳性细胞;模型组随处可见大量Caspase-3阳性细胞;相比于假手术组,CMIT训练组及模型组Caspase-3阳性细胞含量明显增加;相对于模型组,CMIT训练组Caspase-3阳性细胞含量明显降低,见图2。光镜下,PDCD-5阳性细胞呈现棕黄色或黄褐色。假手术组基本未见PDCD-5阳性细胞;模型组随处可见大量PDCD-5阳性细胞;相比于假手术组,CMIT训练组及模型组PDCD-5阳性细胞含量明显增加;但相对于模型组,CMIT训练组PDCD-5阳性细胞含量明显降低,见图3。与假手术组大鼠相比,模型组及CMIT训练组大鼠的Caspase-3及PDCD-5 mRNA表达量显著升高(P<0.05);与模型组大鼠相比,CMIT训练组大鼠的Caspase-3及PDCD-5 mRNA表达量显著降低(P<0.05),见图4。
2.4SOD及MDA含量比较 相比于假手术组,模型组及CMIT训练组SOD含量显著降低、MDA含量显著升高(P<0.05);相比于模型组,CMIT训练组SOD含量表达显著升高(P<0.05)。见表1。

图2 各组脑组织Caspase-3表达(DAB,×400)

图3 各组脑组织PDCD-5表达(DAB,×400)

图4 Caspase-3及PDCD-5 mRNA含量表达

组别SODMDA假手术组379.44±7.122.23±1.43模型组142.75±7.881)15.32±1.211)CMIT训练组192.16±8.191)2)7.37±1.091)2)
与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05;下表同
2.5NSE及S-100β含量比较 相比于假手术组,模型组及CMIT训练组NSE、S-100β含量表达显著升高(P<0.05);相比于模型组,CMIT训练组NSE、S-100β含量表达显著降低(P<0.05)。见表2。
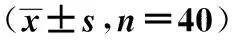
表2 各组大鼠NSE及S-100β含量比较
3 讨 论
脑卒中后,脑组织缺血缺氧导致细胞凋亡以及氧自由基增高,促使多种脑组织损伤特异性蛋白,如NSE、S-100β分泌增多,并随之诱导脑组织神经功能损伤。NSE是多由神经元细胞分泌的,是CNS特异性蛋白,正常情况下血清中无法被检测到,但当颅内缺血缺氧时,胞质内的NSE即被释放入血,可作为颅内损伤的标志物〔5〕;S-100β限制性表达于多种脑内胶质细胞,可调节细胞的生长代谢多种功能,参与颅内缺血缺氧的多种病理过程,被认为是脑损伤的特异性标记蛋白〔6〕。
作为脑卒中发病的重要因素之一,细胞凋亡是一种有序性的细胞死亡,是受多种基因调控的细胞正常死亡。已有研究表明,主要有3条信号通路可以干预凋亡:线粒体凋亡通路、内质网凋亡途径和死亡受体通路,这三种通路最终都通过激活下游Caspase-3、PDCD-5等凋亡蛋白,从而诱发了细胞的程序性死亡〔7〕。Caspase-3处于凋亡系统的中心环节,多种因子及通道均可激活Caspase-3分子,从而启动细胞凋亡〔8〕。PDCD-5是新近发现的凋亡因子,在凋亡过程中起着早期及始动性的功能,可诱发线粒体凋亡通路〔9〕。与此同时,机体在正常情况下可以清楚体内多余的自由基,然而在颅内缺血缺氧的情况下,机体内会出现较多的氧自由基的积聚,从而加重脑组织的损害。SOD是主要的抗氧化酶,能有效地清除体内自由基〔10〕;而MDA与线粒体膜的稳定性呈负相关〔11〕,因此通过测定两者情况可以评估颅内氧自由基水平。
多种干预措施可促进脑卒中后的神经功能恢复,其中CMIT疗法已被较广泛地应用于脑卒中患者康复领域,可有效改善患者神经功能障碍〔12〕。然而CMIT通过何种机制干预脑卒中恢复仍然不清楚。本研究可以看出,CMIT疗法可以形态学方面显著改善大鼠脑卒中神经功能障碍,免疫组化染色发现CMIT疗法可以改善大鼠颅内细胞凋亡程度,CMIT疗法还可以显著减轻脑卒中大鼠氧自由基的分泌。CMIT疗法可以降低脑特异损伤蛋白的分泌,参与脑卒中的修复。以往研究显示,CMIT疗法可诱发大脑皮层发生使用-依赖性神经功能重组的可塑性变化,可使脑卒中恢复期患者大脑皮层发生功能重组变化,使患侧上肢运动功能得到恢复〔13,14〕。本研究可以看出,CMIT疗法可以通过减轻颅内凋亡程度,氧自由基分泌状况及脑损伤蛋白的合成来改善脑卒中大鼠的神经功能障碍,然而有关其深入机制的研究仍需后续实验。
1中华预防医学会卒中预防与控制专业委员会介入学组,急性缺血性脑卒中血管内治疗中国专家共识组.急性缺血性脑卒中血管内治疗中国专家共识〔J〕.中国脑血管病杂志,2014;(10):556-60.
2张 璇,张林亭,张 霞,等.强制性使用运动疗法对大鼠脑缺血后神经可塑性的影响〔J〕.中国康复医学杂志,2014;29(7):615-8,623.
3李 红,张 爽,纪影实,等.山楂叶总黄酮对大鼠局灶性脑缺血再灌注损伤的保护作用〔J〕.中草药,2010;41(5):794-8.
4何 嫱.强制性运动训练促进脑缺血大鼠功能恢复的作用机制研究〔D〕.上海:复旦大学,2013.
5Li ZM,Xiao YL,Zhu JX,etal.Recombinant human erythropoietin improves functional recovery in patients with severe traumatic brain injury:A randomized,double blind and controlled clinical trial〔J〕.Clin Neurol Neurosurg,2016;150:80-3.
6Gao J,Zheng Z.Development of prognostic models for patients with traumatic brain injury:a systematic review〔J〕.Int J Clin Exp Med,2015;8(11):19881-5.
7Brazier SP,Telezhkin V,Kemp PJ.Functional interactions between BKCaα-subunit and annexin A5:implications in apoptosis〔J〕.Oxid Med Cell Longev,2016;2016:1607092.
8Cui J,Chen B,Wang H,atal.Glucosidase Ⅱ β-subunit,a novel substrate for caspase-3-like activity in rice,plays as a molecular switch between autophagy and programmed cell death〔J〕.Sci Rep,2016;6:31764.
9张晓璇,李佳佳.丁苯酞对脑缺血再灌注大鼠凋亡情况的影响〔J〕.中国实用神经疾病杂志,2014;17(14):44-6.
10Choudhary R,Bodakhe SH.Magnesium taurate prevents cataractogenesis via restoration of lenticular oxidative damage and ATPase function in cadmium chloride-induced hypertensive experimental animals〔J〕.Biomed Pharmacother,2016;84:836-44.
11Hedayati Kashka R,Zavareh S,Lashkarbolouki T.Augmenting effect of vitrification on lipid peroxidation in mouse preantral follicle during cultivation:modulation by coenzyme Q10〔J〕.Syst Biol Reprod Med,2016;62(6):404-14.
12李莹莹,张 备,李 策,等.强制性运动对脑缺血再灌注大鼠前肢运动功能及情绪相关脑区葡萄糖代谢的影响〔J〕.中华物理医学与康复杂志,2015;37(7):481-6.
13李 贺.强制性使用运动疗法对亚急性期脑卒中患者上肢运动功能的康复〔D〕.长春:吉林大学,2013.
14樊留博,韩文胜,章 霞,等.电针联合强制性运动对脑缺血大鼠神经功能及GFAP表达的影响〔J〕.中华全科医学,2014;12(12):1891-3,封3.
〔2016-11-14修回〕
(编辑 徐 杰)
R743
A
1005-9202(2017)18-4440-04;doi:10.3969/j.issn.1005-9202.2017.18.005
湖南省自然科学基金(12JJ9029);湖南省科技厅项目(2013FJ3117)
1 湖南省人民医院康复科
刘 佳(1963-),女,主治医师,主要从事神经康复研究。
王淑珍(1984-),女,硕士,助理研究员,主要从事神经康复研究。
