Wnt/β-catenin信号通路抑制剂对脑胶质瘤细胞迁移的影响
2017-09-27赵贤军袁国强周旺宁潘亚文
赵贤军 康 暐 袁国强 周旺宁 潘亚文
(兰州大学第二医院神经外科,甘肃 兰州 730030)
Wnt/β-catenin信号通路抑制剂对脑胶质瘤细胞迁移的影响
赵贤军 康 暐 袁国强 周旺宁 潘亚文
(兰州大学第二医院神经外科,甘肃 兰州 730030)
目的探讨Wnt/β-连环蛋白(β-catenin)信号通路抑制剂对脑胶质瘤细胞迁移能力的影响。方法抑制组用浓度为20 μmol/L的Wnt/β-catenin信号通路抑制剂FH535处理脑胶质瘤U251细胞,对照组细胞中不加入抑制剂。培养48 h后,噻唑蓝(MTT)检测各组细胞的存活率,细胞划痕实验检测各组细胞的迁徙率,Transwell小室检测各组细胞迁移的数目,用Western印迹法检测细胞中β-连环蛋白(β-catenin)、C-myc、基质金属蛋白酶(MMP)-9、MMP-2蛋白的表达水平。结果抑制组细胞存活率、细胞迁移数目、迁徙率和MMP-9、MMP-2蛋白水平与对照组相比明显降低(P<0.01)。抑制组细胞中β-catenin、C-myc水平明显低于对照组(P<0.01)。结论Wnt/β-catenin信号通路抑制剂能够抑制脑胶质瘤细胞增殖、迁徙及迁移能力。
脑胶质瘤;增殖;迁移;Wnt/β-catenin信号通路
脑胶质瘤是一种颅内肿瘤,发病率在全部恶性肿瘤发病率中占2%左右,治疗后的生存期只有8~11个月〔1〕。Wnt/β-catenin信号通路在结直肠癌、肺癌、肝癌、血管瘤、脑胶质瘤、前列腺癌等多种癌症发生过程中发挥调控作用〔2〕。有研究表明,20 μmol/L的Wnt/β-连环蛋白(β-catenin)信号通路抑制剂FH535能够抑制舌鳞癌、鼻咽癌细胞的生长,对癌细胞的迁移能力也具有一定的抑制作用〔3〕。本研究探究Wnt/β-catenin信号通路抑制剂作用后的脑胶质瘤细胞生长、迁徙和迁移能力的影响,以期为靶向抑制Wnt/β-catenin信号通路治疗脑胶质瘤提供理论依据。
1 材料与方法
1.1细胞 人胶质瘤细胞株U251购自中国科学院细胞库。
1.2主要仪器及试剂 RPMI1640培养基购自美国Gibco;胎牛血清(FBS)购自美国Hyclone;β-catenin单克隆抗体、C-myc单克隆抗体、基质金属蛋白酶(MMP)-9单克隆抗体、MMP-2单克隆抗体、β-actin单克隆抗体均购自美国CTS;二喹啉甲酸(BCA)蛋白浓度检测试剂盒购自美国Pierce;CO2培养箱购自美国Thermo;倒置显微镜购自日本Nikon。
1.3细胞培养 将保存于液氮中的胶质瘤细胞U251取出后放置37℃水浴锅中溶解,8 000 r/min离心10 min,弃上清液,加5 ml细胞培养液悬浮细胞,接种于细胞培养瓶,放在37℃、5%CO2培养箱中培养。观察细胞密度达到90%时,弃去细胞培养液,用磷酸盐缓冲液(PBS)重悬细胞两次,用0.25%的胰蛋白酶对细胞进行消化,根据实验要求接种到细胞培养瓶中,在37℃、5%CO2培养箱中培养。
1.4噻唑蓝(MTT)检测细胞增殖 U251细胞培养至对数期后消化,用细胞培养液把浓度调整到2×104个/ml,每孔加入100 μl细胞悬浮液接种到96孔细胞培养板中,培养过夜,弃细胞培养液,在细胞中加入含有Wnt/β-catenin信号通路抑制剂FH535浓度为20 μm的培养液,放置37℃、5%CO2培养箱中培养48 h后,在细胞中加入体积为10 μl,5 mg/ml的MTT,37℃下结合4 h。将上清液吸除后,加100 μl的二甲基亚砜(DMSO)。为了提高实验的准确性,每组设置6个复孔,以不加入细胞的孔为空白组用于调零。观察结晶物完全融化后,放置于酶标仪上检测每孔的光密度值(OD值),计算每组细胞存活率。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.5细胞划痕实验检测细胞迁徙能力 U251细胞培养至对数期后种植到24孔板中继续培养8h。在贴壁细胞中用枪头小心的划出一条细痕,用PBS把划下的细胞洗掉。加入含有Wnt/β-catenin信号通路抑制剂FH535浓度为20 μmol/L的培养液,在37℃、5%CO2培养箱中培养48 h后观察细痕的宽度。用细胞迁徙率表示细胞迁徙能力。迁徙率=(迁徙距离÷0 h划痕距离)×100%。
1.6Transwell小室检测细胞迁移能力 U251细胞培养至对数期后用胰蛋白酶消化并收集细胞。用含有Wnt/β-catenin信号通路抑制剂FH535浓度为20 μmol/L的培养液悬浮细胞,调整细胞浓度为5×106个/ml,在Transwell小室的下室加入600 μl含有10% FBS的完全培养液,取每组细胞悬液各100 μl加入到上室。放置于37℃、5%CO2培养箱中培养48 h,吸除小室上室的培养液,小心用棉签擦掉附着在小室内侧的未穿膜的细胞。收集各组中下室的细胞,在显微镜下计数,计算细胞迁移数。
1.7Western印迹检测细胞中β-catenin、C-myc、MMP-9、MMP-2表达水平 取Wnt/β-catenin信号通路抑制剂FH535浓度为20 μmol/L的培养液培养48 h后的U251细胞,提取细胞中的总蛋白。用BCA定量检测试剂盒检测蛋白浓度。蛋白与上样缓冲液煮沸3 min后进行SDS-PAGE电泳(每个上样孔中加入50 μl变性蛋白样品),80 V电压下观察溴酚蓝进入分离胶和浓缩胶边缘时改用120 V电压直至溴酚蓝进入到分离胶边缘。4℃转膜90 min。用5%脱脂奶粉封闭后,依次与一抗(600倍稀释)、二抗(1 000倍稀释)反应,显色曝光,以β-actin作为内参,分析计算目的蛋白的水平。
1.8统计学方法 应用SPSS22.0软件行t检验、单因素方差分析。
2 结 果
2.1细胞增殖检测结果 抑制剂组细胞存活率〔(62.34±2.54)%〕明显低于对照组〔(100.00±3.17)%〕(P<0.01)。
2.2细胞迁徙和迁移能力检测结果 见表1。抑制剂组细胞迁徙率、迁移细胞数目和MMP-2、MMP-9表达水平均明显低于对照组(P<0.01),提示Wnt/β-catenin信号通路抑制剂FH535能够抑制胶质瘤细胞的迁移能力。
2.3细胞中β-catenin、C-myc表达水平检测结果 抑制剂组中β-catenin、C-myc表达水平(0.28±0.03,0.57±0.06)明显低于对照组(0.69±0.08,0.98±0.06)(P<0.01),提示Wnt/β-catenin信号通路抑制剂FH535能够抑制Wnt/β-catenin信号通路的激活。
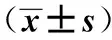
表1 细胞迁徙率、迁移细胞数目及MMP-2、MMP-9蛋白相对表达水平
与对照组比较:1)P<0.01
3 讨 论
Wnt/β-catenin信号通路是一个高度保守的信号通路,在胚胎发育、组织器官形成过程中均具有重要作用。Wnt/β-catenin信号通路能够通过激活β-catenin,进而导致β-catenin在细胞核内聚集,影响靶基因的转录和表达,调控细胞的生长过程〔4〕。在正常情况下,Wnt/β-catenin信号通路处于抑制状态,β-catenin与细胞内的其他蛋白以复合物的形式存在,当受到某些条件刺激后,泛素蛋白酶依赖的蛋白降解途径被激活,导致细胞内β-catenin复合物被降解β-catenin表达升高〔5〕。Wnt/β-catenin信号通路与肿瘤有密切关系,在肝癌、鼻咽癌、舌鳞癌等多种癌症中均发现有β-catenin的过度表达情况,当Wnt/β-catenin信号通路抑制剂作用后的肝癌细胞生长、迁移能力均明显降低〔6〕。FH535作为Wnt/β-catenin信号通路的抑制剂,能拮抗β-连环蛋白的转录〔7〕。本研究说明20 μmol/L的FH535能够抑制Wnt/β-catenin信号通路的激活。另外FH535作用后的脑胶质瘤细胞存活率明显降低。提示抑制Wnt/β-catenin信号通路能够抑制脑胶质细胞的增殖。
肿瘤的转移与肿瘤细胞的迁移有关。肿瘤细胞在受到特异性的迁移信号作用后,能够产生移动,而细胞外基质的降解是肿瘤细胞转移的重要组成部分〔8〕。细胞迁移过程受到MMP家族的作用,MMP-2、MMP-9能够降解Ⅳ型胶原酶〔9〕。有研究表明,MMP-2、MMP-9在肿瘤的转移过程中发挥重要作用〔10〕。本研究结果发现,FH535作用后的脑胶质瘤细胞迁徙能力、迁移能力均明显降低,而细胞内的MMP-2、MMP-9表达水平也明显下降,提示FH535能够抑制脑胶质瘤细胞的迁移能力,作用机制与MMP-2、MMP-9有关。
1Ruan S,Chen J,Cun X,etal.Noninvasive in vivo diagnosis of brain glioma using RGD-decorated fluorescent carbonaceous nanospheres〔J〕.J Biomed Nanotechnol,2015;11(12):2148-57.
2Hofsteen P,Robitaille AM,Chapman DP,etal.Quantitative proteomics identify DAB2 as a cardiac developmental regulator that inhibits WNT/β-catenin signaling〔J〕.Proc Nat Acad Sci,2016;113(4):1002-7.
3Beaulieu JF.Tuning WNT-β-catenin signaling via BCL9 proteins for targeting colorectal cancer cells〔J〕.E Biol Med,2015;2(12):1846-7.
4Arques O,Chicote I,Puig I,etal.Tankyrase inhibition blocks Wnt/β-catenin pathway and reverts resistance to PI3K and AKT inhibitors in the treatment of colorectal cancer〔J〕.Clin Cancer Res,2016;22(3):644-56.
5Senapedis WT,Donovan S,Golan G,etal.PAK4 allosteric modulators (PAMs) repress the Wnt/β-catenin signaling pathway and tumor growth〔J〕.Cancer Res,2015;75(15 Suppl):5404.
6Ganju A,Gara R,Kumari S,etal.Ormeloxifene attenuates wnt/β-catenin signaling in colon cancer cells by modulation of PKD1 and glycolytic pathways〔J〕.Cancer Res,2015;75(15 Suppl):2072.
7Liu L,Zhi Q,Shen M,etal.FH535,a β-catenin pathway inhibitor,represses pancreatic cancer xenograft growth and angiogenesis〔J〕.Oncotarget,2016;7(30):47145.
8吕会来,张 丽,温士旺,等.微小 RNA-126 在食管癌组织中的表达及其对食管癌 EC109 细胞增殖和迁移的影响〔J〕.中国老年学杂志,2016;36(10):2332-4.
9Nakamura K,Sawada K,Kinose Y,etal.Exosome transfer from ovarian cancer cells to mesothelial cells promotes cell invasion by upregulating MMP-9 secretion and increasing clearance of mesothelial cells〔J〕.Cancer Res,2015;75(15 Suppl):5060.
10杨 晟,刘声财,陈文华,等.1,25-(OH) _2VitD_3 对人胰腺癌细胞侵袭迁移能力及 MMP-2,9,14 表达的影响〔J〕.山东医药,2016;56(34):17-9.
〔2017-06-07修回〕
(编辑 郭 菁/滕欣航)
R739.41
A
1005-9202(2017)18-4474-03;doi:10.3969/j.issn.1005-9202.2017.18.018
甘肃省自然科学基金项目(1606RJZA201)
赵贤军(1972-),男,博士,副主任医师,主要从事颅脑肿瘤、脑血管疾病研究。
