人参糖肽对大鼠体外胰岛β细胞的保护作用
2017-09-03赵丽艳张秀云苗春生李相军刘昕鸣
赵丽艳 张秀云 苗春生 李相军 李 才 刘昕鸣
(吉林大学第二医院检验科,吉林 长春 130041)
人参糖肽对大鼠体外胰岛β细胞的保护作用
赵丽艳 张秀云1苗春生1李相军1李 才1刘昕鸣
(吉林大学第二医院检验科,吉林 长春 130041)
目的 探讨人参糖肽对体外培养大鼠胰岛β细胞的保护效果。方法 分离和培养大鼠胰岛β细胞。人参糖肽预处理β细胞之后用链脲佐菌素(STZ)引起细胞损伤(人参糖肽+STZ组),STZ引起β细胞损伤后再进行人参糖肽处理(STZ+人参糖肽组),以正常胰岛β细胞和单用人参糖肽处理的β细胞作为对照。检测培养上清中胰岛素和C肽分泌水平,噻唑蓝(MTT)法检测细胞存活率,免疫组织化学染色测量β细胞内胰岛素蛋白表达水平,电镜观察细胞超微结构变化。结果 人参糖肽+STZ组胰岛β细胞的胰岛素和C肽分泌量与正常胰岛细胞比较差异无统计学意义(P>0.05),而在STZ+人参糖肽组二者分泌量均明显减少(P<0.05)。人参糖肽+STZ组胰岛β细胞的存活率有所下降,但与单独人参糖肽组比较差异无统计学意义(P>0.05),而STZ+人参糖肽组细胞存活率显著降低(P<0.05)。免疫组织化学定量研究显示,STZ+人参糖肽组胰岛β细胞内胰岛素阳性染色面积与细胞面积的百分比明显小于其他3组。STZ+人参糖肽组胰岛β细胞超微结构为变性及坏死性改变,且分泌颗粒极少,而人参糖肽+STZ组胰岛β细胞这些改变明显减轻,可见大量分泌颗粒。结论 人参糖肽对STZ引起的大鼠体外胰岛β细胞损伤有防护作用。
人参糖肽;胰岛β细胞;胰岛素
人参糖肽是我国治疗糖尿病(DM)的中药二类新药。研究证明,人参糖肽能降低实验性DM动物的血糖水平〔1〕。应用人参糖肽治疗2型糖尿病(T2DM)患者,其降低血糖起效较缓慢,但作用持续,停药后一段时间内血糖仍处于较低水平〔2〕。人参糖肽降低血糖作用的机制尚未阐明。胰岛β细胞的主要功能是分泌胰岛素,胰岛素对维持机体糖稳态起关键作用,在DM的发生发展中扮演重要角色。人参糖肽能否通过保护胰岛β细胞功能发挥降低血糖的作用,目前尚未见报道。本研究旨在探讨人参糖肽对体外培养大鼠胰岛β细胞的保护效果。
1 材料与方法
1.1 材料 人参糖肽注射液由吉林省松原天实药业有限责任公司提供,使用时用生理盐水配制成所需浓度。链脲佐菌素(STZ)、胰岛素抗体、胶原酶Ⅴ、细胞分离液Histopaque1077、双硫腙、噻唑蓝(MTT)购自Sigma公司;RPMI- 1640培养基、胎牛血清(FBS)购自Gibco公司;胰岛素和C肽放射免疫分析试剂盒购自中国原子能科学研究院同位素研究所;其他试剂为国产分析纯;浓缩型链霉素亲和素- 生物素复合物(SABC)试剂盒、二氨基联苯胺(DAB)显色试剂盒及其他组化试剂购自博士德公司。体重250~300 g雄性Wistar大鼠由吉林大学实验动物部提供(实验动物合格证号吉科字950000010,医动字10- 5110)。
1.2 胰岛β细胞的分离和培养 参考文献〔3〕的方法并加以改进。大鼠过夜禁食,腹腔注射戊巴比妥钠麻醉,无菌条件下剪开腹壁,上翻肝脏,下拉十二指肠,分离胆总管十二指肠入口处,引入手术线,近肝门部结扎胆总管上端,胆总管中段向远侧插入4.5号针头,准确插入后可见黄绿色胆汁回流,心脏放血处死大鼠。经胆总管逆行注入预冷Hank液,再灌注胶原酶Ⅴ(1 mg/ml)6 ml。灌注后迅速剪下膨胀的胰腺,将其放入预热至37℃的水浴中温育,静止消化12 min。用力振荡胰腺消化产物,经600 μm滤网过滤除去未完全消化的组织,终止消化,4℃ 1 000 r/min离心 2 min。将胰岛消化产物混于分离液Histopaque1077中,再沿管壁在混合产物之上缓慢加入10 ml Histopaque1077,继而加入10 ml冷Hank液,梯度离心收集纯化胰岛。双硫腙染色倒置显微镜下观察染成猩红色的细胞团即为胰岛〔4〕。调整细胞浓度为2×105/ml,置于6孔培养板中,用含10%FBS、青霉素100 U/ml、链霉素0.1 mg/ml的RPMI- 1640培养基于5% CO2、37℃培养5 d后用于下述实验。
1.3 胰岛β细胞处理、胰岛素和C肽分泌量测定 ①人参糖肽+STZ组:在含等量胰岛β细胞的培养液中加入终浓度160 μg/ml的人参糖肽,继续培养24 h,再加入STZ(5 mmol/L)作用2 h后收集培养上清,按放射免疫分析试剂盒说明书测定胰岛素和C肽分泌量;②STZ+人参糖肽组:在含等量胰岛β细胞的培养液中先加入STZ(5 mmol/L)作用2 h后再加入人参糖肽160 μg/ml,继续培养24 h,收集培养上清,按放射免疫分析试剂盒说明书测定胰岛素和C肽分泌量。以正常胰岛β细胞和单独用人参糖肽处理的β细胞为对照。每组3个平行孔。
1.4 胰岛β细胞存活率的检测 96孔培养板每孔加入混匀的β细胞悬液190 μl(含10 000个细胞)。经上述因素处理并培养24 h后,每孔加入5 mg/ml的MTT溶液20 μl,继续培养4 h。吸弃孔内上清液,每孔加入150 μl二甲基亚砜(DMSO),充分振荡。设置调零孔和空白对照孔。以空白对照孔调零,用酶标仪在570 nm波长测定每孔的A值。每种条件6个平行孔。计算细胞存活率,细胞存活率=(实验孔A值-空白对照A值)/(对照孔A值-空白对照A值)×100%。
1.5 免疫细胞化学染色 上述胰岛β细胞处理后在6孔板制备细胞爬片,磷酸盐缓冲液(PBS)清洗,冰丙酮固定15 min,空气干燥,PBS清洗,0.5%Triton X- 100孵育20 min,PBS清洗,3%H2O2室温孵育15 min,PBS清洗3次,封闭血清封闭后,滴加胰岛素一抗(1∶200),4℃过夜,以PBS代替一抗作为阴性对照。PBS漂洗,滴加二抗37℃孵育30 min,PBS漂洗,加入SABC 37℃孵育20 min,DAB显色。苏木素复染,脱水,透明,中性树脂封片。光镜观察反应产物呈棕褐色为阳性反应。利用Imagepro Plus 6.0分析软件测定每个细胞胰岛素阳性染色的面积和细胞总面积,计算二者百分比,表示胰岛素蛋白表达水平。每组测量30个细胞。
1.6 胰岛β细胞电镜观察 将上述1.3中经过不同处理的胰岛β细胞刮下,悬浮在培养液中,倾入尖底离心管,800 r/min离心10 min,吸除上清液,缓慢加入2.5%戊二醛固定液,800 r/min离心10 min,使细胞成小丸状,在含2.5%戊二醛固定液中切成1 mm3小块,用2.5%戊二醛前固定和1%锇酸后固定,Epon 812包埋,LKB- V型超薄切片机制备超薄切片,铀和铅双重染色,JEM- 1200EX透射电镜观察胰岛细胞超微结构并摄片。
1.7 统计学方法 应用SPSS12.0软件进行单因素方差分析、χ2检验。
2 结 果
2.1 胰岛素和C肽分泌量 与正常胰岛β细胞组相比,单独人参糖肽处理β细胞24 h,对胰岛素的分泌量无显著影响。人参糖肽+STZ组胰岛β细胞,其胰岛素分泌量与正常胰岛β细胞组及单独人参糖肽处理组比较无统计学意义(P>0.05)。但STZ+人参糖肽组胰岛素分泌量显著低于其他3组(P<0.05)。C肽分泌量与胰岛素分泌量基本一致。见表1。
2.2 胰岛β细胞存活率的检测结果 与正常胰岛β细胞组相比,单独人参糖肽组仍然很高,可达(96.8±18.6)%,表明人参糖肽对胰岛β细胞无明显细胞毒性。人参糖肽+STZ组,细胞存活率有所下降,但与单独人参糖肽组比较无统计学意义。STZ+人参糖肽组细胞存活率显著低于其他3组(P<0.05)。见表1。
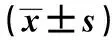
表1 各组胰岛β细胞的胰岛素、C肽分泌量和细胞存活率
与STZ+人参糖肽组比较:1)P<0.05
2.3 免疫细胞化学染色结果 培养5 d的胰岛β细胞呈球形或略呈椭圆形,直径10~14 μm,胞质透亮,胞核大。免疫细胞化学染色显示:正常胰岛β细胞呈椭圆形或短梭形,核圆而大,细胞结构无明显异常,在胞质内可见胰岛素呈浓重棕黄色阳性表达,证明所分离和培养的细胞是胰岛β细胞。单独加入人参糖肽对胰岛β细胞结构无明显影响,胞核呈圆形,胞质内可见胰岛素呈棕黄色阳性表达。人参糖肽+STZ组胞核呈圆形,胞质呈棕色,可见少量空泡。STZ+人参糖肽组核膜界限模糊,部分胞膜破坏,胞浆内可见多数空泡,胞质呈浅淡黄色。STZ+人参糖肽组胰岛β细胞内胰岛素阳性染色面积与细胞面积的百分比(38.8±8.2)%明显小于正常胰岛β细胞组(89.9±24.2)%、单独人参糖肽组(86.6±17.8)%和人参糖肽+STZ组(76.4±18.6)%(P<0.05)。见图1。

图1 各组胰岛β细胞免疫细胞化学染色(×400)
2.4 胰岛β细胞超微结构改变 正常胰岛β细胞:胞核较规则,核膜光滑,染色质均匀分布,内质网丰富,胞质内可见大量高密度的分泌颗粒。人参糖肽+STZ组:胞核较规则,胞核内染色质边聚不明显,线粒体较多,胞质内可见较多分泌颗粒。STZ+人参糖肽组:呈变性和坏死性改变,胞核染色质浓集边聚,细胞器溶解,可见大小不一的空泡,胞质内分泌颗粒稀少,见图2。

A:正常胰岛β细胞(×8 000);B:人参糖肽+STZ(×6 600);C:STZ+人参糖肽(×8 000)图2 各组胰岛β细胞超微结构改变
3 讨 论
胰岛β细胞是体内分泌胰岛素的重要细胞,在DM的发生发展中起关键作用,保护胰岛β细胞具有重要意义。研究胰岛β细胞功能可以利用胰岛素瘤细胞如NIT- 1β、MIN6N8、RIN- m5f、INS- 1细胞,也可利用从动物胰腺分离培养的胰岛β细胞〔5,6〕,本研究利用从大鼠胰腺组织分离培养的胰岛β细胞。STZ对胰岛β细胞具有高度选择性毒性,除了用来复制DM动物模型外,目前已用于体外引起胰岛β细胞损伤〔7〕,本研究利用STZ作为损伤胰岛β细胞的因素。C肽与胰岛素以等分子数从胰岛β细胞释放,具有稳定性好、不受外源性胰岛素和血胰岛素抗体的影响等特点,已成为胰岛素分泌能力的一个良好指标。本研究表明人参糖肽预处理对胰岛β细胞有较好的保护作用。但人参糖肽后处理对胰岛β细胞的保护作用不明显。
细胞存活率可以反映损伤因素对细胞的损害程度。本研究结果表明,人参糖肽预处理能显著减轻STZ对胰岛β细胞的损伤,对细胞有较好的保护作用。然而,人参糖肽后处理不能明显保护胰岛β细胞。本研究免疫细胞化学染色证明所分离和培养的细胞是胰岛β细胞。从细胞形态改变和胰岛素阳性染色面积与细胞面积的百分比分析可见,人参糖肽预处理对胰岛β细胞损伤有较好的保护作用,而人参糖肽后处理则保护作用较差。胰岛β细胞超微结构改变进一步说明人参糖肽预处理对胰岛β细胞损伤有较好的保护作用。
由于胰腺β细胞中的抗氧化酶活性很低,对氧化应激更为敏感,活性氧不仅可以直接损伤胰岛β细胞,还可影响胰岛素合成和分泌的信号转导通路,导致β细胞凋亡,损害胰岛分泌功能。研究表明,氧化应激在1型和T2DM胰岛β细胞功能不全的发生机制中起重要作用〔8〕。目前人参糖肽保护胰岛β细胞的机制尚不十分清楚。研究证明,人参糖肽对蛋白质糖基化终产物(AGEs)的形成具有明显抑制作用〔9〕,还能明显改善DM大鼠体内蓄积AGEs的致尾腱胶原交联〔10〕。Lin等〔11〕研究证明,AGEs通过氧化应激引起胰岛β细胞损伤。还有研究显示,人参通过减少氧化应激减轻环孢素引起的胰岛β细胞损伤〔12〕。因此认为人参糖肽可能通过其抗氧化应激作用对胰腺β细胞发挥保护作用。
1 陈文学,杨 铭,于德伟,等.人参糖肽对糖尿病气阴两虚证大鼠降血糖作用及其机制研究〔J〕.中国药学杂志,2014;49(21):1903- 7.
2 张秋梅,张 喆,于德民,等.人参糖肽治疗2型糖尿病的临床观察〔J〕.中国现代医学杂志,2003;13(6):59- 62.
3 刘玉溥,吕庆国,童南伟.大鼠胰岛β细胞分离与原代培养方法探讨〔J〕.四川大学学报(医学版),2009;40(1):153- 6.
4 董维平,张洪德,王煜非,等.胰岛移植物质量鉴定方法的研究〔J〕.中华器官移植杂志,1998;19(4):205- 7.
5 Wang J,Song MY,Bae UJ,etal.n- 3 Polyunsaturated fatty acids protect against pancreatic β- cell damage due to ER stress and prevent diabetes development〔J〕.Mol Nutr Food Res,2015;59(9):1791- 802.
6 杨宏莉,张宏馨,李兰会,等.山药多糖对体外培养大鼠胰岛细胞活性及胰岛素分泌的影响〔J〕.河北大学学报(自然科学版),2010;30(4):408- 12.
7 陈志红,李 堂,孙秀芳.黄芪对胰岛β细胞保护作用的研究〔J〕.北京中医药大学学报,2009;32(3):182- 4.
8 Drews G,Krippeit- Drews P,Dufer M.Oxidative stress and beta- cell dysfunction〔J〕.Pflugers Arch,2010;460(4):703- 18.
9 张 旗,王诗雯,苗春生,等.人参糖肽对糖基化抑制作用的体外研究〔J〕.中国老年学杂志,2009;29(5):557- 9.
10 李 才,李相军,苗春生,等.人参糖肽对糖尿病大鼠尾腱胶原交联的改善作用〔J〕.中国中药杂志,2005;30(7):544- 7.
11 Lin N,Zhang H,Su Q.Advanced glycation end- products induce injury to pancreatic beta cells through oxidative stress〔J〕.Diabetes Metab,2012;38(3):250- 7.
12 Lim SW,Doh KC,Jin L,etal.Oral administration of ginseng ameliorates cyclosporine- induced pancreatic injury in an experimental mouse model〔J〕.PLoS One,2013;8(8):e72685.
〔2017- 05- 10修回〕
(编辑 滕欣航)
吉林省科学技术厅资助项目(No.20010545)
刘昕鸣(1961- ),女,副教授,主要从事内分泌代谢疾病临床生化研究。
赵丽艳(1971- ),女,博士,副教授,主要从事代谢性疾病和抗病生物学研究。
R965,R587.1
A
1005- 9202(2017)15- 3667- 03;
10.3969/j.issn.1005- 9202.2017.15.011
1 吉林大学药学院实验药理与毒理学教研室
