间充质干细胞缓解大鼠急性肺损伤的分子机制
2017-09-03胡晓旻王延安
胡晓旻 刘 刚 刘 超 王延安
(天津市第三中心医院心脏中心,天津 300170)
间充质干细胞缓解大鼠急性肺损伤的分子机制
胡晓旻 刘 刚1刘 超2王延安3
(天津市第三中心医院心脏中心,天津 300170)
目的 探讨间充质干细胞(MSCs)抑制核因子(NF)- κB的活性和抑制亲环素(CyP)A的表达而缓解急性肺损伤(ALI)的分子机制。方法 首先比较脐带和骨髓MSCs的细胞形态、细胞表型、分化能力和免疫能力,并采用全基因组表达芯片比较两者的功能基因表达差异。通过注射脂多糖(LPS)制备SD大鼠ALI模型,研究输注MSCs能否通过抑制CyPA的表达和抑制NF- κB的活性,进而控制炎症反应的过度激活和抑制氧化应激等,减轻内毒素所致的ALI。 结果 CD29在脐带MSCs的阳性表达率低于在骨髓MSCs中的表达率(P<0.01)。聚类分析发现骨髓来源的MSCs中高表达的基因主要集中在免疫相关和骨骼发育相关的基因,而脐带MSCs中高表达的基因主要集中在细胞分化、器官发育和信号转导的相关基因。对SD大鼠ALI损伤模型的研究发现,MSCs干预可减轻LPS对肺组织的损伤程度。LPS组各时间点血浆促炎因子巨噬细胞炎症蛋白(MIP)- 2 水平显著高于对照组和MSCs+LPS组(P<0.05)。MSCs可显著抑制LPS诱发的炎症因子MIP- 2的增高(P<0.05)。与对照组相比,LPS组在各时间点CyPA蛋白表达和TNF- α表达水平均显著升高(P<0.05),而MSCs可以抑制CyPA的蛋白和TNF- α的表达(P<0.05)。肺组织NF- κB 在LPS组增高,MSC干预可有效降低NF- κB 表达(P均<0.05)。LPS组肺组织丙二醛(MDA)和髓过氧化物酶(MPO)活性水平在三个时间点均明显高于对照组,在各相应时间点,MSCs+LPS组肺组织MDA和MPO均明显低于LPS组(P均<0.05)。结论 脐带MSCs明显降低了大鼠血浆促炎因子的水平,可显著抑制CyPA的表达,并通过抑制NF- κB的活性减轻了LPS引起的全身炎症反应和氧化应激,减轻了LPS所致的肺损伤。
间充质干细胞;急性肺损伤;核因子- κB;亲环素A;信号转导通路
急性肺损伤(ALI)发病机制目前仍未阐明,目前临床上ALI的治疗主要是支持性治疗,尚未找到针对性的治疗措施。存在于革兰阴性菌表面的脂多糖(LPS)可以通过Toll样受体(TLR)4激活下游的核因子(NF)- κB信号通路〔1,2〕。NF- κB信号通路活化后,启动靶基因的表达,可以引起肿瘤坏死因子(TNF)- α、白细胞介素(IL)- 1、IL- 6、IL- 8等多种炎性介质及细胞因子的释放,诱发炎症反应。亲环素(CyP)A在细胞内广泛存在,生理功能为对单核细胞、巨噬细胞、内皮细胞和平滑肌细胞产生氧化刺激,而且在细胞外部对白细胞具有趋化作用。CyPA通过与受体CD147结合,可以活化NF- κB通路〔3〕,因此在病理情况下具有促炎作用。间充质干细胞(MSCs)具有多向分化、免疫调节的特性,不仅能够归巢至损伤组织,抑制受损组织发生的免疫反应和过度炎性反应,MSCs还具有向多种组织、细胞分化的潜能,因此在创伤修复、组织功能再生与重建、免疫调节等领域应用前景广阔〔4〕。MSCs可通过其抗炎、抗凋亡和免疫调节的作用,减轻内毒素引起的ALI,改善肺功能,提高ALI/急性呼吸窘迫综合征(ARDS)模式动物的生存率,为ALI的治疗提供了新的方法与思路。本研究探讨抑制NF- κB的活性和CyPA的表达而缓解ALI的分子机制。
1 资料和方法
1.1 材料与试剂 脐带MSCs的获取:采集足月健康新生儿脐带组织30份。足月正常分娩之脐带来自我院产科病房,均取得产妇及家属的知情同意。产妇的年龄为(29.1±5.7)岁。骨髓MSCs的获取:常规局麻,于髂骨取骨髓,分离制备骨髓MSCs。低糖DMEM培养基、高糖DMEM培养基购自武汉博士德生物工程有限公司;胎牛血清和Trizol试剂购自Gibco公司。荧光标记鼠抗人CD29、CD44、CD73、CD105和CD166及其同型对照购自Sigma公司。
1.2 MSCs的培养和鉴定 脐带MSCs采用胰酶消化法获取。取无菌脐带2 cm,磷酸盐缓冲液(PBS)洗净,剪碎后使用Ⅳ型胶原酶37℃消化,离心,洗涤3遍,取下层沉淀,再以胰蛋白酶PBS消化后离心,获取沉淀后使用吹打细胞悬浮,以100 μm滤网过滤并离心获得单细胞。然后以PBS离心后洗涤细胞2次,置于低糖DMEM培养基中培养。骨髓组织用PBS液稀释后,放置在淋巴细胞分离液面上,离心25 min后获得单个核细胞,采用DMEM培养基培养。另种MSCs均传至F4代时进行常规倒置显微镜观察,进行HE染色。在含MSCs的PBS中加入鼠抗人抗体PE- CD44,FIFC- CD29,PE- CD73,FIFC- CD90,PE- CD105,PE- CD166,进行流式细胞检测。
1.3 利用基因芯片分析MSCs的基因表达 使用人全基因组表达基因芯片对这两种细胞的基因组表达和微小表达情况进行比较分析,并对差异表达的基因进行功能聚类分析。采用Affymetrix mrcroarray 公司提供的基因差异表达芯片,生物素标记cDNA,进行杂交反应,采用基因芯片操作软件对数据进行采集和处理,使用DAVID分析软件进行功能聚类分析。
1.4 脓毒症ALI模型的制作及输注MSCs悬液治疗肺损伤 选择SD大鼠90只,随机分成3组,分别为对照组30只、LPS组30只和MSC+LPS组30只。LPS组和MSC+LPS组均采用腹腔内注射LPS 10 mg/kg的方法制作脓毒症模型,后者于LPS注射1 h后,通过鼠尾静脉给予含5×105脐带MSCs的生理盐水300 μl,对照组和LPS组则给予300 μl生理盐水。分别于尾静脉注射后6 h、24 h和48 h处死大鼠,每次10只,于左肺取得支气管肺泡灌洗液,测定支气管肺泡灌洗液蛋白浓度,收集血浆和右肺组织。取右肺下叶,采用4%多聚甲醛溶液对SD大鼠肺脏进行固定,常规病理切片后进行HE染色。以肺泡充血、出血、中性粒细胞浸润和肺泡间隔增厚或透明膜形成等四种病变对肺组织损伤进行综合评定并分级。0级为无损伤,1级肺组织损伤面积小于1/4,2级肺组织损伤面积介于1/4~1/2,3级肺组织损伤面积介于1/2~3/4,4级肺组织损伤面积大于3/4。取右肺中叶,制备肺组织匀浆。将各组肺组织匀浆100 mg,ELISA方法测定肺组织TNF- α水平,免疫荧光法测定肺组织CyPA蛋白含量,并测定CyPA mRNA表达水平。取右肺上叶,先称重,然后进行烘干并再次称重,计算肺组织湿干比。采用ELISA的方法测定炎症因子巨噬细胞炎症蛋白(MIP)- 2、IL- 10、CyPA和NF- κB水平。采用Western印迹方法测定NF- κB的肺组织入核水平。对肺组织丙二醛(MDA)和髓过氧化物酶(MPO)活性进行测定。
1.5 统计学方法 采用SPSS19.0统计软件进行方差分析。
2 结 果
2.1 两种MSCs细胞表面抗原表达 脐带来源的MSCs细胞表面CD44、CD73、CD90、CD105和CD166阳性表达率分别为(92.15±4.31)%、(94.43±3.68)%、(97.39±4.74)%、(93.88±5.11)%和(98.62±4.64)%,骨髓来源的MSCs细胞表面CD44、CD73、CD90、CD105和CD166阳性表达率分别为(92.78±4.22)%、(95.02±3.49)%、(96.86±4.45)%、(93.23±4.98)%和(98.23±4.14)%,两组相比差别无统计学意义。但是CD29在脐带MSCs的阳性表达率仅(43.5±2.32)%,明显低于在骨髓MSCs中的表达率(90.15±3.43)%(P<0.01)。
2.2 基因芯片分析MSCs的基因表达 基因芯片mRNA差异表达分析脐带来源MSCs和骨髓来源MSCs之间至少4倍差异表达的基因,可得到1 190个差异表达的基因。聚类分析发现骨髓来源的MSCs中高表达的基因主要集中在免疫相关和骨骼发育相关的基因,而脐带MSC中高表达的基因主要集中在细胞分化、器官发育和信号转导的相关基因。
2.3 SD大鼠肺组织病理、肺组织湿干比、支气管肺泡灌洗液蛋白浓度改变 SD大鼠于腹腔注射LPS 6 h开始,肺组织病理开始肺毛细血管充血、出血,肺毛细血管、肺泡间隔和肺泡腔可见大量炎性细胞浸润,部分肺泡内可见富含蛋白质的水肿液,于LPS注射24 h时达到高峰,48 h水肿液开始减少。MSC+LPS组肺组织的损伤程度于6 h、24 h和48 h三个时间点均较LPS组明显减轻。LPS组24 h肺组织湿干比明显升高并达峰,MSC+LPS组24 h肺干湿比明显低于LPS组(P<0.05),48 h MSC+LPS组和LPS比较,肺组织湿干比差异无统计学意义(P>0.05)。支气管肺泡灌洗液蛋白浓度在LPS组明显增高升高,并于24 h达到高峰。与LPS组比较,MSC+LPS组在各时间点支气管肺泡灌洗液蛋白浓度差异无统计学意义(P>0.05)。
2.4 不同时间点血浆MIP- 2、IL- 10 水平的组间比较 LPS组在时间点血浆促炎因子MIP- 2 水平显著高于对照组和MSC+LPS组(P<0.05);血清IL- 10 水平组间比较差异无统计学意义(P>0.05)。MIP- 2水平在LPS刺激下明显升高并于6 h达峰。MSC+LPS组各时间点MIP- 2水平显著低于LPS组,说明MSCs可显著抑制LPS诱发的炎症反应。见表1。
2.5 肺组织CyPA、TNF- α 水平的组间比较 与对照组相比,LPS组在6 h、12 h和24 h CyPA蛋白表达均显著升高(P<0.05),与LPS组相比,MSC+LPS组CyPA表达下降有统计学意义(P<0.05)。说明LPS可以明显提高SD大鼠肺组织的CyPA的表达,而MSCs可以抑制CyPA的蛋白表达。LPS组肺组织TNF- α表达水平在各时间点均高于对照组的表达水平(P<0.05),各相应时间点MSC+LPS组TNF- α表达水平均低于LPS组(P<0.05)。见表2。
2.6 肺组织NF- κB(P65)入核检测结果的比较 肺组织NF- κB在对照组、LPS组和MSC+LPS组NF- κB 表达分别为(0.25±0.04)、(0.69±0.04)和(0.42±0.04),三组之间比较差异均有统计学意义(P<0.05)。
2.7 肺组织MDA和MPO活性水平比较 LPS组肺组织MDA在三个时间点均明显高于对照组(P<0.05);在各相应时间点,MSC+LPS组肺组织MDA水平则明显低于LPS组(P<0.05)。三个时间点LPS组MPO活性水平明显高于对照组(P<0.05);MSC+LPS组明显低于LPS组(P<0.05);各组内MPO水平差异无统计学意义(P>0.05),见表3。

表1 不同时间点各组血浆MIP- 2、IL- 10水平比较
与LPS 组比较:1)P<0.05;与对照组比较:2)P<0.05,下表同

表2 不同时间点肺组织CyPA、TNF- α 水平的比较
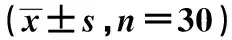
表3 各组不同时间点肺组织MDA和MPO活性水平比较
3 讨 论
脓毒症所致的ALI发病具体机制目前尚未完全明确。一过性的炎症反应是机体控制感染的自我保护反应,目前普遍认为ALI发病的本质是大量炎症细胞和炎症因子导致的过度失控性的炎性反应。中性粒细胞、巨噬细胞在内毒素作用下,产生TNF- α、白细胞介素等促炎因子,启动炎性反应的级联反应〔5〕。因此内毒素血症是ALI/ARDS发病的始动关键环节,通过活化各种炎症细胞,触发炎症反应,进而导致肺血管通透性增高、肺泡腔蛋白质渗出、肺水肿和透明膜的形成。
既往研究表明,LPS可以TLR4激活下游的NF- κB信号通路〔6〕。NF- κB作为核转录因子,通过与B细胞免疫球蛋白的轻链κ链基因增强子序列结合,调节靶基因表达,引起包括MIP- 2、TNF- α和IL家族在内的多种炎性介质和细胞因子释放,从而诱发机体的炎症反应,因此NF- κB通路在机体炎症反应过程中起核心作用〔2,6〕。因此阻断NF- κB信号转导通路可减轻LPS诱导的ALI的炎症反应,因此有望成为治疗ALI/ARDS的靶点。MSCs可以从骨髓、脐带、脂肪、肝脏等脏器或组织获得,然而不同组织取得的MSCs在功能和分化上不尽相同。本研究结果证实脐带来源的MSCs具有更高的增殖率,骨髓来源的MSCs中高表达的基因主要集中在免疫相关和骨骼发育相关的基因,而脐带MSCs中高表达的基因主要集中在细胞分化、器官发育和信号转导的相关基因。对于盲肠结扎穿孔的脓毒症小鼠模型的研究表明受累的肺组织中MIP- 2 表达及MPO 均明显增高〔7〕。本研究说明MSCs干预可明显减轻大鼠肺损伤。
炎症因子会进一步活化中性粒细胞和血管内皮细胞,趋化中性粒细胞迁移到肺组织内。中性粒细胞激活后产生氧自由基和蛋白酶,中性粒细胞呼吸爆发,可直接损伤肺组织或通过激活诱导炎症因子释放,引发炎症逐级放大〔8〕。MPO可反映中性粒细胞的浸润程度〔9〕,而MDA是脂质过氧化的产物〔10〕。本研究说明MSCs干预可阻断或部分阻断中性粒细胞的浸润和呼吸爆发。
CyPA 主要由活性氧化物质的激活分泌,通过与受体CD147结合激活NF- κB 通路,调节促炎因子TNF- α等的释放〔3,11〕。NF- κB以p65/p50二聚体的形式存在于胞质中,其中p65含有转录活化区域。静息状态下,胞质中的NF- κB与IκB- α结合,使p65的转录活化区域功能受到抑制而不能发挥转录调节作用〔12〕。本研究说明MSCs在NF- κB通路的上游起作用,从而干预caspase级联放大的炎症反应。
1 伍冬冬,潘频华,覃庆武.急性肺损伤/急性呼吸窘迫综合征发病机制研究进展〔J〕.中华结核和呼吸杂志,2015;38(7):524- 7.
2 Sender V,Stamme C.Lung cell- specific modulation of LPS- induced TLR4 receptor and adaptor localization〔J〕.Commun Integr Biol,2014;7:e29053.
3 Zhu D,Wang Z,Zhao JJ,etal.The Cyclophilin A- CD147 complex promotes the proliferation and homing of multiple myeloma cells〔J〕.Nat Med,2015;21(6):572- 80.
4 Zhou Z,You Z.Mesenchymal stem cells alleviate LPS- induced acute lung injury in mice by MiR- 142a- 5p- controlled pulmonary endothelial cell autophagy〔J〕.Cell Physiol Biochem,2016;38(1):258- 66.
5 Standiford TJ,Ward PA.Therapeutic targeting of acute lung injury and acute respiratory distress syndrome〔J〕.Transl Res,2016;167(1):183- 91.
6 He X,Wei Z,Zhou E,etal.Baicalein attenuates inflammatory responses by suppressing TLR4 mediated NF- κB and MAPK signaling pathways in LPS- induced mastitis in mice〔J〕.Int Immunopharmacol,2015;28(1):470- 6.
7 Aratani Y,Miura N,Ohno N,etal.Role of neutrophil- derived reactive oxygen species in host defense and inflammation〔J〕.Med Mycol J,2012;53(2):123- 8.
8 Jennette JC,Falk RJ.Pathogenesis of antineutrophil cytoplasmic autoantibody- mediated disease〔J〕.Nat Rev Rheumatol,2014;10(8):463- 73.
9 Flint SM,McKinney EF,Smith KG.Emerging concepts in the pathogenesis of antineutrophil cytoplasmic antibody- associated vasculitis〔J〕.Curr Opin Rheumatol,2015;27(2):197- 203.
10 Ho E,Galougahi K,Liu CC,etal.Biological markers of oxidative stress:applications to cardiovascular research and practice〔J〕.Redox Biol,2013;1(10):483- 91.
11 Shibata N,Kobayashi M.The role for oxidative stress in neurodegenerative diseases〔J〕.Brain Nerve,2008;60(2):157- 70.
12 Dyson HJ,Komives EA.Role of disorder in IκB- NFκB interaction〔J〕.IUBMB Life,2012;64(6):499- 505.
〔2015- 12- 31修回〕
(编辑 曹梦园)
2015年中国博士后科学基金资助项目(2015M581308);天津市科学技术委员会重点项目(11ZCGYSY02000);天津市卫生局重点攻关项目(12KG106)
刘 刚(1972- ),男,医学硕士,主治医师,主要从事临床麻醉、疼痛诊疗和缓和医疗研究。
胡晓旻(1974- ),男,博士,副主任医师,主要从事心脏重症治疗与急救研究。
R563
A
1005- 9202(2017)15- 3664- 04;
10.3969/j.issn.1005- 9202.2017.15.010
1 北京军区总医院麻醉科 2 天津市胸科医院心内科
3 河北省巨鹿县医院麻醉科
