临床分离大肠埃希菌质粒介导喹诺酮耐药基因和β内酰胺酶基因检测
2017-06-05兰芳俊何清雯曹颖平
兰芳俊, 吴 娟, 何清雯, 曹颖平, 李 彬
临床分离大肠埃希菌质粒介导喹诺酮耐药基因和β内酰胺酶基因检测
兰芳俊1, 吴 娟2, 何清雯1, 曹颖平1, 李 彬1
目的 探讨大肠埃希菌临床分离株质粒介导喹诺酮耐药(PMQR)基因的流行情况,及其与 β 内酰胺酶基因相关性。方法 收集 2013 年 7-12 月福建医科大学附属协和医院临床分离的对左氧氟沙星和 /或环丙沙星耐药的大肠埃希菌200 株,采用 PCR 检测 qnrA、qnrB、qnrC、qnrD、qnrS、aac(6')-Ib-cr、qepA 和 oqxAB 基因,对 PMQR 基因阳性菌株扩增常见 β 内酰胺酶基因 ;采用琼脂稀释法对 PMQR 基因阳性菌株进行药敏试验,以及 PCR 法对菌株进行系统发育分型 ;利用肠杆菌基因重复一致序列分析(ERIC-PCR)进行菌株同源性分析。结果 PCR 扩增结果显示实验菌株 PMQR 阳性率为29.0%(58/200)。其中 qnr 阳性率为 5.5%(11/200),aac(6')-Ib-cr 阳性率为 20.5%(41/200),oqxAB 阳性率为 8.0%(16/200),qepA 阳性率为 0.5%(1/200)。58 株 PMQR 基因阳性菌株中 CTX-M-1 组 32 株(55.2%)、CTX-M-9 组 17 株(29.3%)和TEM 型 1 株(1.7%),未检出 SHV 型 β 内酰胺酶基因。PMQR 阳性菌呈现多重耐药现象 ;系统发育分型结果显示 A 型有21 株(36.2%),D 型 17 株(29.3%),B2 型 11 株(19.0% ),B1 型 9 株(15.5% )。ERIC-PCR 显示 PMQR 大肠埃希菌可分为 50 个不同的型别,其中 1 株未能分型。结论 该院大肠埃希菌中 PMQR 基因以 aac(6')-Ib-cr、qnr 和 oqxAB 为主,且与 β内酰胺酶耐药基因高度相关 ;此外PMQR 菌株以非克隆播散方式在该院中流行。
大肠埃希菌 ; 喹诺酮类耐药 ; 质粒介导喹诺酮耐药 ; β 内酰胺酶
氟喹诺酮类药物是目前临床治疗革兰阴性菌感染最常用的抗菌药物之一。随着该药临床上的广泛使用,其耐药性也不断增长。细菌对喹诺酮类的耐药主要是由染色体介导,包括药物靶位改变、膜渗透性改变和外排泵表达过度。质粒介导喹诺酮类耐药(PMQR)机制的存在使细菌更容易产生高水平的耐药[1]。目前 PMQR 基因包括 qnr、aac(6')-Ib-cr、qepA 和 oqxAB,其作用方式各不相同,均介导细菌对喹诺酮类抗菌药物的低水平耐药[2]。细菌耐药性的迅速增加,给临床抗感染治疗带来严峻的考验。本研究对临床分离的大肠埃希菌进行耐药状况和喹诺酮类耐药基因的调查,同时探讨 PMQR 基因与 β内酰胺酶基因之间的关系,旨在为临床合理选用抗菌药物提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集 2013 年 7-12 月福建医科大学附属协和医院临床分离的对左氧氟沙星和/或环丙沙星耐药的大肠埃希菌 200 株,剔除同一患者同一部位的重复菌株。所有菌株均使用 VITEK系统鉴定。质控菌株为大肠埃希菌 ATCC25922。
1.1.2 仪 器 与 试 剂 细 菌 鉴 定 仪 为 VITEK 2-Compact全自动微生物鉴定仪(法国生物梅里埃公司);PCR 扩增仪(美国 Applied Biosystems 公司);Universal Hood Ⅱ凝胶成像分析系统(美国BIO-RAD 公司)。PCR 扩增试剂为大连宝生物有限公司产品 ;100 bpDNA Maker、电泳用琼脂糖、Goodview 核酸染料购自铂尚生物技术(上海)有限公司。萘啶酸、四环素、头孢噻肟、头孢吡肟、庆大霉素、阿米卡星、左氧氟沙星、环丙沙星均购于中国药品生物制品检定所,亚胺培南为杭州默沙东制药有限公司产品。
1.2 方法
1.2.1 药物敏感性试验 采用琼脂稀释法检测药物对大肠埃希菌的 MIC,按美国临床与实验室标准化协会(CLSI)2014 版标准操作及判断结果。
1.2.2 PCR 扩增 PMQR 和 β 内酰胺酶基因 采用煮沸法提取细菌DNA模板。反应体系、引物序列见表1[3-12]。反应 条 件 为 94 ℃预变 性 5 min ;94 ℃变 性 30 s,55 ℃ 退 火 30 s,72 ℃ 延 伸 30 s, 共 30个循环,最后 72 ℃延伸 10 min。引物均由英潍捷基(上海)贸易有限公司合成。PCR 阳性产物均送铂尚生物技术(上海)有限公司进行测序,测序结果在 GenBank 中经 BLAST 程序分析比对。
1.2.3 系 统 发 育 分 型 基 因 检 测 多 重 PCR 对PMQR 基因阳性菌株扩增系统发育分型基因,包括 ChuA、YjaA、TspE4.C2;引物合成参照文献 [13]。1.2.4 菌 株 同 源 性 分 析 利 用 肠 杆 菌 科 基 因 重复一致序列分析(ERIC-PCR)对 PMQR 基因阳性菌 进行 同 源 性 分析。引 物序 列 为 ERIC-1 : 5'-ATGTAAGCTCCTGGGGATTCAC-3',ERIC-2 : 5'-AAGTAAGTGACTGGGGTGAGCG-3'。反应条件 :94 ℃ 预 变 性 5 min ;94 ℃ 变 性 1 min、26 ℃ 退 火1 min、72 ℃ 延 伸 1 min, 共 4 个 循 环 ;94 ℃ 变 性30 s、40 ℃退火 30 s、72 ℃延伸 1 min,共 40 个循环 ;最后 72 ℃延伸 10 min。PCR 产物 经 2% 琼脂糖凝胶电泳后观察结果,判断标准参考文献 [14]。
2 结果
2.1 PMQR 基因检测
200 株耐药大肠埃希菌中,检出 PMQR 基因阳 性 菌 58 株(29.0%)。 其 中 qnr 11 株(5.5%);aac(6')-Ib-cr 41 株(20.5%);oqxAB 16 株(8.0%);qepA 1 株(0.5%)。未检出 qnrA、qnrC 和 qnrD 基因。结果见表2。
2.2 β 内酰胺酶基因扩增
58 株 PMQR 阳性菌株中共有 45 株(77.6%)携 带 β 内 酰 胺 酶 基 因。5 株 携 带 CTX-M-1 组 和CTX-M-9 组 2 种 β 内酰胺酶基因。未检出 SHV、CTX-M-2 组基因。结果见表3。
2.3 药敏试验
58 株 PMQR 基因阳性菌株对萘啶酸耐药且耐药水平较高,对环丙沙星和左氧氟沙星耐药率分别为 96.6% 和 91.4% ;对四环素和庆大霉素的耐药率分别为 98.3% 和 88.0% ;对头孢菌素类抗生素敏感性不一,对头孢噻肟和头孢吡肟的耐药率分别为 82.8% 和 27.6% ;对阿米卡星和亚胺培南耐药率较低。结果见表4。
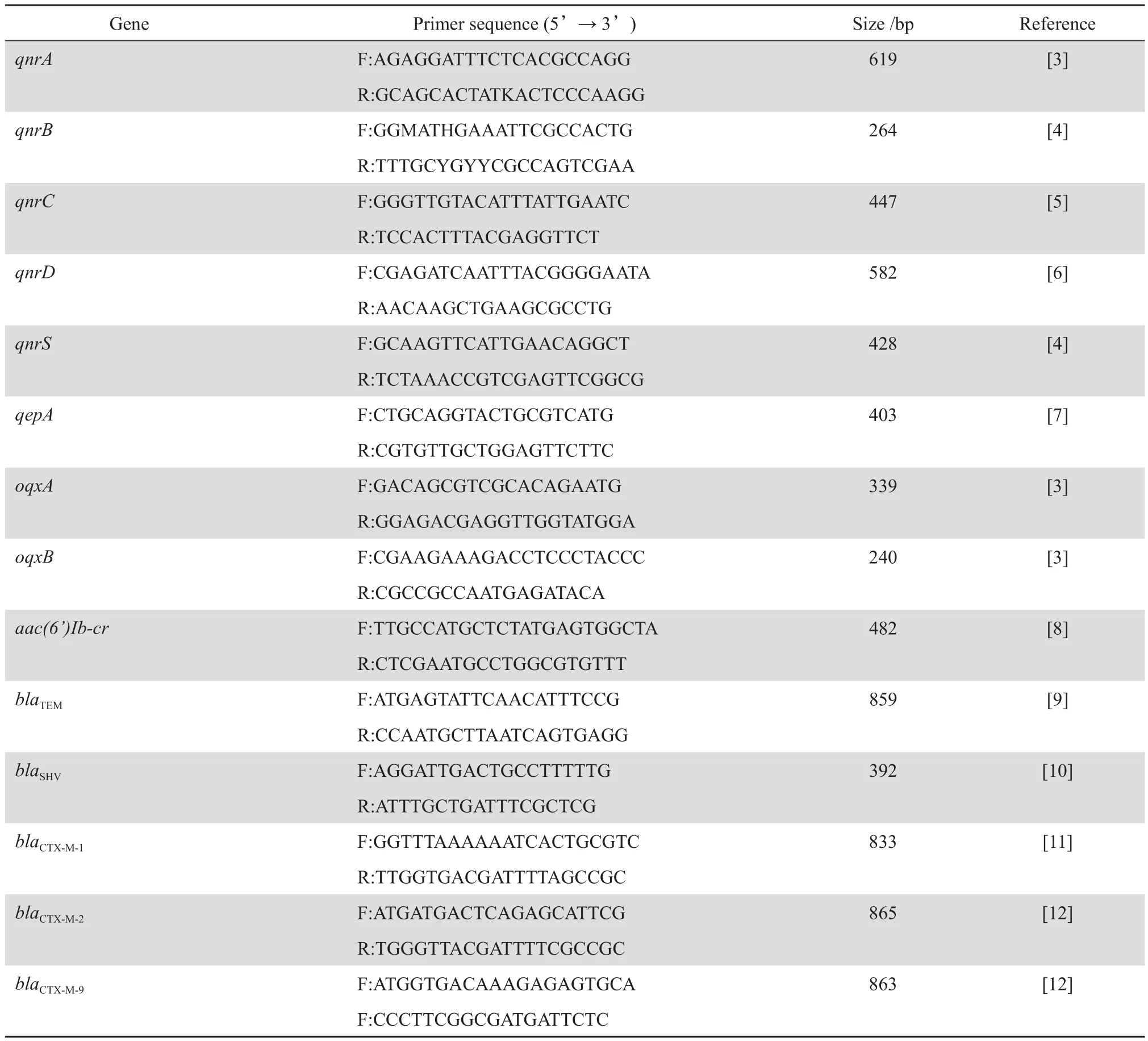
表1 PCR 扩增引物序列Table 1 Primer used for PCR ampli fi cation in this study
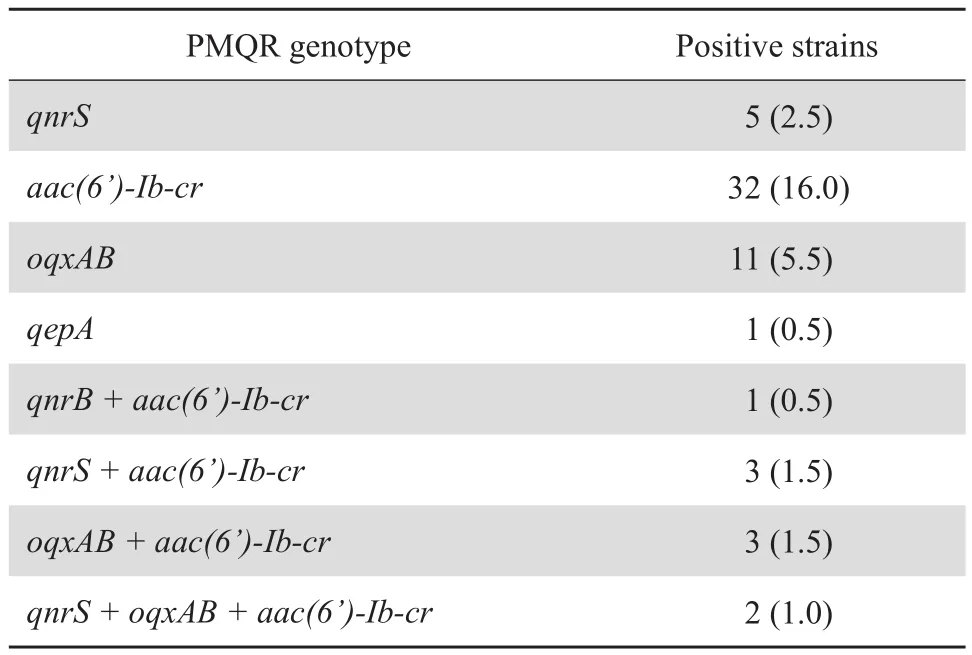
表2 200 株大肠埃希菌 PMQR 基因型分布Table 2 Prevalence of PMQR genotypes in the 200 strains of E. coli [ n ( % ) ]
2.4 系统发育分型
本次研究中,58 株 PMQR 基因阳性大肠埃希菌检出 A 型 21 株(36.2%),D 型 17 株(29.3%),B2 型 11 株(19.0%), B1 型 9 株(15.5%)。
2.5 菌株同源性
根据 ERIC-PCR 结果分析,58 株 PMQR 基因阳性大肠埃希菌可分为 50个不同的型别,另有 1株未能分型。
3 讨论
由于喹诺酮类药物抗菌谱广以及抗菌作用强,已经成为继头孢菌素类之后抗感染应用最广泛的抗菌药物。但随着喹诺酮类的广泛应用,导致细菌在药物选择性压力下,表现出对此类抗菌药物的耐药率越来越高。在 1998 年首次发现 PMQR 基因 qnr,随后新的 PMQR 基因及耐药机制不断被发现,包括 aac(6')-Ib-cr 基因、oqxAB 基因和 qepA基因。这些耐药基因虽引起细菌对喹诺酮类药物低水平耐药,但其与染色体编码的DNA旋转酶和拓朴异构酶Ⅳ的突变具有相关性,后者可造成高水平氟喹诺酮类耐药[15]。
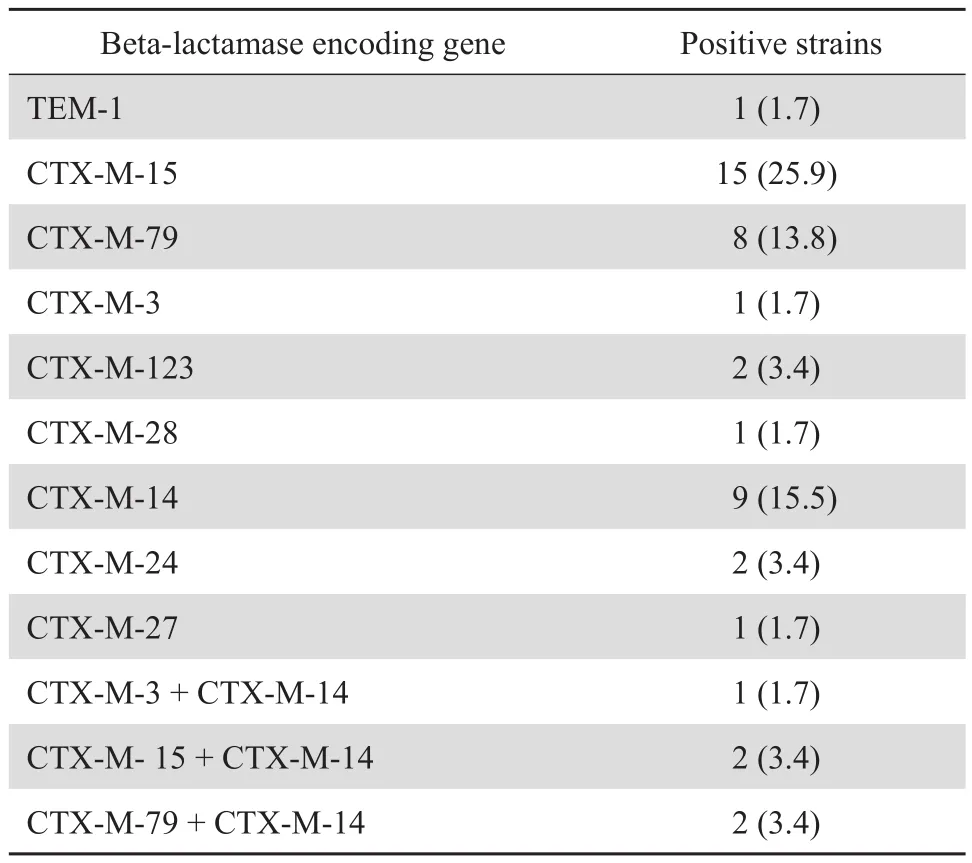
表3 58 株 PMQR 基因阳性菌株中 β 内酰胺酶基因的分布Table 3 Prevalence of β-lactamase encoding genes in the 58 PMQR-positive isolates [ n ( % ) ]
本研究显示PMQR基因阳性大肠埃希菌携带qnr 基因占 5.5%,低于黄丽等[16]的报道。aac(6')-Ib-cr 基因是本地区中为最常见的 PMQR 流行基因,检出率低于陈聪等[17]报道的检出率。还发现oqxAB 阳性菌株在本地区的流行中也占有较大的比例,与其他文献的报道相似[18-19]。本实验显示,PMQR 基因阳性菌株中β内酰胺酶的检出率达到77.6%,部分菌株携带 2 种或以上类型的 β 内酰胺酶基因。有研究表明PMQR 基因通常与 β 内酰胺酶基因共同存在于同一个质粒,并且能够共同传播[20-21]。PMQR 基因的高检出率及 PMQR 与 β 内酰胺酶基因的高共存率[22],表明两者在介导细菌耐药的进程中关系紧密。
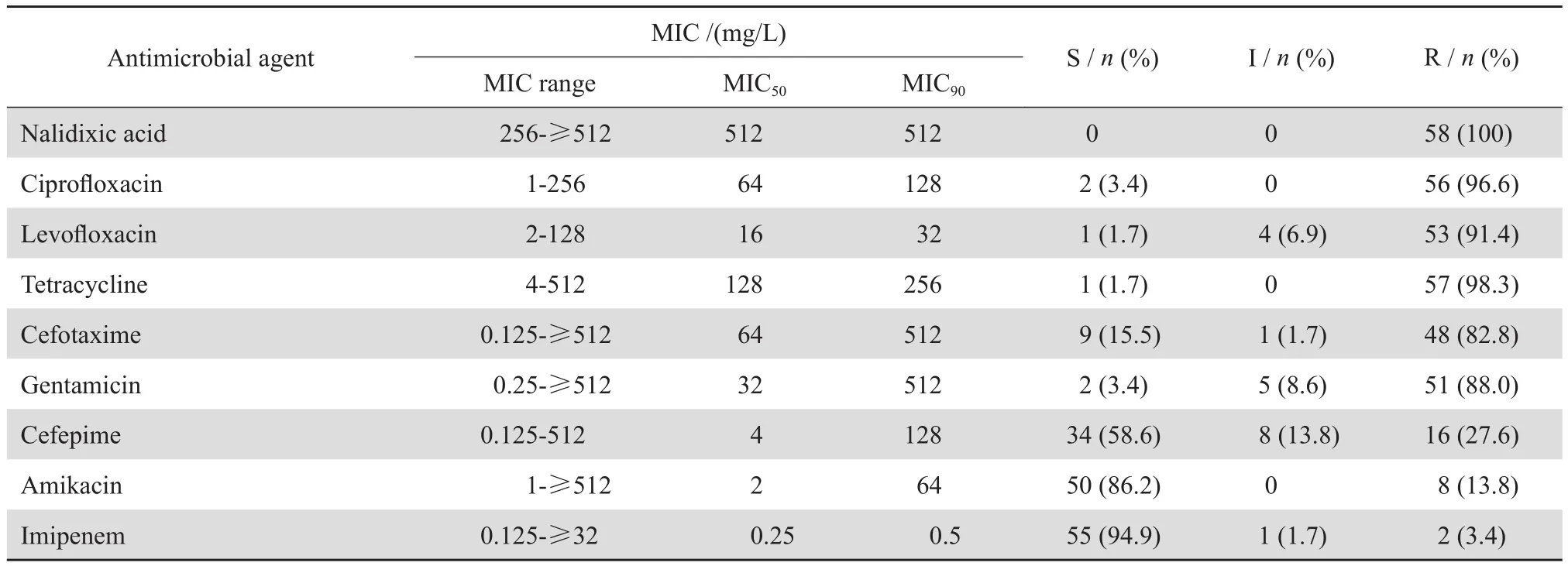
表4 58 株 PMQR 基因阳性菌株对 9 种抗菌药物的药敏结果Table 4 Antimicrobial susceptibility of the 58 PMQR-positive strains to 9 antimicrobial agents
大肠埃希菌肠外致病株毒力最强的是B2型,其次是 D 型,A 型和 B1 型主要为共生菌[23]。张嵘等[24]对杭州地区的研究表明 D 型为主要部分。Zhao 等[25]对苏州地区的研究表明所占比例最高的为 B2 型,其次为 D 型。本研究显示 A 型(36.2%)为主,D型次之,与其他研究报道有一定的差别,其原因可能为菌株来源的差别,如本研究中收集的喹诺酮类耐药菌株等。ERIC-PCR 检测未发现明显的优势克隆,推测本院PMQR基因阳性菌株为非克隆性传播。
综上,本院大肠埃希菌中喹诺酮类耐药基因主 要 为 aac(6')-Ib-cr、qnr 和 oqxAB, 且 与 β 内 酰胺酶耐药基因高度相关 ;此外 PMQR 基因阳性菌株以非克隆播散方式在本院中流行。PMQR 介导的耐药往往是低水平的,但这些耐药基因的存在有利于使菌株对喹诺酮类药物产生高水平的耐药,从而给临床带来严重的危害。PMQR 基因能够在不同细菌中通过水平传播并导致更大范围的流行。因此医疗机构应采取有效措施控制抗菌药物的滥用,以防止多重耐药菌株的产生及广泛播散,同时加强对PMQR基因流行情况的监测与防控。
[1] 毕超,蒋岗,余广超,等 . 质粒介导的大肠埃希菌对喹诺酮类抗菌药物耐药机制的研究 [J]. 中国医院感染学杂志,2011,21 (18):3755-3758.
[2] BRIALES A, RODRIGUEZ-MARTINEZ JM, VELASCO C, et al. In vitro effect of qnrA1, qnrB1, and qnrS1 genes on fluoroquinolone activity against isogenic Escherichia coli isolates with mutations ingyrA and parC [J]. Antimicrob Agents Chemother, 2011, 55(3): 1266-1269.
[3] CHEN X, ZHANG W, PAN W, et al. Prevalence of qnr, aac(6')-Ib-cr, qepA, and oqxAB in Escherichia coli isolates from humans, animals, and the environment [J]. Antimicrob Agents Chemother, 2012, 56(6): 3423-3427.
[4] CATTOIR V, POIREL L, ROTIMI V, et al. Multiplex PCR for detection of plasmid-mediated quinolone resistance qnr genes in ESBL-producing enterobacterial isolates [J]. J Antimicrob Chemother, 2007, 60(2): 394-397.
[5] WANG M, GUO Q, XU X, et al. New plasmid-mediated quinolone resistance gene, qnrC, found in a clinical isolate of Proteus mirabilis [J]. Antimicrob Agents Chemother, 2009, 53(5): 1892-1897.
[6] CAVACO LM, HASMAN H, XIA S, et al. qnrD, a novel gene conferring transferable quinolone resistance in Salmonella enteric serovar Kentucky and Bovismorbif i cans strains of human origin [J]. Antimicrob Agents Chemother, 2009, 53(2): 603-608.
[7] CATTOIR V, POIREL L, NORDMANN P. Plasmid-mediated quinolone resistance pump QepA2 in an Escherichia coli isolate from France [J]. Antimicrob Agents Chemother, 2008, 52(10):3801-3804.
[8] PARK CH, ROBICSEK A, JACOBY GA, et al. Prevalence in the United States of aac(6')-Ib-cr encoding a ciprof l oxacinmodifying enzyme [J]. Antimicrob Agents Chemother, 2006, 50(11): 3953-3955.
[9] TONKIC M, MOHAR B, SISKO-KRALJEVIC K, et al. High prevalence and molecular characterization of extended-spectrum beta-lactamase-producing Proteus mirabilis strains in southern Croatia [J]. J Med Microbiol, 2010, 59(Pt 10): 1185-1190.
[10] BHATTACHARJEE A, SEN MR, PRAKASH P, et al. Role of beta-lactamase inhibitors in enterobacterial isolates producing extended-spectrum beta-lactamases [J]. J Antimicrob Chemother,2008, 61(2): 309-314.
[11] PARK YJ, LEE S, KIM YR, et al. Occurrence of extendedspectrum (beta)-lactamases and plasmid-mediated AmpC(beta)-lactamases among Korean isolates of Proteus mirabilis[J]. J Antimicrob Chemother, 2006, 57(1): 156-158.
[12] GARREC H, DRIEUX-ROUZET L, GOLMARD JL, et al. Comparison of nine phenotypic methods for detection of extendedspectrum beta-lactamase production by Enterobacteriaceae[J]. J lin Microbiol, 2011, 49(3): 1048-1057.
[13] MOULIN-SCHOULEUR M, REPERANT M,LAURENT S,et al. Extraintestinal pathogenic Escherichia coli strains of avian and human origin:link between phylogenetic relationship and common virulence patterns[J]. J Clin Microbial,2007,45(10):3366-3379.
[14] VERSALOVIC J,KOEUTH T,LUPSKI JR. Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes[J]. Nucleic Acids Res,1991,19(24):6823-6831.
[15] MACHUCA J, BRIALES A, LABRADOR G, et al. Interplay between plasmid-mediated and chromosomal-mediated fluoroquinolone resistance and bacterial fitness in Escherichia coli [J]. J Antimicrob Chemother, 2014, 69(12): 3203-3215.
[16] 黄丽,高晓坤,张宏 . 肠杆菌科细菌质粒介导喹诺酮类耐药基因的检测 [J]. 中国感染与化疗杂志,2014,14(4):286-290.
[17] 陈聪,叶英,江洋,等 . 安徽地区 PMQR 基因阳性大肠埃希菌和肺炎克雷伯菌中 ESBLs 流行特征的研究 [J].中国抗生素杂志, 2013, 38(3): 239-244.
[18] 李瑞华,刘亮,聂大平,等 . oqxAB 基因在大肠埃希菌和肺炎克雷伯菌中的流行及传播 [J].中国感染与化疗杂志,2013,13 (6):456-459.
[19] YUAN J, XU X,GUO Q, et al. Prevalence of the oqxAB gene complex in Klebsiella pneumonia and Escherichia coli clinical isolates [J]. J Antimicrob Chemother, 2012, 67(7):1655-1659.
[20] BRIALESA, RODRIGUES-MARTINEZ JM, VELASCO C, et al. Prevalence of plasmid-mediated quinolone resistance determinant sqnr and aac(6')-Ib-cr in Escherichia coli and Klebsiella pneumonia producing extended-spectrum β-lactamases in Spain[J]. Int J Antimicrob Agents, 2012,39(5): 431-434.
[21] ALOUACHE S, ESTEPA V, MESSAI Y,et al. Characterization of ESBLs and associated quinolone resistance in Escherichia coli and Klebsiella pneumoniae isolates from an urban wastewater treatment plant in Algeria [J]. Microb Drug Resist, 2014, 20(1):30-38.
[22] FERJANI S, SAIDANI M, AMINE FS, et al. Prevalence and characterization of plasmid-mediated quinolone resistance genes in extended-spectrum β-lactamase-producing Enterobacteriaceae in a Tunisian hospital[J]. Microb Drug Resist, 2015, 21(2):158-166.
[23] PITOUT JD. Extraintestinal pathogenic Escherichia coli: an update on antimicrobial resistance, laboratory diagnosis and treatment [J]. Expert Rev Anti Infect Ther, 2012,10(10):1165-1176.
[24] 张嵘, 池丹, 蔡加昌, 等 . 大肠埃希菌对碳青霉烯类抗生素的耐药机制及分子分型 [J]. 中华微生物学和免疫学杂志,2014,34( 4 ): 256-263.
[25] ZHAO R, SHI J, SHEN Y, et al. Phylogenetic distribution of virulence genes among ESBL-producing uropathogenic Escherichia coli isolated from long-term hospitalized patients [J]. J Clin Diagn Res, 2015, 9(7): DC01-DC04.
Survey on the genes conferring plasmid-mediated quinolone resistance and those encoding β-lactamases in Escherichia coli isolates
LAN Fangjun, WU Juan, HE Qingwen, CAO Yingping, LI Bin.
(Department of Laboratory Medicine, Fujian Medical University Union Hospital, Fuzhou 350001, China)
Objective To examine the prevalence of plasmid mediated quinolone resistance (PMQR) genes and their correlation with the genes encoding β-lactamases in E. coli isolates. Methods A total of 200 levof l oxacin- and/or ciprof l oxacin-resistant E. coli isolates were collected from Fujian Medical University Union Hospital during the period from July to December 2013. PCR method was used to screen these E. coli isolates for the presence of qnrA, qnrB, qnrC, qnrD, qnrS, aac(6’)-Ib-cr, qepA, oqxAB genes, and the blaTEM, blaSHVand blaCTX-Mgenes in the PMQR positive strains. Agar dilution method was utilized to measure the antimicrobial susceptibility of PMQR-positive strains. Phylogenetic analysis was conducted by triplex PCR. Enterobacterial repetitive intergenic consensus-polymerase chain reaction (ERIC-PCR) was used to evaluate the genetic similarity between the PMQR-positive isolates. Results Of the 200 clinical isolates of E. coli, 58 (29.0%) were PMQR-positive. And qnr, aac(6’)-Ib-cr, oqxAB, and qepA genes were positive in 11 (5.5%), 41 (20.5%), 16 (8.0%), 1 (0.5%) strains, respectively. The genes encoding CTX-M-1, CTX-M-9 and TEM type enzymes was positive in 32 (55.2%), 17 (29.3%), and 1 (1.7%) of the PMQR-positive strains, respectively. The blaSHVgene was not identif i ed in any isolate. PMQR-positive strains were multi-drug resistant. Phylogenetic analysis indicated that 21 (36.2%), 17 (29.3%), 11 (19.0%), and9 (15.5%) of the PMQR-positive strains belonged to group A, group D, group B2 and group B1, respectively. ERIC-PCR suggested the PMQR-positive isolates belonged to 50 different types. Only one strain was non-typeable. Conclusions Most of the PMQR-related genes in E. coli are aac(6’)-Ib-cr, qnr, and oqxAB in our hospital, which are highly relevant to β-lactamase genes. PMQR-positive strains may spread by way of non-clonal dissemination in our hospital.
Escherichia coli; quinolone resistance; plasmid mediated quinolone resistance; β-lactamase
R378.21
:A
:1009-7708 ( 2017 ) 03-0293-05
10.16718/j.1009-7708.2017.03.013
2016-09-06
2016-10-17
国家自然科学基金(81201328);福建省高校杰青项目(JA13134);福建省卫计委中青年骨干人才培养项目(2015-ZQN-ZD-15)。
1. 福建医科大学附属协和医院检验科,福州 350001;2. 福建医科大学医学与技术工程学院。
兰芳俊(1992—),男,硕士研究生,主要从事细菌耐药机制研究。
李彬,E-mail:leonlee307@hotmail.com。
