小熊猫感染肺炎克雷伯氏菌的检查及药敏试验
2017-04-19文继锋龚永平王承东邓林华颜其贵
杨 锐,文继锋,龚永平,王承东,邓林华,黄 杰,任 露,颜其贵
小熊猫感染肺炎克雷伯氏菌的检查及药敏试验
杨 锐1,文继锋1,龚永平1,王承东2,邓林华2,黄 杰1,任 露1,颜其贵1
目的 为确诊导致一只6岁左右的雌性小熊猫死亡的病因。方法 无菌采集死亡小熊猫的心、肝、脾、肺等样品并进行病原学检查。通过对多个内脏样本进行细菌平行分离鉴定(形态特征、生化特性和16S rDNA分析),对分离得到的一株优势菌(R1)进行小鼠人工感染及药敏试验。结果 R1被鉴定为肺炎克雷伯氏菌,且未检测到别的细菌;R1对小鼠具有较强致病力,LD50为6.5×104CFU/mL,且死亡小鼠与该小熊猫具有一致临床表现和病理剖解症状;R1对头孢噻肟等药物敏感,对丁胺卡那等药物敏感性为中介,对青霉素等耐药。结论 该小熊猫死于肺炎克雷伯氏菌感染。该菌对青霉素类抗生素耐药较强,且耐药谱较广,对大环内酯类、多肽类抗生素均有耐受作用,对头孢菌素类和氨基糖苷类抗生素敏感。
小熊猫;肺炎克雷伯氏菌;16S rDNA;LD50;药敏试验
小熊猫(Ailurusfulgens)又名红熊猫、小猫熊,为国家Ⅱ级重点保护动物[1]。小熊猫的食性较杂,除了竹简以外,也吃其他几种野果、野菜、根茎、青草[2];小熊猫在分类、生态学等领域具有十分重要的研究价值,也是动物园里具有很高观赏价值的一种野生动物[3]。某动物养殖基地中一只6岁左右的雌性小熊猫与另外3只小熊猫共养。刚开始发病时,发现该小熊猫出现精神沉郁、腹围增大,并且靠近尾根处有类似咬伤的伤口等症状。该小熊猫死亡后,剖解发现有化脓灶、胸腔积液、心包积液、肝脏有坏死灶等病变。为确诊该小熊猫死亡的原因,对采集的样本进行微生物学检查。
1 材料与方法
1.1 病料 对该死亡小熊猫进行剖解,无菌采取心脏、肝脏、脾脏、肺脏、心包液、腹水及创伤部位样品。
1.2 培养基与试剂 MH营养琼脂、兔鲜血、琼脂粉;病毒DNA提取试剂盒、病毒RNA提取试剂盒、细菌基因组DNA提取试剂盒均购自北京天根生化科技有限公司;生化及药敏试验的材料参照文献[4]使用。
1.3 实验动物 健康昆明小白鼠购自简阳达硕动物科技有限公司,共60只,规格为19-21 g/只。
1.4 主要病毒病的诊断 分别利用病毒DNA提取试剂盒、病毒RNA提取试剂盒对无菌采集的小熊猫肝脏进行DNA和RNA的提取,按照郭玲等的检测方法[5-6]进行犬细小病毒(CPV)和犬瘟热病毒(CDV)的检测。
1.5 细菌分离鉴定 将无菌采取的心脏、肝脏、脾脏、肺脏等组织分别接种于MH固体培养基和含5%的兔鲜血固体培养基,在37 ℃恒温箱培养18~24 h,观察细菌的生长情况,并挑取单个菌落进行革兰氏染色镜检,观察细菌的菌体形态及染色特征;分离纯化后,将纯化的细菌接种于MH液体培养基中进行培养,得到扩大培养的菌液。对分离纯化的细菌参照《常见细菌系统鉴定手册》[7]进行系统的理化特性测定。引物设计参照文献进行[8],由上海英骏生物技术有限公司合成。按照文献中[9]方法对分离纯化细菌进行16S rDNA序列测定分析。
1.6 人工感染小鼠试验 鉴定多个组织共有的菌株命名为R1。将R1菌株培养物用0.9% 生理盐水稀释制成菌悬液备用,在预实验的基础上,采用微量点样法[10]对菌落计数并调整菌悬液浓度至8.2×108、8.2×107、8.2×106、8.2×105、8.2×104CFU/mL,以0.2 mL/只剂量腹腔注射小鼠,对照组小鼠以0.2 mL/只剂量腹腔注射无菌0.9% 生理盐水,每组5只。在接种后每隔6 h观察1次,连续观察两周。记录小鼠的临床表现,对死亡小鼠进行剖解,观察并记录各组织器官病变;从死亡小鼠肺脏再次分离细菌,并进行鉴定。
1.7 药敏试验 选用22种抗生素药敏纸片,参照文献[11]操作及标准对R1进行药敏试验并判定结果。
2 结 果
2.1 病毒诊断 抽提血液组织的总RNA 和DNA,采用CPV与CDV的特异性引物经RT-PCR和PCR扩增反应后,将其扩增产物进行琼脂糖凝胶电泳,电泳结果未出现各自预期的特异性条带,判定该小熊猫未感染CPV和CDV。
2.2 细菌分离镜检 心脏、肝脏、脾脏、肺脏、心包液及创伤部位样品经划线平板培养基并培养后中均有大量细菌生长,每个平板上具有相似的菌落出现且为优势菌落,将优势菌株命名为R1。对R1优势菌落进行分离纯化后镜检,菌体形态一致。该菌在MH固体培养基上生长为圆形、微凸、表面光滑、边缘整齐、白色菌落,直径2~3 mm;在含兔血清的MH固体培养基上不产生溶血环,菌落呈白色,圆形、微凸,边缘光滑,直径2~4 mm。革兰氏染色镜检为革兰氏阴性粗短杆菌,无鞭毛和芽孢,呈单个或成对存在。
2.3 生化试验 将各个组织中分离出来的共同菌R1株进行生化鉴定,该菌株理化特性见表1。
表1 分离优势菌株R1的生理生化特性
Tab.1 Biochemical and physiological characteristics of the R1 isolate
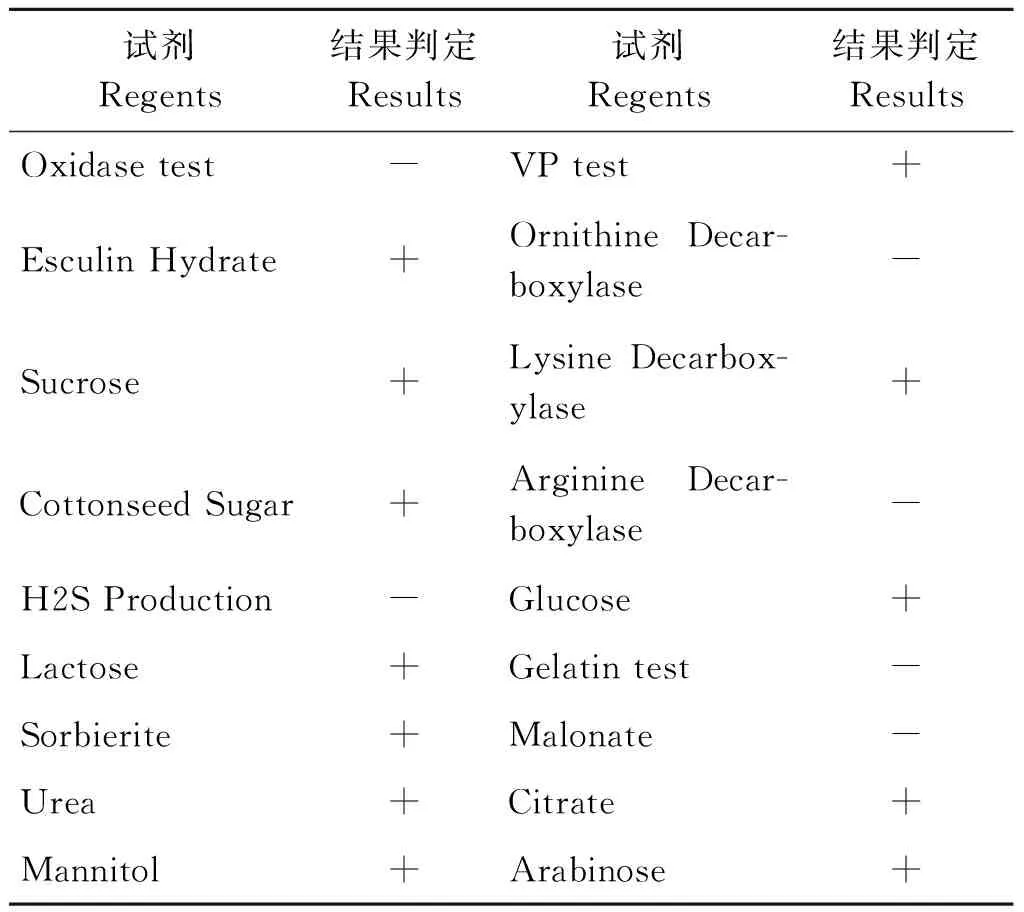
试剂Regents结果判定Results试剂Regents结果判定ResultsOxidasetest-VPtest+EsculinHydrate+OrnithineDecar-boxylase-Sucrose+LysineDecarbox-ylase+CottonseedSugar+ArginineDecar-boxylase-H2SProduction-Glucose+Lactose+Gelatintest-Sorbierite+Malonate-Urea+Citrate+Mannitol+Arabinose+
注:“+”阳性;“-”阴性
Note:“+”Positive;“-”Negative
通过查阅《伯杰氏细菌鉴定手册》可以看出,所分离的共同细菌与肺炎克雷伯氏菌的生化特性相符合,判定为肺炎克雷伯氏菌,命名为R1株。
2.4 分子生物学鉴定 将提取的R1菌株DNA进行16S rDNA-PCR扩增、测序、BLAST分析,结果表明:R1菌株16S rDNA基因序列与肺炎克雷伯氏菌(GenBank登陆号:CP016811.1) 的同源性达100%。
2.5 人工感染小鼠试验 R1菌株对小鼠的致病性结果见表2。接种细菌后小鼠出现精神萎靡,呼吸困难,眼角粘性分泌物多等临床症状。剖解后发现腹腔有胶冻样积液,肠道严重臌气,肺有实变和充血,肝边缘坏死等病理变化,与死亡小熊猫表现一致,对照小鼠表现正常,并且从死亡小鼠肺脏中分离到的菌株经过鉴定与R1菌株一致。试验显示该分离株对小鼠具有较强致病力,依改良寇氏法计算其半致死剂量LD50,即logLD50=Xk-i(∑p-0.5),其中Xk为最大剂量的对数,∑p为死亡率的总计,i为剂量对数的间距[4]。计算出其LD50为6.5×104CFU/mL。
表2 R1菌株对小鼠的致病力
Tab.2 Pathogenicity of R1 isolate to mice

细菌浓度Concentration(CFU/mL)8.2×1088.2×1078.2×1068.2×1058.2×104ControlLD50死亡率DeathNo./TestNo.5/55/55/54/54/50/56.5×104CFU/mL
2.6 药敏试验 药敏实验结果见表3。结果表明,R1菌对头孢噻肟、头孢他啶、头孢拉定、磺胺异噁唑、复方新诺明、诺氟沙星、多黏菌素B、环丙沙星等敏感;对丁胺卡那、卡那霉素、头孢氨苄、新霉素的敏感性为中介;对青霉素、红霉素、氨苄西林、利福平等不敏感。这表明,R1菌株对头孢菌素类、喹诺酮类、四环素类等抗生素敏感;对氨基糖苷类等抗生素的敏感性为中介;对β-内酰胺类、大环内酯类、多肽类等抗生素耐药,即R1菌株对三类以上抗生素耐药。
3 讨 论
基于R1菌株的形态特征、培养特性、生化特性和16S rDNA序列分析,依据参考文献[12-14],确定该分离病原菌为肺炎克雷伯氏菌(K.pneumonia)。参照相关文献[15],选择其敏感实验动物小鼠进行人工感染试验,确定出肺炎克雷伯氏菌感染为此次小熊猫死亡的原因。通过人工感染小鼠实验发现,分离鉴定出的肺炎克雷伯氏菌对小鼠有较强致病力,经计算得出其LD50为6.5×104CFU/mL。肺炎克雷伯氏菌在人类和其他哺乳动物体内腐生,定植胃肠道,皮肤和鼻咽;也在土壤、水等各种环境中有发现[16]。肺炎克雷伯氏菌为条件致病菌,当机体抵抗力降低时容易引起发病甚至死亡,可引起急性人畜共患传染病。该病常发生于猪、牛、羊、鸡、鸭等多种家畜、家禽及野生动物,已有很多相关报道肺炎克雷伯氏菌对大熊猫、白颊长臂猿、扭角羚等野生动物的感染并致死[17-19]。对于一些珍稀的野生动物,更应加强防范感染该菌,以至于能够减少甚至避免人与野生动物对肺炎克雷伯氏菌的感染。
表3 R1菌株的药敏试验
Tab.3 Antibiotic sensitivity test of the R1 strain
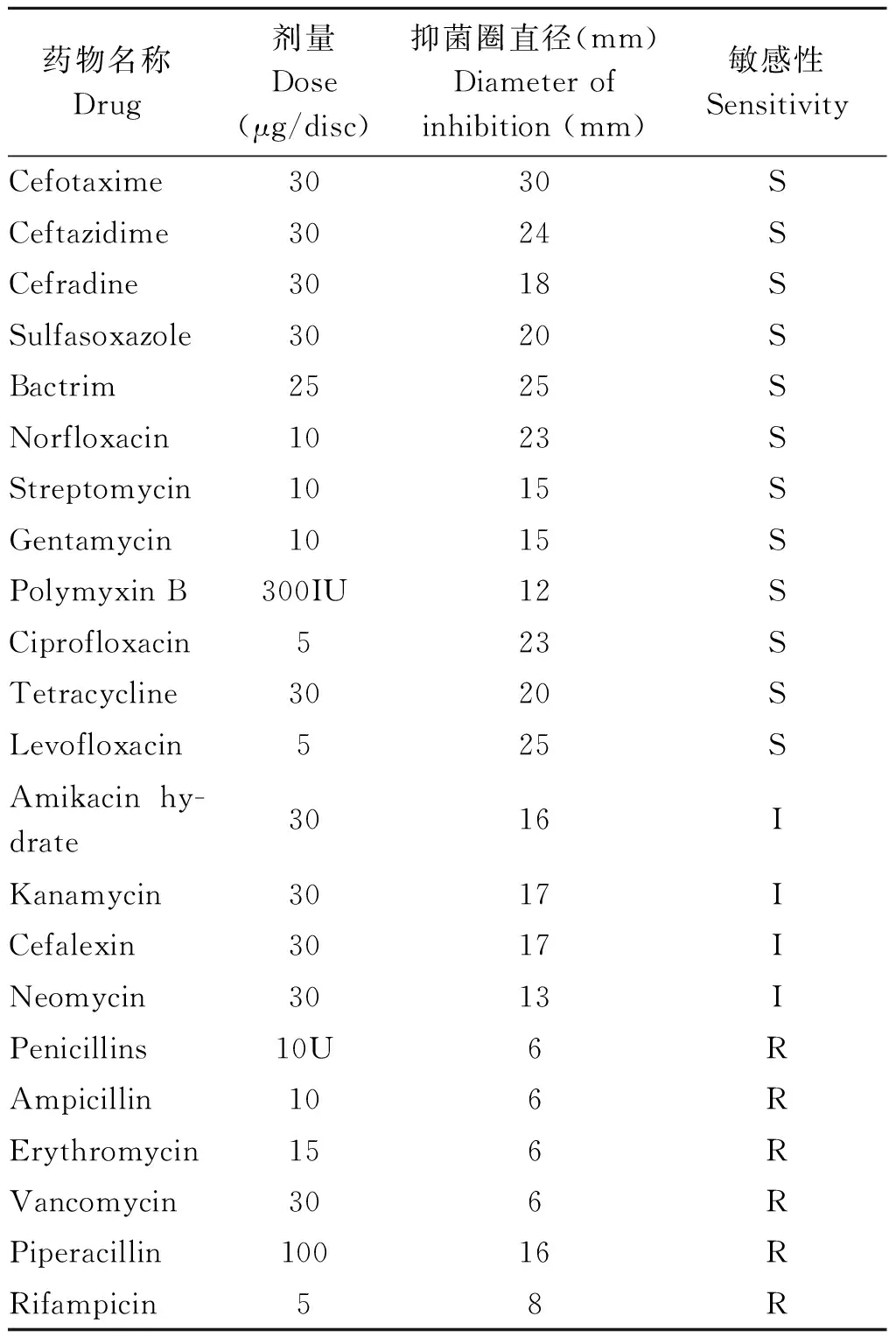
药物名称Drug剂量Dose(μg/disc)抑菌圈直径(mm)Diameterofinhibition(mm)敏感性SensitivityCefotaxime3030SCeftazidime3024SCefradine3018SSulfasoxazole3020SBactrim2525SNorfloxacin1023SStreptomycin1015SGentamycin1015SPolymyxinB300IU12SCiprofloxacin523STetracycline3020SLevofloxacin525SAmikacinhy-drate3016IKanamycin3017ICefalexin3017INeomycin3013IPenicillins10U6RAmpicillin106RErythromycin156RVancomycin306RPiperacillin10016RRifampicin58R
注: “S” 敏感;“ I” 中介;“R” 耐药
Notes:“S” High sensitivity;“ I” Moderate sensitivity;“R” Resistance
肺炎克雷伯氏菌是重要的医院感染及免疫缺陷者感染的致病菌,它作为一种条件致病菌所导致的感染在细菌感染性疾病中的比重日渐增加。肺炎克雷伯氏菌对人也造成严重的感染,主要感染肺部与肠道,经研究报道[20],肺炎克雷伯氏菌感染人肺部并且引起智力障碍。药敏结果显示对β-内酰胺类抗生素耐药较强,这可能与大量使用抗生素比如青霉素的结果有关,致使耐药性日趋加强,同时,药敏试验结果也发现对肺炎克雷伯氏菌耐受的抗生素药物类型较多,即其耐药谱越来越广泛,这对于动物及人都有较大的危险性,因此对于肺炎克雷伯氏菌感染的机体要慎重用药,而不是滥用抗生素。从20世纪90年代以来,一直关注研究临床上肺炎克雷伯氏菌耐药谱变化并已发生显著变化。研究表明[21-22],肺炎克雷伯氏菌已成为革兰氏阴性菌中存在多重耐药机制的代表菌,其耐药率也在不断上升。耐药性对肺炎克雷伯氏菌造成不当的经验性抗生素治疗[23],因此,在防治疫病时,因根据药敏试验的结果选择最佳药物进行治疗。
近年来研究表明肺炎克雷伯氏菌是致病力较强的人兽共患细菌,因此应加强对该菌的防治以免造成对人及动物的更大危害。对于其耐药性的研究也相对较多,对于肺炎克雷伯氏菌的预防,建议临床上最好选用对该菌敏感性高的药物,避免滥用抗生素导致病原菌对更多药物产生的耐药性。从本试验结果看来,肺炎克雷伯氏菌对小鼠的致病力很强,耐药谱较广,为小熊猫健康养殖生产和对预防肺炎克雷伯氏菌病提供一定的参考价值。
[1] Jia LL,Jiang CL,Wang MY, et al. Rearing and reproduction of captive pandas[J]. Agr Development Equipments, 2013, (5): 115-115. (in Chinese)
贾琳琳, 姜春林, 王铭愉, 等. 圈养小熊猫的饲养与繁殖[J]. 农业开发与装备, 2013(5): 115-115.
[2] Tan BJ.AiluropodamelanoleucaandAilurusfulgens[J]. Popular Sci: Sci Education, 1955, (10): 413-414. (in Chinese)
谭邦杰. 大熊猫和小熊猫[J]. 科学大众: 科学教育, 1955(10): 413-414.
[3] Wang XJ. Diseases of red panda(Ailurusfulgens)[J]. Chin J Wildlife, 2007, 28(5): 8-11. (in Chinese)
王兴金. 圈养小熊猫的疾病[J]. 野生动物学报, 2007, 28(5): 8-11.
[4] Xi N, Han J, Wu L. The pathogenicity ofShigellaisolates with different virulence genotypes demonstrated in Lanzhou city[J]. Chin J Zoonoses, 2009, 25(3): 273-275. (in Chinese)
郗宁, 韩俭, 吴玲. 兰州市不同毒力基因型志贺菌致病力研究[J]. 中国人兽共患病学报, 2009, 25(3): 273-275.
[5] Guo L, Wan L, Ma L, et al. Establishment of RT-PCR method or the detection of canine distemper virus[J]. Chin Vet Sci, 2012, 42(2): 166-170. (in Chinese)
郭玲, 万莉, 马磊, 等. 犬瘟热病毒RT-PCR检测方法的建立[J]. 中国兽医科学, 2012, 42(2): 166-170.
[6] Guo L, Yang SL, Zhang ZH, et al. Establishment of PCR for detection of canine parvovirus and investigation into giant pandas[J]. Chin Vet Sci, 2013, 33(8): 1201-1205. (in Chinese)
郭玲, 杨绍林, 张志和, 等. 犬细小病毒PCR诊断方法的建立及对大熊猫粪便的检测[J]. 中国兽医学报, 2013, 33(8): 1201-1205.
[7] Cai MY, Dong XZ. Manual of common bacterial system identification[M]. Beijing: Science Press, 2001. (in Chinese)
蔡妙英,东秀珠.常见细菌系统鉴定手册[M]. 科学出版社, 2001.
[8] Greisen K, Loeffelholz M, Purohit A, et al. PCR primers and probes for the 16S rRNA gene of most species of pathogenic bacteria, including bacteria found in cerebrospinal fluid[J]. J Clin Microbiol, 1994, 32(2): 335-351.
[9] Ali A, Hameed S, Oresnik IJ, et al. An improved method for bacterial identification through 16S rDNA sequencing using double set of primers: a case study[J]. Pakistan J Agr Sci, 2015, 52(2): 285-291.
[10] Wu YH, Li ZH, Tan SH. A simple and accurate method for enumeration of viable bacteria[J]. Biotechnology, 2013, 23(2): 65-69. (in Chinese)
吴窈画, 李正华, 谈书华. 一种简单准确的微生物活菌计数方法[J]. 生物技术, 2013, 23(2): 65-69.
[11] Hombach M, Bloemberg GV, Böttger EC. Effects of clinical breakpoint changes in CLSI guidelines 2010/2011 and EUCAST guidelines 2011 on antibiotic susceptibility, test reporting of Gram-negative bacilli[J]. J Antimicrob Chemoth, 2012, 67(3):622-632. DOI: 10.1093/jac/dkr524
[12] Ma Lei, Yan QG, Wan L, et al. Isolation and identification onK.peneumoniaeinRhizomys[J]. Chin J Zoonoses, 2011, 27(9): 825-827. (in Chinese)
马磊, 颜其贵, 万莉, 等. 竹鼠肺炎克雷伯氏菌的分离鉴定[J]. 中国人兽共患病学报, 2011, 27(9): 825-827.
[13] Lu CP. Veterinary microbiology[M]. Beijing: China Agriculture Press, 2012. (in Chinese)
陆承平. 兽医微生物学[M]. 中国农业出版社, 2012.
[14] Bu KN. Bergey’s manual of systematic bacteriology[M]. Beijing: Science Press, 1984. (in Chinese)
布坎南. 伯杰细菌鉴定手册[M]. 科学出版社, 1984.
[15] Zhang CL, Zhu FB, Zhang JG, et al. Study on the pathogenicity ofKlebsiellapneumoniaeto giant panda[J]. Chin Vet Sci, 1997, 27(4): 40-41. (in Chinese)
张成林,朱飞兵,张金国,等.克雷伯氏菌对大熊猫的致病性探讨[J].中国兽医科学,1997, 27(4):40-41.
[16] Bagley ST. Habitat association ofKlebsiellaspecies[J]. Infect Ctrl, 1985, 6(2): 52-58.
[17] Peng GN, Xiong Y. The studying status quo on the pandaKlebsicllapneumoniae[J]. Sichuan Anim Vet Sci, 2000, 27(s1): 86-87. (in Chinese)
彭广能, 熊焰. 大熊猫肺炎克雷伯氏菌的研究现状[J]. 四川畜牧兽医, 2000, 27(s1): 86-87.
[18] Liu Y, Zhao J, Zhang CL, et al. Mortality inHylobatescaused byKlebsiellapneumoniae[J]. Chin J Wildlife, 2011, 32(3): 156-157. (in Chinese)
刘燕, 赵京, 张成林,等. 肺炎克雷伯氏菌致白颊长臂猿脓肿一例[J]. 野生动物学报, 2011, 32(3): 156-157.
[19] Hao ZX, Liao H, Liu D, et al. Isolation and Identification ofK.pneumoniaein Takin[J]. China Anim Husb Vet Med, 2015, 42(1): 203-208. (in Chinese)
郝中香, 廖红, 刘丹, 等. 扭角羚肺炎克雷伯氏菌的分离鉴定[J]. 中国畜牧兽医, 2015, 42(1): 203-208.
[20] Ballesteros A, Montes L,Jaimes W,et al. A case of catatonia,Klebsiellapneumoniaelung infection and intellectual disability: Differential diagnosis[J]. EuropPsychiatry, 2016, 33(Suppl): S474-S475. DOI: 10.1016/j.eurpsy.2016.01.1734
[21] Huang CW, Li XL, Chen WX. Antibiotic resistance spectrum of main clinical pathogens: an analysis[J]. Chin J Nosocomiol, 2002, 12(6): 416-418. (in Chinese)
黄长武, 李兴禄, 陈维贤. 临床主要病原菌耐药谱变化分析[J]. 中华医院感染学杂志, 2002, 12(6): 416-418.
[22] Xia MY, Gao QC, Yuan CG. Change of drug resistance ofEscherichiacoliandKlebsiellapneumoniae[J]. Chin J Nosocomiol, 2014, 24(2): 287-289. (in Chinese)
夏梦岩, 高全成, 袁晨光. 大肠埃希菌与肺炎克雷伯菌耐药性的变迁研究[J]. 中华医院感染学杂志, 2014, 24(2): 287-289.
[23] Girometti N, Lewis RE, Giannella M, et al.Klebsiellapneumoniaebloodstream infection: Epidemiology and impact of inappropriate empirical therapy[J]. Medicine, 2014, 93(17): 298-309. DOI: 10.1097/MD.0000000000000111
Detection and antibiotic sensitivity test ofKlebsiellapeneumoniaeinAilurusfulgens
YANG Rui1,WEN Ji-feng1,GONG Yong-ping1,WANG Cheng-dong2, DENG Lin-hua2,HUANG Jie1,REN Lu1,YAN Qi-gui1
(1.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Wenjiang611130,China; 2.ChinaConservationandResearchCenterfortheGiantPanda,Wolong623006,China)
To confirm the etiology of a dead case for a 6 year-old femaleAilurusfulgens,one strain of the predominant bacteria from pathologic tissues(heart,liver,spleen,lung and other samples) of the deadAilurusfulgenswere examined and isolated.The isolate was named R1 and no other bacteria were isolated. The bacterial etiological examination(morphological characteristics,biochemical characteristics and 16S rDNA gene detection)of R1 showed that it was identifed asK.peneumoniae. Artificial infection to mice about R1 was also conducted in this study.R1 had strong pathogenicity to mice and the LD50is 6.5×104CFU/mL. Moreover,the clinical and pathological features of the dead mice were consistent with that of theAilurusfulgens.To find effective therapeutic drugs of curing otherAilurusfulgens,antibiotic sensitivity test of R1 was conducted,and the results revealed that R1 was highly sensitive to cefotaxime et al,moderately sensitive to amikacin and resistant to penicillin.These data showed thatK.peneumoniaewas bacterial pathogen leading to death of theAilurusfulgensand it had strong resistance to penicillins,macrolides and virginiamycin and it had broad drug resistance spectrum.However,R1 is sensitive to cephalosporins and aminoglycoside antibiotics.
Ailurusfulgens;K.peneumoniae;16S rDNA;LD50;antibiotic sensitivity test Supported by the Innovation Team Project of " Changjiang Scholars and Innovation Team Development Plan" by the Ministry of Education (No. IRT0848) Corresponding author: Yan Qi-gui, Email: yanqigui@126.com
10.3969/j.issn.1002-2694.2017.03.015
颜其贵,Email: yanqigui@126.com
1.四川农业大学动物医学院,温江 611130; 2.中国保护大熊猫研究中心,卧龙 623006
R378.99
A
1002-2694(2017)03-0271-05
2016-10-11 编辑:李友松
教育部《长江学者和创新团队发展计划》创新团队项目(No. IRT0848)资助
