H7N9禽流感及相关疫情分析评估
2017-04-19谢剑锋严延生
林 丹,谢剑锋,2,严延生,2
H7N9禽流感及相关疫情分析评估
林 丹1,谢剑锋1,2,严延生1,2
2016年10月起至今发生的第5波人感染H7N9禽流感疫情比前4波严重,截止至2017年3月8日,本波疫情感染者数量已达历年累积报告数的40.00%。病原学研究发现最近广东分离的两株H7N9病毒在HA的链接肽位置发生插入性变异导致对禽致病性有所增强,但绝大多数分离株与前4波疫情中H7N9病毒病原学特征无明显区别;流行病学调查研究显示,除有3起可能人传人事件外,与前4波比较,患者之间也没有明显的流行病学关联。因此,基于疫情分析及风险评估认为H7N9禽流感仍会扩散传播并继续发生新发病例,但流行病学和病原学分析认为该病毒在人际间持续传播的可能性低。本综述认为加强H7N9禽流感病原学与流行病学的研究具有重要的公共卫生意义。
H7N9禽流感;病原学;流行病学;疫情分析
2013 年 2 月和 3 月间 ,我国上海市 、安徽等省发生了严重的急性下呼吸道感染,患者标本经中国疾病预防控制中心鉴定,确定感染人类的病毒为新型H7N9 禽流感病毒(Avian influenza virus, AIV)[1]。 此后发现,该病毒传播扩散有一定的季节性,即好发于冬春季,所以在疫情分析统计时,世界卫生组织(WHO)建议,从每年的10月1日至次年的9月30日作为H7N9的流行年度。因此,从2013年H7N9疫情发生计起,我国已经历4波流行,目前正处于第5波流行期[2],但2017年2月中旬后报告病例数已明显下降。
根据世界卫生组织、联合国粮农组织(FAO)及有关权威机构的报告,截至 2017 年 3 月 8 日止,人感染H7N9 AIV累计报告病例数1 292 例。第1波134例,第2波304例,第3波219例,第4波118例,第5波目前已报告517例,疫情较为严重,已达到总报告病例40.00%;总体死亡435例,病死率约为33.67%。大陆境内已有20个省(市)自治区报告病例,境外港澳台、马来西亚和加拿大各有报告从中国大陆地区输入的病例。新发生病例主要集中在东南沿海地区,以江浙粤及其周边省份和地区的疫情为重[2-5]。
1 H7N9 AIV的病原学特征
1.1 基本特征 H7N9 AIV属于甲型流感的一种亚型,因此它具有甲型流感的所有基本特征。一是单股负链RNA 8节段病毒,有囊膜,可以编码血凝素(hemagglutinin,HA)、神经氨酸酶(neuramidinase,NA)、 基质蛋白 (M1、M2)、 核蛋白 (NP) 等 12 种病毒蛋白[6]。二是新重排的H7亚型病毒。A 型流感病毒根据 HA 和 NA 的抗原性不同分为 18 种 H 亚型(H1~H18)和 11 种 N 亚型(N1~N11),除近年新报告的H17、 H18分别系从中非和秘鲁的果蝠分离获得外[7-8],其他H1-H16均可在水禽(鸟)中被检测到。据目前有关资料,新H7N9的H7和N9分别来源于浙江鸭群的H7N3 亚型的H7和韩国水鸟中流行的 H7N9 的NA 片段,内部6个基因(MP、NS、NP、PA、PB1、PB2)与大多数新亚型病毒一样,均以H9N2为供体,但其中 MP、NS、NP 来源于中国东南部的鸡群,PA、PB1、PB2 来源于北京燕雀[9]。三是低致病性禽流感(low pathogenic avian influenza,LPAI)病毒。H7N9 AIV作为A型流感病毒的一种,以往仅在禽类中发现,美国和韩国等地曾发生过鸡和鸟类的H7N9 AIV感染,但在2013年之前未发现过人的感染[10]。除H7N7 AIV在2003年曾导致1位荷兰患者死亡外,人类中从未发现H7亚型产生的死亡病例,而N9亚型则从未发现感染人类的病例[11]。新重排的H7N9感染家禽后(主要为鸡)一般不会出现症状或导致死亡,呈隐性感染,但人感染后会引起急性肺炎、呼吸衰竭、急性呼吸窘迫综合征等致命的临床结局[12]。
1.2 H7N9 AIV主要基因的变异
1.2.1 HA基因变异 与其他A型流感病毒一样,H7N9病毒HA受体结合位点的氨基酸序列决定了病毒优先选择结合的受体类型。从人和禽类分离到的H7N9病毒均发现在HA受体结合位点分别发生了G186V、G226L和T160A(H3 Numbering)氨基酸替换[13-14],而从人分离到的H7N9病毒还发生了A138S氨基酸替换[15],这些突变增加了病毒对人a-2,6唾液酸受体的亲和性,同时仍保留了与禽类a-2,3唾液酸受体结合的能力,这使得新型H7N9病毒同时具备人流感病毒和AIV的一些特征,这种特征在其他AIV中未发现。当然,也不是所有的分离株均具有上述位点的突变,其对人a-2,6唾液酸受体的亲和性仍远低于对禽类a-2,3唾液酸受体结合的能力,保持着在禽类复制为主而不是在人类复制的能力。因此,它仍然是AIV而不是H1N1、H2N2和H3N2这样的A型人流感病毒。
2017年2月18日,国家卫生和计划生育委员会(以下简称国家卫计委)向WHO报告了从广东两病例分离H7N9病毒株及核酸序列分析结果,发现其在HA1和HA2之间的连接肽区有4个氨基酸的插入[16],我国台北2月4日在GISAID数据库中也已登载过类似的序列,其毒株系从广东返回台湾的旅游者病例中分离得到;此外,2月21日,我国农业部也向OIE报告从广东活禽市场分离到这种病毒,显然,这种病毒已从对禽类低致病性向高致病性转化。在HA连接肽区多个碱性氨基酸插入而致A型流感病毒毒力提高已有报道[17-18],这一发现,虽不影响对第1至第5波H7N9流行毒株主体为LPAI的评价,但应警惕此类H7N9突变株今后对人、禽疫情的影响。
1.2.2 NA基因变异 NA基因其所编码的神经氨酸酶主要功能在于裂解宿主细胞的唾液酸受体,协助新生病毒颗粒从被感染宿主细胞表面游离下来,再吸附到周围未被感染的细胞上。人型流感病毒不仅裂解a-2,6唾液酸受体,而且还能裂解a-2,3唾液酸受体,而禽型流感病毒仅能裂解a-2,3唾液酸受体,这涉及到病毒的宿主适应性及复制问题,继而决定了疫情的走向[19]。不仅在H7N9 AIV,而且也在H2N2、H9N2 AIV的NA茎部69~73位置,均发现有5个氨基酸的缺失。这种短茎NA既有可能改变病毒对受体的结合倾向,也提高了病毒的复制能力和对哺乳动物的毒性,与AIV在家禽中的适应和传播有关,如使水禽中的AIV能够适应陆地上的禽鸟,有报道H7N9 AIV在感染人类之前可能已经在陆地的禽鸟中流行,北美、韩国和蒙古的欧亚大陆的野禽内均发现H7N9 AIV[20],这说明该病毒分布甚广。
另外,H7N9 病毒耐药性变异的病原学监测则发现极少数病人分离株的 NA 序列发生E119V、R292K(N2 numbering)的突变,提示对神经氨酸酶抑制剂(主要为达菲)的敏感性降低[21]。需要说明的是一种病原耐药的发生,往往是长期流行和不规范治疗累积的结果,但H7N9感染人的病案相对少见,没有证据表明该耐药性的突变具有扩散传播的现象。因此,人感染后尽早使用达菲是有助于患者的治疗[22]。
1.2.3 其他基因变异 对于AIV聚合酶亚基PB2片段引用最多的突变是Glu627Lys的替换[23-24],Zhang等也确认约有70%的H7N9人体分离株PB2发生E627K的替换是H7N9 AIV在人体中复制的关键突变[5];近期,Yamayoshi等除发现H7N9 AIV Glu627Lys的替换外,还发现PB2 Asp701Asn位点发生天冬氨酸到天冬酰氨的替换,这就证明PB2的627位点对于AIV适应人体细胞复制的重要性[26]。研究认为这种替换使H7N9等AIV可在33 ℃的人的上呼吸道复制,而取代了AIV只能在40 ℃禽肠道的复制[24-25],这个替换显然是H7N9适应人体的一个重要突变。而Asp701Asn替换突变可能是代尝性地促进了AIV在人体细胞中的复制。
其他位点的突变[33],如PB2的89V和357H、PB1-F2的66S、PA中的336M、M1的30D和215A、NS1的42S和92E等氨基酸替换,都可能使H7N9的毒力增强,但多与实验动物如小鼠、雪貂等有关。
2 环境及禽体免疫力对H7N9 AIV生存的影响
一般而言,AIV主要潜藏在家禽(如鸭子、鹅)和鸥、雀等野鸟中,大量的病毒从禽鸟的粪便排出,经粪-口途径感染具有相同迁移习性和路线的禽鸟[27-28],所以引起全球传播作用自然与飞禽有关。流感病毒在野生鸟类中的传播包括病毒在机体中的潜伏、在环境中的稳定性和与其他宿主的密切接触程度等多种因素有关。潜伏在飞禽中的各种病毒大多数在清水的外环境中可分离获得,其感染性的维持与清水的温度与pH值有关,有报道在28 ℃时病毒可存活4 d,在0 ℃时超过30 d,特别是在微碱(pH 7.4-8.2)及低于17 ℃时其感染性最强[29]。
禽体免疫系统的状况决定了病毒在禽体的储存时间继而在天然宿主中的传播。在禽体细胞免疫系统,成熟的T淋巴细胞分布在颈部的胸腺和多数禽类的胸腔中。与人类不同,这些T淋巴细胞主要在雏鸟的后期成熟并持续一生;参与抗体调节应答的浆母细胞位于泄殖腔的法氏囊(BF),但BF在雏鸟早期就已退化。BF的退化及完整的胸腺功能发挥期间,此时禽类的免疫功能弱化,导致雏鸟体内具有高病毒载量成为传染源,它们与各种飞鸟通过粪-口途径及密切接触,进一步使AIV传播扩散。
3 H7N9 AIV的流行病学基本特征
3.1 病例感染来源 H7N9 AIV是我国继发现H5N1高致病性AIV后,再度发现的可感染人并造成较为严重临床后果的新型AIV。流行病学调查和病毒序列分析证明,H7N9从野生水鸟传入家禽鸭子再传给鸡[30],各种禽鸟类尤其是家养鸡是人感染H7N9禽流感的主要传染源。从2013年2月19日我国报告首例H7N9 AIV感染者始,截止目前约已发现20起人传人事件[4,31],有的系有共同暴露禽类史,有的可能是自家中陪护的密切接触成员,最多一般不超过3例,即该病毒不具备持续的人间传播能力,所以病人尚不能作为严格意义上的传染源。已证明新型 H7N9 AIV能够在家禽中无症状携带,这对于疾病的源头管控带来了较大的难度。H7N9 AIV分离株的核酸序列分析表明H7N9 AIV可分为长三角分支及珠三角分支两种体系株[21],后者系从前者进化而来,两者在传播力上无区别,不同只是在朔源分析方面而已。从第5波感染病例分析,70%以上感染者具有家禽接触史或活禽市场暴露史,各地报告(尤其是上海市)关闭活禽市场可极大减少人感染病例的发生,因此认为暴露于活禽市场是引发疾病的高危因素,且主要传染源还是感染H7N9 AIV的家禽。
3.2 传播途径 病例的流行病学调查及临床检查资料证实,经呼吸道感染含有病毒粒子的气溶胶是人感染H7N9 AIV的主要途径。在与感染者毫无保护地、长时间密切接触的特殊环境下,携带H7N9 AIV的感染者可能具有有限的传播能力,但主要也是通过气溶胶传播。研究表明可能少数人对于AIV具有遗传易感性[32],但仍未有肯定证据。
4 当前疫情简析及风险评估[2-4]
4.1 第5波疫情简析 据WHO网站2017年2月14日提供的数据,第5波人感染H7N9禽流感疫情开始至今,全球范围内共报告了425例实验室确诊病例。这些病例分布于20个地区,其中江苏报告125例、浙江74例、广东47例、安徽44例、湖南27例,涉及跨地区报告病例达12例。
除1例病例信息缺失外,其余424例病例年龄范围3~91岁,中位年龄58岁,男女性别比为2.39∶1。死亡病例年龄3~91岁,中位年龄59.50岁,死亡病例性别比2.13∶1。
167例病例的发病前流行病学暴露史仍在调查中,其余257例病例中,90.66%(233例)的病例发病前有禽类相关暴露情况,其中67.32%(173例)存在活禽市场暴露史,24.90%(64例)有家养禽类暴露史,4.28%(11例)有职业暴露史(表1)。
表1 2016年10月1日至2017年2月14日人感染H7N9禽流感实验室确诊病例暴露史信息
Tab.1 Exposure history of laboratory-confirmed human H7N9 cases,1stOct 2016 to 14thFeb 2017
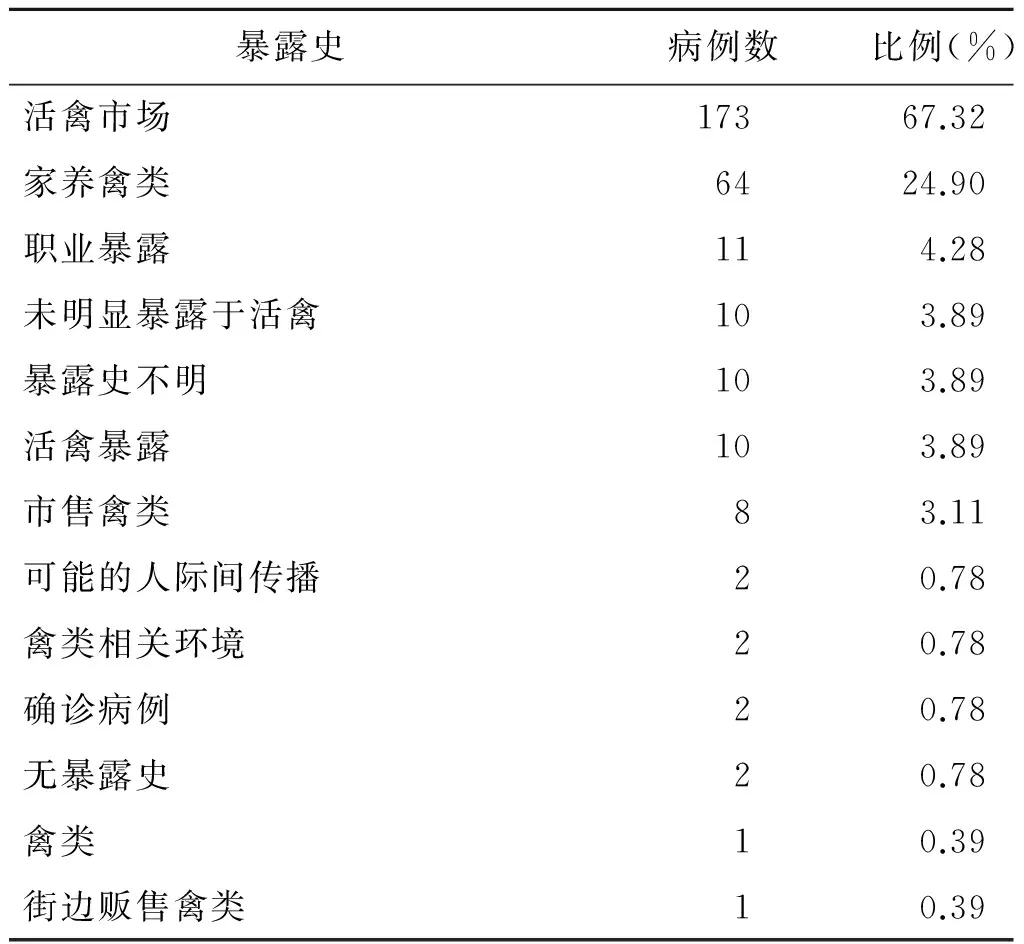
暴露史病例数比例(%)活禽市场17367.32家养禽类6424.90职业暴露114.28未明显暴露于活禽103.89暴露史不明103.89活禽暴露103.89市售禽类83.11可能的人际间传播20.78禽类相关环境20.78确诊病例20.78无暴露史20.78禽类10.39街边贩售禽类10.39
注:部分病例有超过1项暴露史。
5.2 历年来总体疫情简析 根据WHO信息,2013年以来,我国已发生5波人感染H7N9禽流感暴发疫情(见图1)。自2013年3月首次接受报告人感染H7N9禽流感病例以来,截止2017年2月14日,WHO共收到报告人感染H7N9禽流感实验
室确诊病例1 223例,其中至少死亡380例,总病死率约为31.07%。
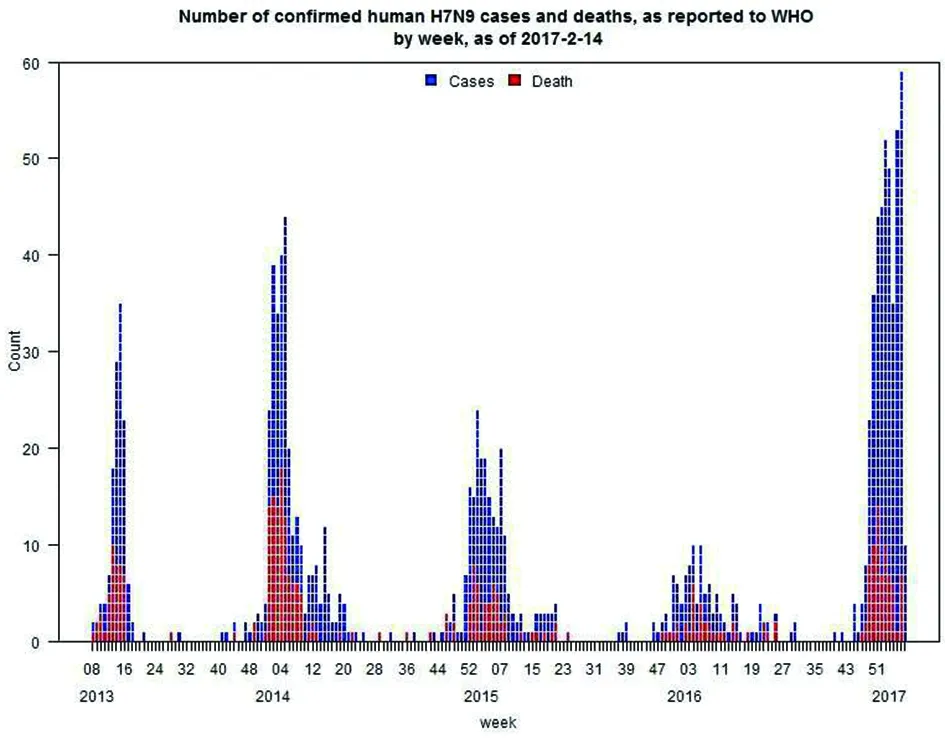
图1 2013-2017年人感染H7N9禽流感疫情发病曲线(以周为单位)Fig.1 Epidemiological curve of avian influenza A(H7N9) cases in humans by week of onset, 2013-2017
根据FAO网站2017年3月15日17时更新的信息,FAO也将2013年至今的人感染H7N9禽流感疫情分为5波,并总结出各波疫情中各个地区的发病情况(见图2)。根据FAO的数据,2013年2月至2017年3月15日,全球范围内报告1 320例人感染H7N9禽流感确诊病例,其中死亡492例,病死率37.27%。
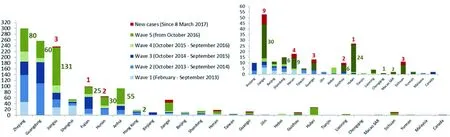
图2 2013年2月至2017年3月15日人感染H7N9禽流感病例数地区分布Fig.2 Number of officially reported human cases since February 2013 as of 15th March 2017
欧盟疾病预防控制中心(ECDC)于2017年3月9日也引用WHO数据,分析了发生在中国的5波人感染H7N9禽流感疫情(表2)[33]。ECDC认为第5波疫情的流行病学特征与前4波相比无太大变化,但呈现出一个与以往不同的流行病学特征,即病例分布地区更广,且农村地区报告病例数增加。ECDC还比较了5波疫情中的病死率情况(第1波32%、第2波42%、第3波44%、第4波37%、第5波截至目前34%、总体疫情截至目前38%),认为第5波疫情的病死率与以往4波相比,没有变化。
表2 人感染H7N9禽流感5波疫情中各地报告病例数
Tab.2 Number of reported cases due to A(H7N9) infection by place and time of reporting
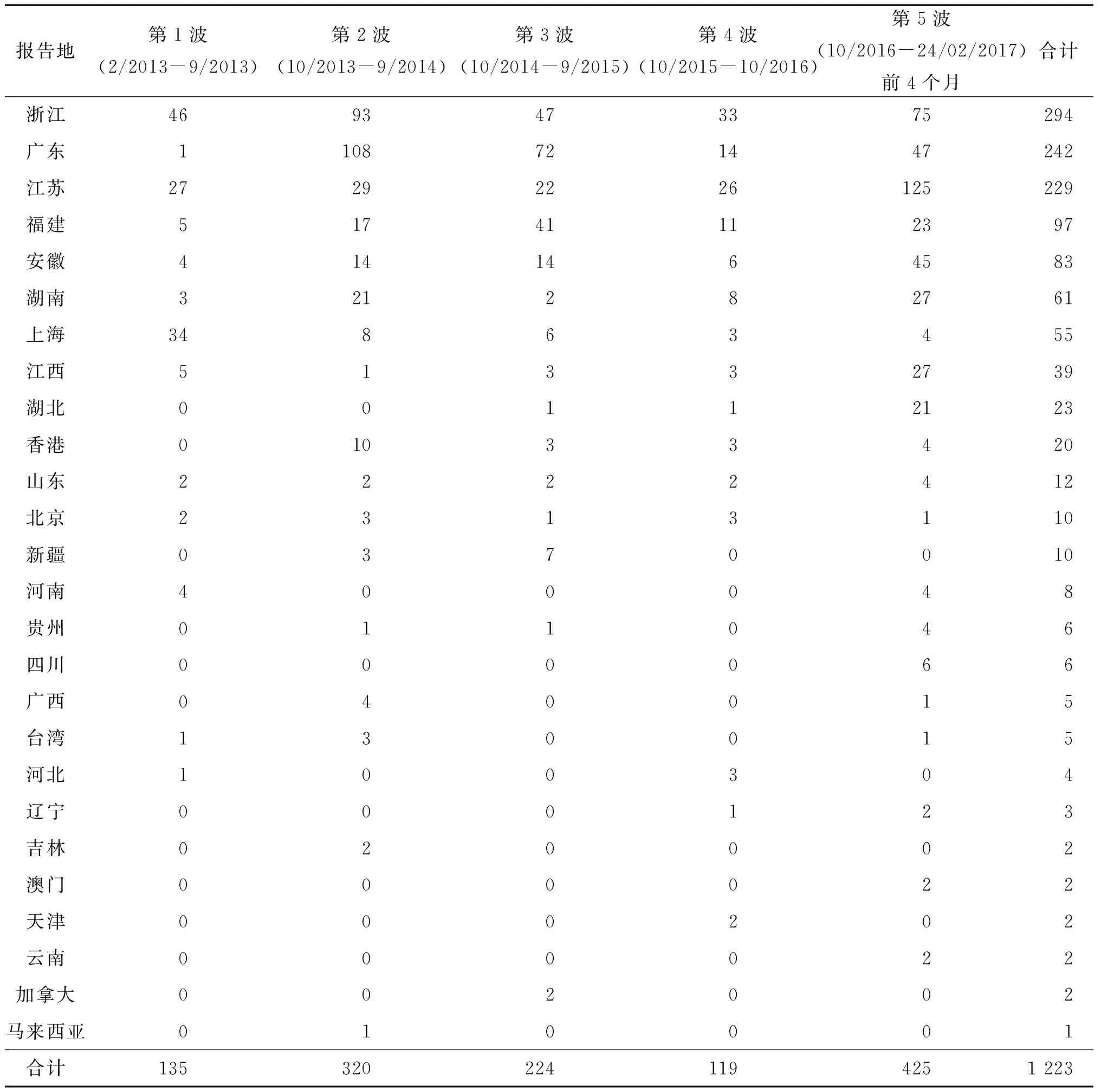
报告地第1波(2/2013-9/2013)第2波(10/2013-9/2014)第3波(10/2014-9/2015)第4波(10/2015-10/2016)第5波(10/2016-24/02/2017)前4个月合计浙江4693473375294广东1108721447242江苏27292226125229福建51741112397安徽4141464583湖南321282761上海34863455江西51332739湖北00112123香港01033420山东2222412北京2313110新疆0370010河南400048贵州011046四川000066广西040015台湾130015河北100304辽宁000123吉林020002澳门000022天津000202云南000022加拿大002002马来西亚010001合计1353202241194251223
注:数据来源为WHO于2017年2月14日发布的报告。
5.3 禽类与外环境中H7N9 AIV污染情况 根据FAO网站数据,超过2 000份来自外环境、鸡、鸽子、鸭和麻雀病毒学标本的检测结果为阳性,其中多数阳性标本主要来自活禽市场、摊贩和养殖场(图3)。
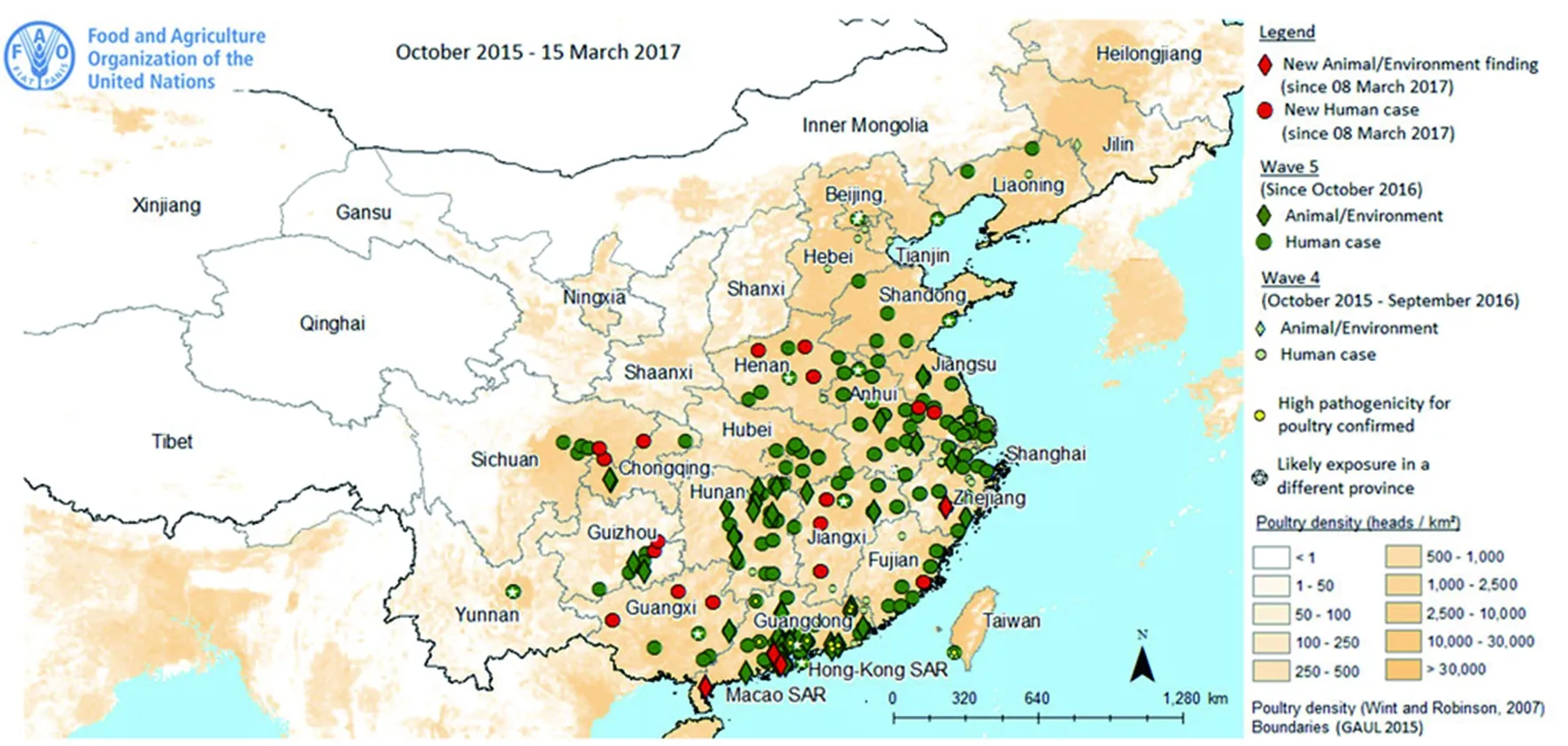
病例所在地以报告地点为准,但某些病例的感染地点与报告地点不同。另有16例病例的确切感染地点不详,因此未在图中标注。图3 人感染H7N9禽流感病例与禽类或外环境阳性结果地区分布Fig.3 Human cases and positive findings in birds or the environment
第5波人感染H7N9禽流感疫情中,3例病例(广东2例,台湾1例)的H7N9 AIV株发生变异,提示该病毒突变为对禽高致病性的病毒。同时,广东省在16份禽类及6份外环境样本中发现对禽高致病性的H7N9病毒。
此外,FAO还从12篇已发表文献中总结出与人感染H7N9禽流感疫情相关的病毒学阳性标本的报道:2013年4月以来,共搜索12篇已发表文献,据统计,研究人员总共采集71 920份样本,其中有1 728份(2.4%)标本的病毒学检测结果为H7N9阳性。
根据农业部兽医局网站的信息[34-38],2016年10月至2017年2月,我国各级兽医实验室针对动物H7N9开展采样监测,共采样1 061 889份,覆盖场点39 632个。检测血清学样品792 421份,检出1 162份H7亚型禽流感血清学阳性样品(鸭样品1份、鹅样品1,其余全部为鸡样本)。检测病原学样品269 468份,检出131份H7N9病原学阳性样品(鸭样品5份、环境样品26份,其余全部为鸡样本)(表3-4)。
表3 2016年10月至2017年2月全国动物H7N9流感监测情况
Tab.3 Surveillance situation of animals infection with avian influenza A(H7N9) virus in China, October 2016 to February 2017
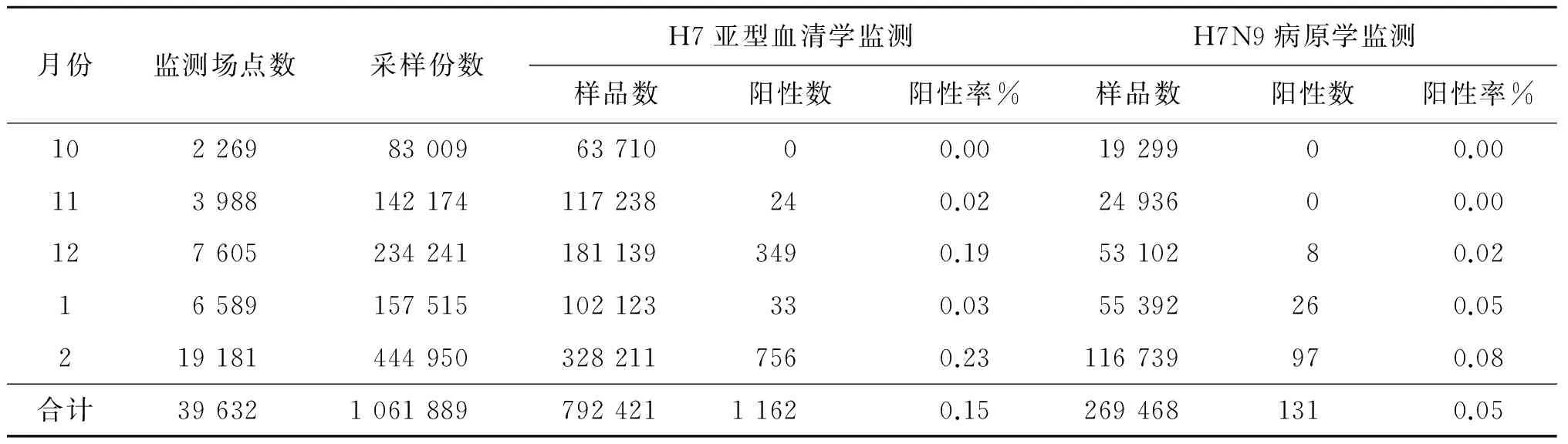
月份监测场点数采样份数H7亚型血清学监测H7N9病原学监测样品数阳性数阳性率%样品数阳性数阳性率%102269830096371000.001929900.00113988142174117238240.022493600.001276052342411811393490.195310280.0216589157515102123330.0355392260.052191814449503282117560.23116739970.08合计39632106188979242111620.152694681310.05
表4 2016年10月至2017年2月全国动物H7N9流感监测阳性结果分布(H7亚型禽流感血清学阳性样品和H7N9病原学阳性样品)
Tab.4 Surveillance results of animals infection with avian influenza A(H7N9) virus in China, October 2016 to February 2017(serological results for H7 subtype & pathogenic results for H7N9 virus)
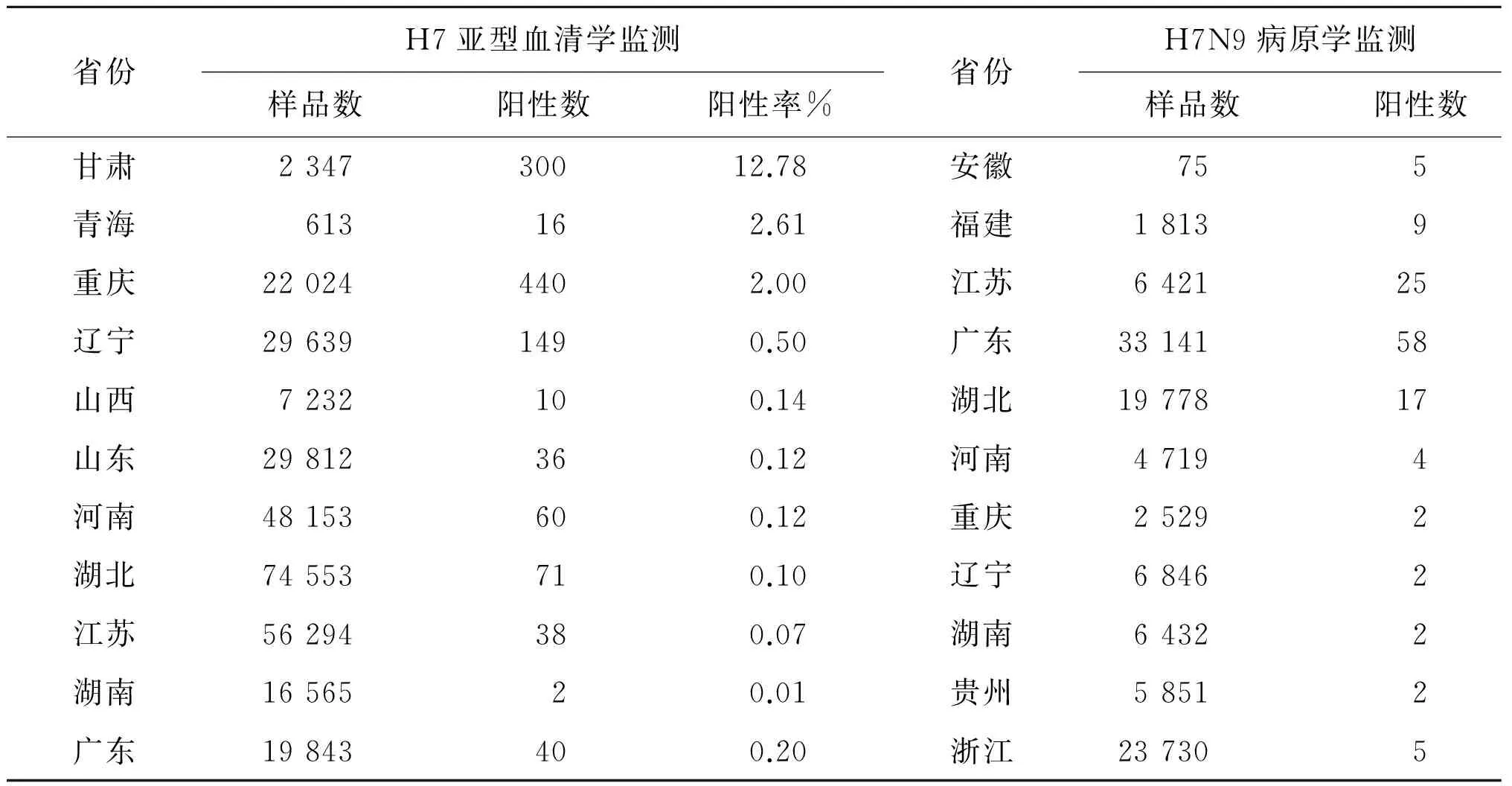
省份H7亚型血清学监测省份H7N9病原学监测样品数阳性数阳性率%样品数阳性数阳性率%甘肃234730012.78安徽7556.67青海613162.61福建181390.50重庆220244402.00江苏6421250.39辽宁296391490.50广东33141580.18山西7232100.14湖北19778170.09山东29812360.12河南471940.08河南48153600.12重庆252920.08湖北74553710.10辽宁684620.03江苏56294380.07湖南643220.03湖南1656520.01贵州585120.03广东19843400.20浙江2373050.02
5.4 各机构风险评估结果 WHO 2017年2月14日发布的月度风险评估结果预测[3],中国境内已出现人感染H7N9禽流感病例的省份还会继续发生新发病例,而之前未出现病例的省份也可能陆续出现病例报告;尽管出现若干起聚集性疫情并涉及部分医务人员,但目前的流行病学和病原学证据表明,H7N9 AIV并未获得在人际间持续传播的能力。因此,该病毒在人际间持续传播的可能性低。
美国疾病预防控制中心(USCDC)做出的风险评估则认为[39],虽然目前该疫情对整个公共卫生体系未产生威胁,但却潜藏着暴发流感大流行的风险。H7N9 AIV不断变异,有可能获得在人际间持续传播的能力,并有可能传播至周边国家,并在这些国家内部导致与活禽暴露相关的人类病例。受人感染H7N9禽流感疫情影响国家也会发生输出病例。尽管如此,由于始终未出现该病毒在人间持续传播的证据,该疫情对公共卫生体系的影响有限。
5 我国应对策略[40]
为有效应对H7N9疫情,做好医疗救治有关工作,切实保障人民群众健康安全,2017年2月22日,国务院总理主持召开国务院常务会议,研究部署H7N9疫情防控工作。要求各地区和有关部门继续做好H7N9疫情联防联控,公开透明及时发布疫情权威信息,强化疫情源头控制,做好监测预警和病例救治,推行“规模养殖、集中屠宰、冷链运输、冰鲜上市”新模式。
国家卫计委高度重视疫情防控工作,发挥联防联控工作机制作用,要求发现病例以及外环境病毒检测阳性的地区,关闭活禽经营市场;加强活禽向外地调运的管控,未经兽医部门检疫合格的活禽限制外调。要求尚未发生疫情地区的活禽市场,进一步严格活禽经营市场准入,加强活禽检疫和清洗、消杀等预防措施,降低人群患病风险。同时,积极推动疫情发生地研究落实全面停止活禽交易、推进家禽产业转型升级和实行冰鲜禽类产品流通上市等长效措施。同时,进一步加强风险评估。一旦发现病例,要求立即调查核实,并有针对性地落实好相关防控措施,防止疫情扩散。
为做好针对新一波H7N9疫情的医疗救治工作,国家卫计委组织制定了《人感染H7N9禽流感诊疗方案(2017年第1版)》[22],并组织制订了《人感染H7N9禽流感早诊早治专家共识》,目的在于提升医疗卫生人员对H7N9早期识别、诊断与治疗的能力,贯彻落实“早发现、早报告、早诊断、早治疗”工作原则,进一步减少重症病例发生,降低病死率。
国家卫计委还根据《国际卫生条例》要求向WHO共享监测信息,并通过WHO全球流感监测和应急响应系统(GISRS),与其他国际机构的动物流感专家以及各国相关机构合作,继续监测并汇报H7N9疫情态势。
我国将继续加强流感监测,包括不明原因肺炎(PUE)监测、严重急性呼吸系统感染(SARI)监测和流感样病例(ILI)监测,认真研究所有异常的流行病学变化,并通过WHO全球流感项目(GIP)和GISRS的世界卫生组织合作中心(WHOCCs)及时通报和预警未分型流感病毒情况,并继续做好流感大流行应对准备。
6 展 望
H7N9严重地威胁着人们的健康,各国科学家对病毒的来源、抗原变异、毒力等病原学特征进行深入分析,对疾病的流行病学特征包括传染源、传染途径、危险因素等进行广泛研究。 但禽类的养殖业是社会经济发展的一个重要内容,如何既保证养殖业的发展又要保护人们的健康,需要多部门的协调和配合。其中,农业部门和卫计部门联合对H7N9 AIV开展禽类(包括家、野禽)和人群的监测尤为重要,当然,也需开展对H5N1、H5N6、H9N2 和 H10N8 AIV亚型的监测,因为,这些亚型也感染人,我们要关注AIV可能对禽和人类的新威胁。
监测和风险评估的目的有两个问题需要注意,一是H7N9 AIV为什么在第5波疫情走高?近几年H5N6、H9N2和H10N8亚型偶有致人疾病发生,这与禽流感不断发生变异跨物种侵犯人类有何逻辑性的关系;二是从1918年起源于西班牙的H1N1流感大流行至2009年起源于北美的H1N1流感四次全球大流行的毒株大多为禽(鸟)、猪和人流感病毒基因多重重配演化的结果[41-42];而位点突变常造成人类或动物流感病情的加重或迁延流行的恶果[17-18]。我国近年来养禽业发展迅速,有报道2015年达到131亿羽之多[43],其中包含大量圈养或放养的禽类。大型禽类养殖场与外界禽鸟相对隔绝,H7N9 AIV可能不易被携带病毒的野禽侵犯传染;但农村大量圈养或放养的禽类就很自然的和野禽交往,特别是在温润的水网地带,这就造成扩散传播,与活禽市场成为H7N9 AIV流行源头不无关系。其次,感染的圈养或放养的禽类再将病毒传与圈养或放养的猪-所谓流感的“混合器”,产生新型病毒,可能由此造成新流感流行。这也许是我们研究A型流感病毒、关注可能的流感大流行的所在。所以,疾控机构对目前所有三种对流感监测措施以及风险评估必须严格执行,动物疫病防治机构也有责任和疾控机构相互配合进行动物间流感病毒的监测,这样才能保证流感病毒进化演变而被人类所及时预知和防控。
[1] Gao R, Cao B, Hu Y, et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. N Engl J Med, 2013,368: 1888-1897.
[2] Zhou L, Ren R, Yang L, et al. Sudden increase in human infection with avian influenza A(H7N9) virus in China, September-December 2016[J]. Western Pac Surveill Response J, 2017, 8(1). DOI: 10.5365/wpsar.2017.8.1.001
[3] WHO. Influenza. Monthly Risk Assessment Summary[EB/OL]. (2017-02-14)[2017-03-16]. http://www.who.int/influenza/human_animal_interface/HAI_Risk_Assessment/en/.
[4] FAO. H7N9 situation update[EB/OL]. (2017-03-15)[2017-03-16].http://www.fao.org/ag/againfo/programmes/en/empres/ H7N9/situation_update.html.
[5] Xiang NJ, Li XY, Ren RQ, et al. Assessing change in avian influenza (H7N9) virus infections during the fourth epidemic-China, September 2015-August 2016[J]. MMWR, 2016, 65(49): 1390-1394.
[6] Zhu W, Shu Y. Genetic tuning of avian influenza A(H7N9) virus promotes viral fitness within different species[J]. Microbes Infect, 2015, 17(2): 118-122.
[7] Tong S, Li Y, Rivailler P, et al. A distinct lineage of influenza A virus from bats[J]. Proc Natl Acad Sci U S A, 2012, 109: 4269-4274.
[8] Tong S, Zhu X, Li Y, et al. New world bats harbor diverse influenza A viruses[J]. PLoS Pathog, 2013, 9: e1003657.
[9] Joseph U, Su Y, Vijaykrishna1 D,et al. The ecology and adaptive evolution of influenza A interspecies transmission[J]. Influenza Other Respir Viruses, 2017, 11: 74-84.
[10] Wu D, Zou S, Bai T, et al. Poultry farms as a source of avian influenza A (H7N9) virus reassortment and human infection[J]. Sci Rep, 2015, 5: 7630.
[11] Wang XY, Chai CL, Li FD, et al. Epidemiology of human infections with avian influenza A(H7N9) virus in the two waves before and after October 2013 in Zhejiang province, China [J]. Epidemiol Infect, 2015, 143(9): 1839-1845.
[12] Su S, Bi Y, Wong G, et al. Epidemiology, evolution, and recent outbreaks of avian influenza virus in China[J]. J Virol, 2015, 89(17): 8671-8676.
[13] To KK, Zhang AJ, Chan AS, et al. Recombinant influenza A virus hemagglutinin HA2 subunit protects mice against influenza A (H7N9) virus infection[J]. Arch Virol, 2015, 160(3): 777-786.
[14] Zeng Z, Huang XR, Lu PX, et al. Imaging manifestations and pathological analysis of severe pneumonia caused by human infected avian influenza (H7N9)[J]. Radiol Infect Dis, 2015, 1(2): 64-69.
[15] Zhu W, Shu Y. Genetic tuning of avian influenza A (H7N9) virus promotes viral fitness within different species[J]. Microbes Infect, 2015, 17(2): 118-122.
[16] Disease outbreak news, 27 February 2017. Human infection with avian influenza A(H7N9) virus-China [EB/OL]. (2017-02-27)[2017-03-16]. http://www.who.int/csr/don/27-february-2017-ah7n9-china/en.
[17] Chen J, Lee KH, Steinhauer DA, et al. Structure of the hemagglutinin precursor cleavage site, a determinant of influenza pathogenicity and the origin of the labile conformation[J]. Cell, 1998, 95: 409-417.
[18] Schrauwen EJ, de Graaf M, Herfst S, et al. Determinants of virulence of influenza A virus[J]. Eur J Clin Microbiol Infect Dis, 2014, 33: 479-490.
[19] de Graaf M, Fouchier RA. Role of receptor binding specificity in influenza A virus transmission and pathogenesis[J]. EMBO J, 2014, 33: 823-841.
[20] Bui C, Bethmont A, Chughtai AA, et al. A systematic review of the comparative epidemiology of avian and human influenza A H5N1 and H7N9-lessons and unanswered questions[J]. Transbound Emerg Dis, 2015, 29.
[21] Wang D, Yang L, Zhu W, et al. Two outbreak sources of influenza A (H7N9) viruses have been established in China[J]. J Virol, 2016, 90(12): 5561-5573. DOI: 10.1128/JVI.03173-15
[22] National Health and Family Planning Commission of the PRC. Diagnosis and treatment plan for human infection with avian influenza A(H7N9) virus, 1st 2017[EB/OL]. (2017-01-24)[2017-03-16].http://www.nhfpc.gov.cn/yzygj/s3593g/201701/2dbdbc6e82dd4fdfa57508499f61cdfc.shtml. (in Chinese)
国家卫生计生委. 人感染H7N9禽流感诊疗方案(2017年第1版)[EB/OL]. (2017-01-24)[2017-03-16].http://www.nhfpc.gov.cn/yzygj/s3593g/201701/2dbdbc6e82dd4fdfa57508499 f61cdfc.shtml.
[23] Van Hoeven N, Pappas C, Belser JA, et al. Human HA and polymerase subunit PB2 proteins confer transmission of an avian influenza virus through the air[J]. Proc Natl Acad Sci U S A, 2009, 106: 3366-3371.
[24] Yamada S, Hatta M, Staker BL, et al. Biological and structural characterization of a host-adapting amino acid in influenza virus[J]. PLoS Pathog, 2010, 6: e1001034.
[25] Zhang H, Li X, Guo J, et al. The PB2 E627K mutation contributes to the high polymerase activity and enhanced replication of H7N9 influenza virus[J]. J Gen Virol, 2014, 95(Pt 4): 779-786. DOI: 10.1099/vir.0.061721-0 (2014)
[26] Yamayoshi S, Fukuyama S, Yamada S, et al. Amino acids substitutions in the PB2 protein of H7N9 influenza A viruses are important for virulence in mammalian hosts[J]. Sci Rep, 2015, 5: 8039.
[27] Slingenbergh JI, Gilbert M, de Balogh KI, et al. Ecological sources of zoonotic diseases[J]. Rev Sci Tech, 2004, 23: 467-484.
[28] Bahl J, Krauss S, Kühnert D, et al. Influenza a virus migration and persistence in North American wild birds[J]. PLoS Pathog, 2013, 9: e1003570.
[29] Causey D, Edwards SV. Ecology of avian influenza virus in birds[J]. J Infect Dis, 2008, 197(Suppl 1): S29-S33.
[30] Tan KX, Jacob SA, Chan KG, et al. An overview of the characteristics of the novel avian influenza A H7N9 virus in humans[J]. Front Microbiol, 2015, 6: 140.
[31] Wu Z, Sha J, Yu Z, et al. Epidemiological and virological differences in human clustered and sporadic infections with avian influenza A H7N9[J]. Int J Infect Dis, 2016, 49: 9-17. DOI: 10.1016/j.ijid.2016.05.022
[32] Zhang Y, Shen Z, Ma C, et al. Cluster of human infections with avian influenza A (H7N9) cases: a temporal and spatial analysis[J]. Int J Environ Res Public Health, 2015, 12(1): 816-828.
[33] European Centre for Disease Prevention and Control. Genetic evolution of A(H7N9) virus in China-implications for public health[R]. Sixth update, Stockholm: ECDC; 2017.
[34] Veterinary Bureau of Ministry of Agriculture, PRC. Surveillance situation of animals infection with avian influenza A(H7N9) virus, October, 2016[EB/OL]. (2017-11-31)[2017-03-14]. http://www.moa.gov.cn/sjzz/syj/dwyqdt/jczt/201611/t20161130_5383479.htm. (in Chinese)
农业部兽医局. 2016年10月份全国动物H7N9流感监测情况[EB/OL]. (2017-11-31)[2017-03-14]. http://www.moa.gov.cn/sjzz/syj/dwyqdt/jczt/201611/t20161130_5383479.htm.
[35] Veterinary Bureau of Ministry of Agriculture, PRC. Surveillance situation of animals infection with avian influenza A(H7N9) virus, November, 2016[EB/OL]. (2017-12-16)[2017-03-14]. http://www.moa.gov.cn/sjzz/syj/dwyqdt/201612/t20161216_5409256.htm. (in Chinese)
农业部兽医局. 2016年11月份全国动物H7N9流感监测情况[EB/OL]. (2017-12-16)[2017-03-14]. http://www.moa.gov.cn/sjzz/syj/dwyqdt/201612/t20161216_5409256.htm.
[36] Veterinary Bureau of Ministry of Agriculture, PRC. Surveillance situation of animals infection with avian influenza A(H7N9) virus, December, 2016[EB/OL]. (2017-01-13)[2017-02-14]. http://www.syj.moa.gov.cn/dwyqdt/jczt/201701/t20170113_5431556.htm. (in Chinese)
农业部兽医局. 2016年12月份全国动物H7N9流感监测情况[EB/OL]. (2017-01-13)[2017-02-14]. http://www.syj.moa.gov.cn/dwyqdt/jczt/201701/t20170113_5431556.htm.
[37] Veterinary Bureau of Ministry of Agriculture, PRC. Surveillance situation of animals infection with avian influenza A(H7N9) virus, January, 2017[EB/OL]. (2017-02-08)[2017-03-14]. http://www.moa.gov.cn/sjzz/syj/dwyqdt/jczt/201702/t20170208_5470378.htm. (in Chinese)
农业部兽医局. 2017年1月份全国动物H7N9流感监测情况[EB/OL]. (2017-02-08)[2017-03-14]. http://www.moa.gov.cn/sjzz/syj/dwyqdt/jczt/201702/t20170208_5470378.htm.
[38] Veterinary Bureau of Ministry of Agriculture, PRC. Surveillance situation of animals infection with avian influenza A(H7N9) virus, February, 2017[EB/OL]. (2017-03-16)[2017-03-16]. http://www.moa.gov.cn/sjzz/syj/dwyqdt/jczt/201703/t20170316_5523850.htm. (in Chinese)
农业部兽医局. 2017年2月份全国动物H7N9流感监测情况[EB/OL]. (2017-03-16)[2017-03-16]. http://www.moa.gov.cn/sjzz/syj/dwyqdt/jczt/201703/t20170316_5523850.htm.
[39] Centers for Disease Control and Prevention. Asian Lineage Avian Influenza A (H7N9) Virus[EB/OL]. (2017-03-08)[2017-03-16]. https://www.cdc.gov/flu/avianflu/h7n9-virus.htm.
[40] National Health and Family Planning Commission of the PRC. Health and Family Planning departments worked actively for prevention and control of H7N9 infection in China[EB/OL]. (2017-02-15)[2017-03-16]. http://www.nhfpc.gov.cn/yjb/s3578/201702/6d04b2b39810459791f77ca3b8213dfd.shtml.(in Chinese)
国家卫生计生委.卫生计生部门积极做好H7N9防控工作[EB/OL]. (2017-02-15)[2017-03-16]. http://www.nhfpc.gov.cn/yjb/s3578/201702/6d04b2b39810459791f77ca3b8213d fd.shtml.
[41] Overview of etiology for Hong Kong influenza (H3N2), 1968[J]. Chin J Virol, 2009, 25(Suppl): 17-20. DOI: 10.13242/j.cnki.bingduxuebao.001980 (in Chinese)
杜宁, 杨霄星, 蓝雨, 等. 1968年香港流感(H3N2)病原学概述[J].病毒学报,2009,25(Suppl):17-20.
[42] Centers for Disease Control and Prevention. Swine influenza A (H1N1) infection in two children—Southern California, March-April 2009[J]. MMWR,2009,58(15): 400-402.
[43] USDAFAS. China-People’s Republic of, Poultry and Products 2015, GAIN Report: CH15027, 2015[EB/OL]. (2016-03-21)[2017-03-10]. http://gain.fas.usda.gov/Recent%20GAIN%20Publications/Poultry%20and%20Products%20Annual_Beijing_China%20-%20Peoples%20Republic%20of_8-18-2015.pdf.
Infection with avian influenza A(H7N9) virus and epidemic analysis
LIN Dan1, XIE Jian-feng1,2, YAN Yan-sheng1,2
(1.FujianCenterforDiseaseControlandPrevention,Fuzhou350001,China;2.TheKeyLaboratoryofZoonosesinFujianProvince,Fuzhou350001,China)
The situation of the ongoing fifth epidemic (beginning October, 2016) of human infection with avian influenza A(H7N9) virus are more serious than the first four ones. As of March 8, 2017, the fifth epidemic reported 40.00% of the cumulative cases. Recently, the pathogenic study reported two new human infections in Guangdong with an influenza A(H7N9) virus strain for which gene sequencing analysis revealed mutations in the haemagglutinin (HA) gene that resulted in the insertion of basic amino acids at the cleavage site of this protein, known to confer increased pathogenicity in chickens. However, most strains show no obvious difference in pathogenic characteristics compared with those detected during the first four waves. Although epidemiological studies showed that 3 clusters with limited human-to-human transmission have been investigated during the current wave, there are no indications of sustained person-to-person spread. Based on epidemic analysis and risk assessment results, it’s likely that human infections with H7N9 virus will continue to occur in China, but epidemiological and pathogenic analysis suggested that it’s unlikely to have a continued transmission of this virus. Profound public health significance would be presented by strengthening etiology and epidemiology studies of avian influenza A(H7N9) virus.
avian influenza A(H7N9); etiology; epidemiology; epidemic analysis Corresponding author: Yan Yan-sheng, Email: yysh@fjcdc.com.cn
10.3969/j.issn.1002-2694.2017.03.001
严延生,Email: yysh@fjcdc.com.cn
1.福建省疾病预防控制中心,福州 350001; 2.福建省人兽共患病研究重点实验室,福州 350001
R373.1
A
1002-2694(2017)03-0186-09
