空心菜浮床对鱼塘水质和微生物多样性的影响
2017-01-19李建柱张鹏飞柳尧全夏闰红马徐发华中农业大学湖北武汉430070
李建柱,侯 杰,张鹏飞,柳尧全,夏闰红,马徐发(华中农业大学,湖北 武汉 430070)
空心菜浮床对鱼塘水质和微生物多样性的影响
李建柱,侯 杰,张鹏飞,柳尧全,夏闰红,马徐发*(华中农业大学,湖北 武汉 430070)
为从环境微生物的角度探讨生物浮床的水质调节机理,采用宏基因组学测序技术和生物信息学手段,分析了环境微生物和根系微生物群落的多样性.研究结果表明,鱼菜共生模式下优势菌门是变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes)等,主要菌属是聚球藻属(Synechococcus)、hgcI_clade、CL500-29_marine_group、芽孢杆菌属(Bacillus)和分支杆菌属(Mycobacterium)等;空心菜根系微生物群落中最丰富的优势菌门是变形菌门和蓝细菌门,主要菌属是红细菌属(Rhodobacter)、噬氢菌属(Hydrogenophaga)和聚球藻属等.研究结果还表明低覆盖率(3.5%)的空心菜生物浮床能够增加水体的溶解氧含量,降低水体中含氮化合物的浓度和改善养殖环境中的微生态平衡,提高有益菌和氮循环细菌的含量.
空心菜浮床;环境微生物多样性;水质;16S rDNA
池塘养殖是中国主要的淡水水产养殖方式,由养殖导致的环境污染日益引起了人们的担忧.废氮积累是水产养殖的一个主要缺点[1],这些废物通常是养殖生物以氨氮的形式排泄[2-3],氨氮对养殖生物具有长期重毒作用[4-5].另外,亚硝酸氮对养殖生物也具有毒性作用[6-7].因此,寻求一个高效科学健康的治理养殖水污染的措施或更加可持续发展的养殖模式是亟待解决的问题.
鱼菜共生模式是一种结合生物浮床技术的新型健康生态养殖模式.研究表明生物浮床技术革命性地推进了水质净化技术的发展,提高了空间利用效率,在净化水质的同时,也可以产生一定的生态效益和经济效益[8-10],具有非常广泛的应用前景.目前,对鱼菜共生模式的研究多侧重于研究选用不同浮床植物对污染水体的净化效果[11-14],而对浮床植物根系微生物的群落结构和多样性及其变化研究较少,且没有从整个环境中全部微生物的角度对生物浮床水质调节机理做出一个科学的解释.因此,研究鱼菜共生模式中环境微生物和浮床植物根系微生物群落结构的多样性,对深入探讨生物浮床的水体调节机理具有非常重要的意义.本研究旨在通过宏基因组学等分子生物学方法,揭示生物浮床对鱼菜共生模式中微生物多样性的影响,并从微生物的角度对生物浮床水质调节机理做出一个科学的解释,为养殖水体生物调控技术的推广与应用提供一定的理论基础.
1 实验材料与方法
1.1 实验地点
实验点位于湖北省红安县中海农业科技有限公司高桥养殖基地,选取6个基本条件(养殖年限、面积、水深、水源与鱼类放养模式等)一致的草鱼精养池塘,其中3个水面上架设覆盖率为3.5% 的空心菜生物浮床构建鱼菜共生模式作为实验组,3个池塘为空白对照组.为防止草鱼摄食植物根系,本实验制作的生物浮床植物载体采用了双层PE网,把空心菜移植在上层网片上,成功防止植物根系被鱼类摄食.本试验周期为2015-06-10~2015-08-23.池塘面积为0.80hm2,平均水深1.80m.每天用商业鱼饲料(草鱼707系列,海大集团)投喂2次(08:30和15:30).
1.2 水质监测方法
水质理化参数溶解氧(DO)、温度(T)和pH用HACH HQ 40d便携式多参数水质分析仪实时测得.
定期采取离水面50cm深处的水层水样,在每个养殖池塘选取5个取样点取同等体积的水样,混合均匀后即为全层多点取样.测定方法参照《水质—中华人民共和国国家标准》测定,其中总氮(TN)用碱性过硫酸钾消解,紫外分光光度法测定;硝态氮测定采用酚二磺酸分光光度法;总氨氮(TAN)采用纳氏试剂比色法;亚硝态氮采用磺胺试剂分光光度计比色法[15-18].
实验组和对照组的各个水质参数平均15d监测1次,共5次,编号分别为T和C.
1.3 样品收集与DNA提取
本实验所有菌体样品均于2015-8-03上午采集.
水体菌体收集:采用5 点取样法,用高温灭菌的有机玻璃取水器采取每个养殖池塘水深50cm的池水,每个样取样量大体一致,均匀混合后装入灭菌的三角烧瓶,随后将50mL水样用0.22pm的滤膜过滤后,将滤膜置于无菌冷冻管中.泥样采集:采用3点取样法,3个采集点均位于投食区,用采泥器采集每个池塘采样点的底泥,混匀并置于无菌冷冻管中.根系菌体收集:随机剪取空心菜根系,悬浮于PBS缓冲溶液中,所得的悬浮液即为根面菌液,摇匀,然后用0.22pm的滤膜过滤100mL根面菌液,将滤膜置于无菌冷冻管中.上述所有样品均置于-20℃保存备用,直至提取DNA.
实验组水体和沉积物的样品编号分别为ST(ST1~ST3)和NT(NT1~NT3),对照组水体和沉积物的样品编号SC(SC1~SC3)和NC(NC1~NC3),空心菜根系样品编号为R(R1~R3).使用Soil DNA Kit试剂盒(OMEGA,美国)提取上述所有样品的DNA.所有样品的 DNA 提取步骤均参照Soil DNA Kit试剂盒说明书,并对提取到的样品基因组 DNA用1% 琼脂糖凝胶电泳检测质量.
1.4 高通量测序分析
针对细菌16S rRNA基因V3+V4区设计含barcode的特异引物338F/806R,引物序列为:338F(5'-ACTCCTACGGGAGGCAGCA-3'),806R(5'-GGACTACHVGGGTWTCTAAT-3').PCR扩增采用rTaq DNA Polymerase-20µL反应体系:10×Buffer 2µL,2.5mmol/L dNTPs 2µL,引物338F/806R各0.8µL,Taq酶0.2µL, BSA 0.2µL,模板DNA10ng,补ddH2O至20µL. PCR条件:95℃变性 3min;95℃ 30s,55℃ 30s,72℃ 45s,27个循环;最后72℃ 10min延伸(PCR仪:ABⅠGeneAmp® 9700型).
PCR产物经过2%琼脂糖凝胶电泳检测,条带清晰,片段大小合适(430bp左右),使用AxyPrepDNA凝胶回收试剂盒(Axygen,美国)切胶回收PCR产物,以Tris-HCl 洗脱后连接“Y”接头,使用磁珠筛选去除接头自连片段,按照每个样品测一万条序列加入1ng PCR产物的标准富集PCR产物,然后用0.1mol/L的NaOH 溶液变性,获得单链DNA片段,构建测序文库后在16S-338F-806R Miseq平台进行高通量测序(美吉生物,上海).
1.5 数据分析
对获得的测序数据,用 MOTHUR 软件结合EXCEL和SPSS 软件进行数据统计和分析.数据的统计分析以每个样品中可操作的分类单元(OUT,分类单元是分类工作中的客观操作单位,有特定的名称和分类特征,是指具体的分类群,可能是菌株、种或属等,将每个分类单位统称为一个操作分类单位)作为分类和计算的依据,并设置差异显著性水平P = 0.05,当P<0.05时表示显著性差异.
2 结果
2.1 水质指标
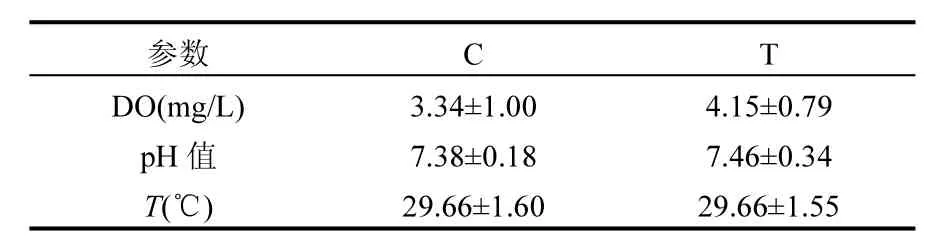
表1 水质的物理参数Table 1 Physical parameter of water in Control and Test
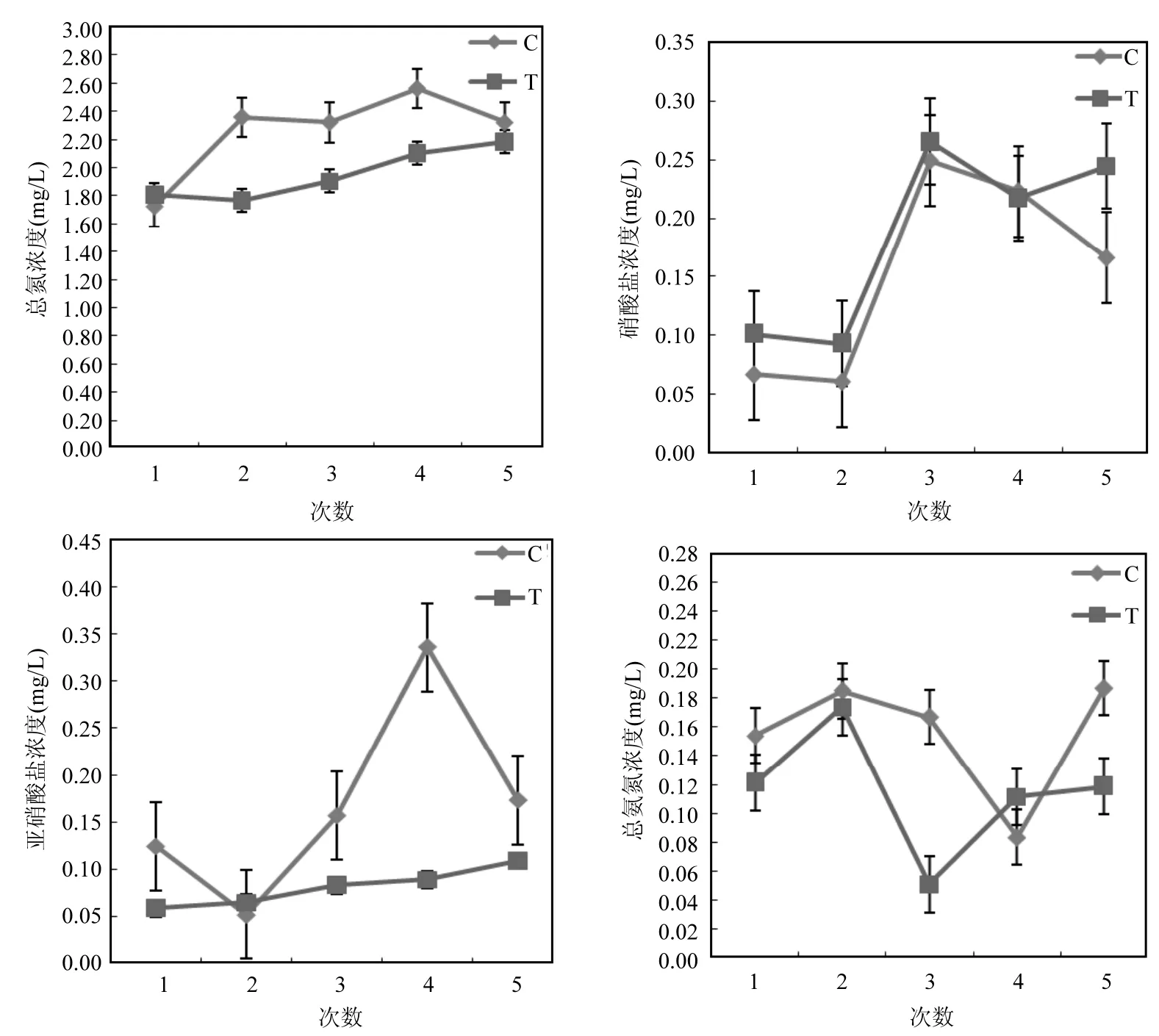
图1 试验期间总氮、总氨氮、硝酸盐和亚硝酸盐浓度的变化Fig.1 Variration of TN, TAN, nitrate, and nitrite concentrations during the study period
实验组和对照组的DO浓度、pH值和温度的监测结果如表1所示,且各参数之间并没有显著性差异(P>0.05).由研究结果可知鱼菜共生系统中的pH值和温度与非鱼菜共生系统的基本相同;但鱼菜共生模式下水体的DO浓度明显较高,分别为(4.15±0.79)mg/L和(3.34±1.00)mg/L.说明鱼菜共生系统中水质的理化性质比非鱼菜共生系统中更优良,更有利于鱼类养殖.
实验过程中,实验组和对照组的总氮、硝酸盐、亚硝酸盐和总氨氮的浓度变化如图1所示,且各参数之间并没有显著性差异(P>0.05).由研究结果可知实验组TN浓度的波动范围为1.76~2.18mg/L,对照组TN浓度的波动范围为1.72~2.32mg/L,且2个组别的总氮浓度都呈现出增加的趋势,实验组TN的浓度一直低于对照组TN的浓度;实验组亚硝酸盐浓度的波动范围为0.06~0.11mg/L,对照组亚硝酸盐浓度的波动范围为0.05~0.34mg/L,实验组亚硝酸盐的浓度明显低于对照组亚硝酸盐的浓度;实验组TAN浓度的波动范围为0.05~0.17mg/L,对照组TAN浓度的波动范围为0.08~0.19mg/L;实验组硝酸盐浓度的波动范围为0.09~0.27mg/L,对照组硝酸盐浓度的波动范围为0.06~0.25mg/L,实验组硝酸盐的浓度高于对照组硝酸盐的浓度(图1).这些结果说明尽管生物浮床能够降低水环境中的总氮、亚硝酸盐和总氨氮浓度,有利于保持养殖水,境的良好,但养殖过程中含氮化合物会不断累积,需要适时调节水质,保证健康养殖.
2.2 样品细菌群落多样性
对各个样品的有效序列进行系谱分类,以97%相似性水平为标准划分操作分类单元(OUT),SC、ST、NC、NT和R样品数据分别可划分为833、962、1989、2164和986个OUT(表2).通过计算在同一样本中检测到的随机选择扩增子序列的覆盖率进行评估抽样的完整性.OTUs的覆盖率的范围是99.17%~99.63%(表2),表明本研究样品中的大多数微生物种类都被检测到了.由样品的菌群丰度指数(Ace和Chao)可知实验组水体和沉积物的微生物丰度高于对照组;由样品的多样性指数(Shannon和Simpson)可知实验组水体的微生物多样性低于对照组,实验组沉积物的微生物多样性高于对照组(表2).这些研究结果表明与非鱼菜共生模式相比,鱼菜共生模式中养殖水环境中微生物具有高丰度和低多样性,沉积物中微生物具有高丰度和高多样性,进而表明空心菜生物浮床有效改变了养殖环境中的微生态平衡.
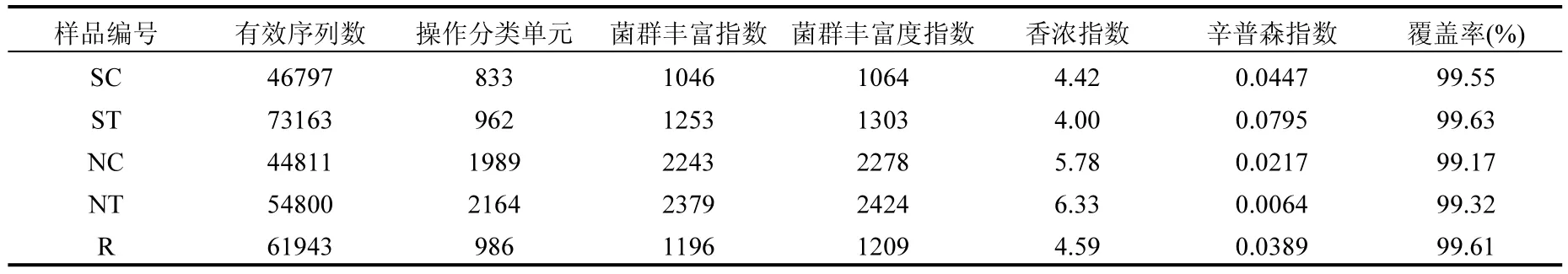
表2 样品的多样性指数Table 2 Alpha-diversity of the samples
2.3 菌群结构组成
对有效序列进行系谱分类,统计各个样品中重要的细菌门类及其相对丰度,共得到了10个重要菌门,分别是变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)、酸 杆 菌 门 (Acidobacteria)、 浮 霉 菌 门(Planctomycetes)和绿菌门(Chlorobi)(表3).研究结果表明,门类学水平上,实验组和对照组环境微生物中最丰富的优势菌门是变形菌门和蓝细菌门,但2个组别水环境中蓝细菌门的相对丰度明显高于其沉积物,变形菌门的相对丰度明显低于其沉积物.实验组和对照组水环境微生物群落中放线菌门和浮霉菌门的相对丰度均明显高于其沉积物,梭杆菌门和酸杆菌门的相对丰度均明显低于比其沉积物.空心菜根系微生物群落中的变形菌门和蓝细菌门占有绝对优势(52.80%和25.77%).
筛选出每类样品中相对丰度最高的前10种明确分类的微生物群落,并在菌属水平上对每类样品的菌群结构及分布进行统计分析(图2).实验组和对照组的水环境中最主要的优势菌属是聚球藻属(Synechococcus)、hgcI_clade、芽孢杆菌属(Bacillus)、CL500-29_marine_group、分支杆菌属(Mycobacterium)、CL500-3和Polynucleobacter等菌属.实验组和对照组的沉积物中最主要的优势菌属是聚球藻属、拟浮丝藻属(Planktothricoides)、芽孢杆菌属、鲸杆菌属(Cetobacterium)、Dechloromonas和厌氧粘细菌属(Anaeromyxobacter).实验组水环境中的聚球藻属、芽孢杆菌属、CL500-3和分支杆菌属的相对丰度均高于对照组,Polynucleobacter、CL500-29_marine_group和hgcI_clade的相对丰度均低于对照组,其中聚球藻属的相对丰度明显高于对照组,分别为42.16%和31.51%.实验组沉积物中的聚球藻属的相对丰度明显高于对照组,分别为5.19%和2.16%;拟浮丝藻属的相对丰度明显低于对照组,分别为2.35%和11.05%; Dechloromonas的相对丰度明显低于对照组,分别为1.95%和3.78%.空心菜根系的前10种优势菌落是红细菌属(Rhodobacter)、噬氢菌属(Hydrogenophaga)、聚球藻属、Meganema、红芽生菌属(Rhodoblastus)、芽孢杆菌属、Shinella、玫瑰弯菌属(Roseiflexus)、球衣菌属(Sphaerotilus)和罗尔斯通菌属(Ralstonia),其中红细菌属(7.68%)、噬氢菌属(3.73%)和聚球藻属(3.40%)占有绝对优势.除了拟浮丝藻属是一类水华蓝藻,以上提到的其他主要优势菌属都是有益菌类.综合这些结果,发现鱼菜共生模式下环境微生物的主要优势菌属是聚球藻属、hgcI_clade、CL500-29_marine_group、芽孢杆菌属和分支杆菌属等,空心菜根系微生物群落中主要优势菌属是红细菌属、噬氢菌属和聚球藻属等.研究结果表明空心菜生物浮床能够有效改善养殖环境中的微生态平衡.

表3 各样品中优势细菌门类及相对丰度(%)Table 3 Advantage bacterial phyla and the relative abundance of each sample (%)
2.4 氮循环细菌
根据《伯杰氏细菌分类手册(第九版)》[19]中对硝化细菌和反硝化细菌的分类和描述,本次研究中主要发现了2类硝化细菌菌属即亚硝化单胞菌属(Nitrosomonas)和硝化螺菌属(Nitrospira)和4类反硝化细菌菌属即假单胞菌属(Pseudomonas)、副球菌属(Paracoccus)、芽孢杆菌属和噬氢菌属(表4).根据研究结果可知实验组硝化细菌的相对丰度高于对照组,分别为0.786%和0.420%,尤其是实验组和对照组的沉积物微生物群落中含有大量的硝化细菌,分别为0.783%和0.419%;实验组的反硝化细菌的相对丰度也高于对照组,分别为4.973%和4.407%;空心菜根系微生物群落中含有大量的反硝化细菌(6.679%).这些结果表明沉积物中的硝化细菌的含量比水环境中硝化细菌的含量高,沉积物中的反硝化细菌的含量比水环境中反硝化细菌的含量低.研究结果还表明空心菜生物浮床可以有效地提高养殖环境中硝化细菌和反硝化细菌的含量,尤其是反硝化细菌,进而有利于保持较好的养殖环境.
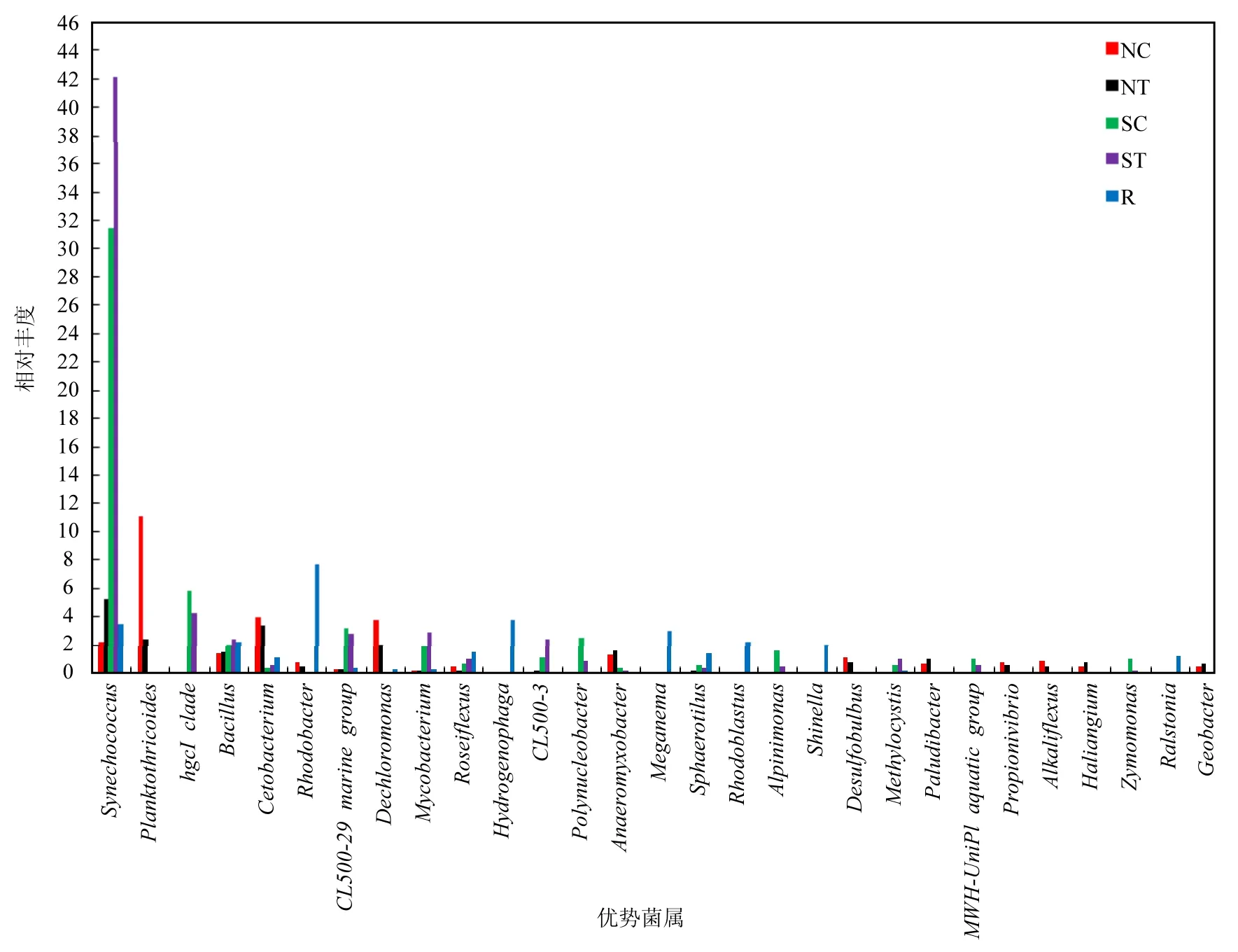
图2 各样品中的优势菌属及其相对丰度Fig.2 Relative abundance of the predominant genera in the samples
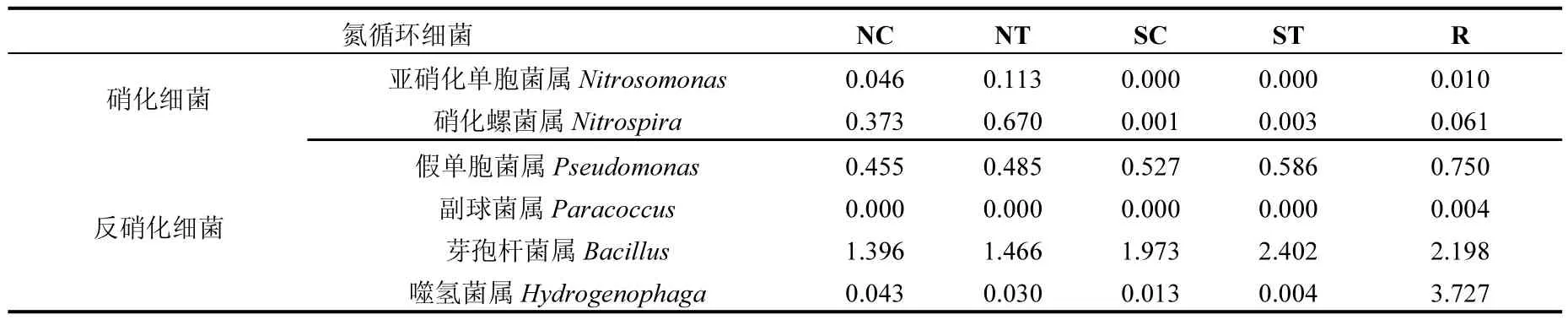
表4 氮循环细菌的组成及相对丰度(%)Table 4 The composition and relative abundance of nitrogen cycle bacteria (%)
2.5 微生物群落与环境因子之间的关系
为研究微生物群落与环境因子之间的关系,本实验将优势微生物群落与环境因子进行了冗余分析(RDA),如图3.
研究结果表明空心菜根系的优势菌落红细菌属、噬氢菌属、Meganema、红芽生菌属、Shinella、玫瑰弯菌属和球衣菌属等与DO和硝酸盐呈正相关关系,与亚硝酸盐和TAN呈现负相关关系.红细菌属与TN呈负相关关系.聚球藻属和分支杆菌属与所有的水质因子之间的相关性都很弱.芽孢杆菌属和罗尔斯通菌属与DO、硝酸盐和亚硝酸盐呈正相关关系,与 TN和 TAN之间呈负相关关系.拟浮丝藻属和Dechloromonas与TN和TAN呈正相关关系,与DO和硝酸盐呈负相关关系.
hgcI_clade、CL500-29_marine_group和Polynucleobacter与亚硝酸盐和TAN呈正相关关系,与DO和硝酸盐呈负相关关系.
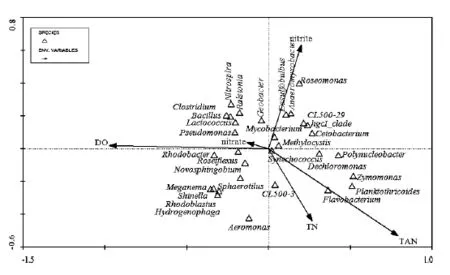
图3 优势菌属和环境因子的 RDA排序图Fig.3 RDA diagram of predominant genera and environmental factors
3 讨论
众多研究都表明生物浮床能够有效地去除水体中的污染物.有植物系统对废水中的总氮、BOD、SS、氨氮和重金属等的去除能力明显高于无植物系统[20],且生物浮床处能够大幅降低污水中的氨氮和总磷等污染物[11-14,21].大量研究表明空心菜生物浮床能够有效去除水体中的含氮化合物等污染物质[22-24].本研究也表明空心菜生物浮床能够有效降低水环境中的总氮、亚硝酸盐和总氨氮的浓度,但本研究还发现养殖过程中含氮化合物会不断积累[25],需要及时调节水质,保证健康养殖.
已有研究发现生物浮床会降低养殖水体中的溶解氧含量.由于生物浮床覆盖水面,阻碍了氧气的水溶作用,并降低了藻类的光合作用,导致水体“氧源”的减少[22],同时植物根系的呼吸作用及根际微生物的硝化与反硝化作用会消耗大量氧气[26].但也有学者研究发现当生物浮床覆盖率较低(≤20%)时,生物浮床对水体溶解氧浓度的影响不显著[27-28],覆盖率为7.5%的空心菜生物浮床对池塘整体的溶氧水平无显著影响[29].本研究的结果与黄海平[24]的研究结果一致,都发现鱼菜共生系统中水体的溶解氧浓度与对照组无显著差异,但却有所增加,这在生产应用等方面具有重要意义.原因可能是在低覆盖率(3.5%)条件下,空心菜生物浮床有效改善了养殖环境中的微生态平衡,这些微生物的变化最终产生了一种“综合效应”,有效地改善了养殖环境,促使水体中溶解氧含量增加以及含氮化合物浓度降低.
本研究发现鱼菜共生模式下养殖水环境中微生物具有高丰富度和低多样性,沉积物中微生物具有高丰富度和高多样性,而且有益微生物明显提高.本研究中养殖环境中有益微生物主要有聚球藻属、CL500-29_marine_group、hgcI_clade、芽孢杆菌属和分支杆菌属等,空心菜根系微生物菌落中还有大量的有益微生物如红细菌属、噬氢菌属和聚球藻属等,这些微生物都是有益的优势菌属.聚球藻属是一类原核超微藻类,是初级生产力的主要参与者和贡献者,在生态系统的光合作用、碳循环及食物链中具有重要作用[30].芽孢杆菌属和分支杆菌属是以多环芳烃(PAHs)为唯一碳源的微生物[31],且芽孢杆菌属还兼具反硝化作用.菌群结构组成表明实验组的芽孢杆菌属的相对丰度高于对照组,RDA分析表明芽孢杆菌属与DO、硝酸盐和亚硝酸盐之间呈正相关关系,与TN和 TAN之间呈负相关关系,推测芽孢杆菌属可能通过降解水体中的碳源污染物和反硝化作用,促进养殖环境的氮循环等,并与环境因子相互影响,提高水体DO,改善养殖环境.hgcI_clade具有很强的吸收碳水化合物和富氮化合物的遗传能力[32],并耐受较低的DO浓度[33],还能利用低温水中的低浓度溶解有机碳,而CL500-29_marine_ group能够有效利用多种形式的碳化合物[34].菌群结构组成表明实验组的hgcI_clade和CL500-29_marine_group的相对丰度低于对照组, RDA分析表明hgcI_clade和CL500-29_ marine_group与亚硝酸盐和TAN呈正相关关系,与DO和硝酸盐呈负相关关系,推测hgcI_clade和CL500-29_marine_group通过促进碳循环和氮循环等,并与环境因子相互影响,改善养殖环境.红细菌属是一类高效净化水质的光合细菌,兼具反硝化作用[35],噬氢菌属是一类反硝化细菌.菌群结构组成表明实验组空心菜根系微生物中含有大量的红细菌属和噬氢菌属,且RDA分析表明红细菌属和噬氢菌属与DO和硝酸盐呈正相关关系,与TAN和亚硝酸盐呈现负相关关系,而且红细菌属还与TN呈负相关关系,推测红细菌属和噬氢菌属可能通过光合作用、硝化作用和反硝化作用等促进养殖环境的氮循环等,并与环境因子相互影响,改善养殖环境.本研究还发现空心菜生物浮床可以有效地提高养殖环境中硝化细菌和反硝化细菌的含量,尤其在植物根系存在大量的反硝化细菌.氨氮可在富氧区被硝化细菌以硝化作用氧化为硝态氮,而硝态氮则在缺氧区中被反硝化细菌以反硝化作用还原为分子态氮而进入大气中[36].生物浮床的覆盖区存在“富氧—厌氧微环境”区,可为微生物的活动提供有利条件[37-38],使氮循环细菌中的不同类型细菌能够同时存在,促进水体氮循环[39].“富氧—厌氧微环境”区的同时或交替存在还可促进根区微生物的生长和繁殖,从而提高生物浮床系统对污染物的去除效率[40-41].正是在这些优势微生物的“综合效应”下,鱼菜共生模式下水环境中溶解氧含量相对较高,含氮化合物浓度相对较低,促使养殖环境更优良,更有利于健康养殖.
本研究中鱼菜共生模式下环境微生物主要是优势菌门是变形菌门和蓝细菌门、拟杆菌门、放线菌门、绿弯菌门、厚壁菌门、梭杆菌门、酸杆菌门、浮霉菌门和绿菌门,主要菌属是聚球藻属、芽孢杆菌属和分支杆菌属等,空心菜根系微生物菌落中主要菌属是红细菌属、噬氢菌属和聚球藻属等.本研究的结果与其他研究者的结果存在一定的差异.众多学者研究表明淡水水体中微生物主要属于变形菌门、放线菌门、拟杆菌门、蓝细菌门、疣微菌门和浮霉菌门等[42-44],优势菌属为嗜胞菌属(Cytophaga)、黄杆菌属(Flavobacterium)、伯克氏菌属(Burkholderia)等[42],植物根际优势菌属以假单胞菌属、微球菌属(Micrococcus)、金黄杆菌属(Chryseobacterium)和不动杆菌属(Acinetobacter)等微生物为主[45-47].导致存在差异的主要原因是水体微生物群落结构受自然环境和水体环境因子如光照、温度、pH值、水流、风速等条件的影响[48],水生植物根际微生物多样性受植物类型、植物长势、水体环境因子等多种因素的相互影响[49],另外技术进步和研究方法也会导致差异的出现[48].
4 结论
采用宏基因组学测序技术和生物信息学手段,分析了环境微生物和根系微生物群落的多样性.研究结果表明鱼菜共生模式下优势菌门是变形菌门、蓝细菌门、拟杆菌门、放线菌门、绿弯菌门和厚壁菌门等,主要菌属是聚球藻属、hgcI_clade、CL500-29_marine_group、芽孢杆菌属和分支杆菌属等;空心菜根系微生物群落中最丰富的优势菌门是变形菌门和蓝细菌门,主要菌属是红细菌属、噬氢菌属和聚球藻属等.研究结果还表明低覆盖率(3.5%)的空心菜生物浮床能够增加水体的溶解氧含量,降低水体中含氮化合物的浓度和改善养殖环境中的微生态平衡,提高有益菌和氮循环细菌的含量.
[1] Cahill P L, Hurd C L, Lokman M. Keeping the water clean -Seaweed biofiltration outperforms traditional bacterial biofilms in recirculating aquaculture [J]. Aquaculture, 2010:153-159.
[2] Randall D J, Wright P A. Ammonia distribution and excretion in fish [J]. Fish Physiology & Biochemistry, 1987,3:107-120.
[3] Wright P A. Nitrogen excretion: three end products, main physiological roles [J]. Journal of Experimental Biology, 1995,198:273-281.
[4] Randall D J, Tsui T K N. Ammonia toxicity in fish [J]. Marine Pollution Bulletin, 2002,45:17-23.
[5] Thurston R V, Russo R C. Acute toxicity of ammonia to rainbow trout [J]. Transactions of the American Fisheries Society, 1983,112:696-704.
[6] 余瑞兰,聂湘平,魏泰莉,等.分子氨和亚硝酸盐对鱼类的危害及对策 [J]. 中国水产科学, 1997,6(3):73-77.
[7] 郭增华,王秋燕.亚硝酸盐氮对方斑东风螺毒性的研究 [J]. 海洋水产研究, 2006,27:88-92.
[8] Sun L P, Liu Y, Jin H. Nitrogen removal from polluted river by enhanced floating bed grown canna [J]. Ecological Engineering,2009,35:135-140.
[9] Lin Y F, Jing S R, Lee D Y, et al. Nutrient removal from aquaculture wastewater using a constructed wetlands system [J]. Aquaculture, 2002,209:169-184.
[10] Zhu L D, Li Z H, Ketola T. Biomass accumulations and nutrient uptake of plants cultivated on artificial floating beds in China's rural area [J]. Ecological Engineering, 2011,37:1460-1466.
[11] 宋祥甫,邹国燕,吴伟明,等.浮床水稻对富营养化水体中氮、磷的去除效果及规律研究 [J]. 环境科学学报, 1998,18: 489-495.
[12] 刘淑媛,任久长,由文辉.利用人工基质无土栽培经济植物净化富营养化水体的研究 [J]. 北京大学学报(自然科学版),1999,35:518-522.
[13] 司友斌,包军杰,曹德菊,等.香根草对富营养化水体净化效果研究 [J]. 应用生态学报, 2003,14:277-279.
[14] 周小平,王建国,薛利红,等.浮床植物系统对富营养化水体中氮、磷净化特征的初步研究 [J]. 应用生态学报, 2005,16:2199-2203.
[15] HJ 636-2012 水质-总氮的测定-碱性过硫酸钾消解紫外分光光度法 [S].
[16] HJ 535-2009 水质-氨氮的测定-纳氏试剂分光光度法 [S].
[17] GB 7493-87 水质-亚硝酸盐氮的测定-分光光度法 [S].
[18] GB 7480-87 水质-硝酸盐氮的测定-酚二磺酸分光光度法[S].
[19] Holt J G, Krieg N R, Sneath P H A, et al. Bergey's Manual of Determinative Bacteriology,9thEdition [M]. Baltimore,Lippincott Williams & Wilkins, 1994,10-786.
[20] Dunbabin J S, Pokorny J, Bowmer K H. Rhizosphere oxygenation by Typha domingensis Pers. in miniature artificial wetland filters used for metal removal from wastewaters [J]. Aquatic Botany, 1988,29:303-317.
[21] Amanda M N, William J M. Tropical treatment wetlands dominated by free-floating macrophytes for water quality improvement in Costa Rica [J]. Ecological Engineering, 2006: 246-257.
[22] 林连升.精养鱼池水质生物净化初步研究 [D]. 南京:南京农业大学, 2006.
[23] Li M, Wu Y J, Yu Z L, et a1. Nitrogen removal from eutrophic water by floating-bed-grown water spinach (Ipomoea aquatica Forsk.) with ion implantation [J]. Water Research, 2007,41:3152—3158.
[24] 常会庆,寇太记,乔鲜花,等.几种植物去除污染水体中养分效果研究 [J]. 水土保持通报, 2009,5:118-122.
[25] 李 谷,吴振斌,侯燕松,等.养殖水体氮的生物转化及其相关微生物研究进展 [J]. 中国生态农业学报, 2006,14(1):11-15.
[26] 雷衍之.养殖水环境化学 [M]. 北京:中国农业出版社, 2004: 119-112.
[27] 陈家长,孟顺龙,胡庚东,等.空心菜浮床栽培对集约化养殖鱼塘水质的影响 [J]. 生态与农村环境学报, 2010,26(2):155-159.
[28] 宋 超,陈家长,戈贤平,等.浮床栽培空心菜对罗非鱼养殖池塘水体中氮和磷的控制 [J]. 中国农学通报, 2011,27(23):70-75.
[29] 黄海平.水蕹菜浮床在精养鱼池中的应用效果研究 [D]. 武汉:华中农业大学, 2012.
[30] 李胜男,周 建,魏利军,等.淡水超微型浮游植物多样性及其研究方法 [J]. 生态学杂志, 2015,34(4):1174-1182.
[31] 霍炜洁,肖晶晶,黄亚丽,等.微生物技术修复水污染的研究进展[J]. 生物技术通报, 2008,4:94-98.
[32] Ghylin T W, Garcia S L, Moya F, et al. Comparative single-cell genomics reveals potential ecological niches for the freshwater acⅠ Actinobacteria lineage [J]. Ⅰsme Journal, 2014,8(12):2503-2516.
[33] Liu J W, Fu B B, Yang H M, et al. Phylogenetic shifts of bacterioplankton community composition along the Pearl Estuary: the potential impact of hypoxia and nutrients [J]. Frontiers in Microbiology, 2015,6:64.
[34] Lindh M V, Lefebure R, Degerman R, et al. Consequences of increased terrestrial dissolved organic matter and temperature on bacterioplankton community composition during a Baltic Sea mesocosm experiment [J]. Ambio, 2015,44Suppl 3(3):402-12.
[35] 郑耀通,胡开辉,高树芳,等.高效净化水产养殖水域紫色非硫光合细菌的分离和筛选 [J]. 福建农业大学学报, 1998,27(3):257-260.
[36] Reddy K R, Patrick W H, Lindau C W. Nitrificationdenitrification at the plant root-sediment interfaces in wetlands[J]. Limnology and Oceanography, 1989,34(6):1004-1013.
[37] Stottmeister U, Wießner A, Kuschk P, et al. Effects of plants and microorganisms in constructed wetlands for wastewater treatment[J]. Biotechnology Advances, 2003,22:93-117.
[38] 胡绵好.水生经济植物浮床技术改善富营养化水体水质的研究[D]. 上海:上海交通大学, 2008.
[39] 吴 伟,胡庚东,金兰先,等.浮床植物对池塘水体微生物的动态影响 [J]. 中国环境科学, 2008,28(9):791-795.
[40] Huetta D O, Morrisb S G, Smitha G, et al. Nitrogen and phosphorus removal from plant nursery runoff in vegetated and unvegetated subsurface flow wetlands [J]. Water Research, 2005,39:3259-3272.
[41] Keffala C, Ghrabi A. Nitrogen and bacterial removal in constructed wetlands treating domestic waste water [J]. Desalination, 2005,185(1-3):383-389.
[42] Jürg B L, Helmut B, Christopher T R. Progress in the Ecological Genetics and Biodiversity of Freshwater Bacteria [J]. Bioscience,2008,58(2):103-113.
[43] Eiler A, Bertilsson S. Composition of freshwater bacteria communities associated with cyanobacterial blooms in four Swedish lakes [J]. Environmental Microbiology, 2004,16:1228-1243.
[44] Tamaki H, Sekiguchi Y, Hanada S, et al. Comparative analysis of bacterial diversity in freshwater sediment of a shallow eutrophic lake by molecular and improved cultivation-based techniques [J]. Applied & Environmental Microbiology, 2005,71:2162-2169.
[45] 詹发萃,邓家齐,夏宜琤,等.凤眼莲根区异养细菌的群落特征与异养活性的研究 [J]. 水生生物学报, 1993,17(2):150-156.
[46] 张甲耀,林清华,夏盛林,等.不同植物构成的潜流型人工湿地处理系统的净化能力及其异养细菌数量的研究 [J]. 环境工程,1998,16(3):17-20.
[47] 陆开宏,胡智勇,梁晶晶,等.富营养水体中2种水生植物的根际微生物群落特征 [J]. 中国环境科学, 2010,30(11):1508-1515.
[48] 王绍祥,杨洲祥,孙 真,等.高通量测序技术在水环境微生物群落多样性中的应用 [J]. 化学通报, 2014,77(3):196-303.
[49] Wasaki J, Rothe A, Kania A. Root exudation, Phosphorus acquisition and microbial diversity in the rhizosphere of white lupine as affected by phosphorus supply and atmospheric carbon dioxide concentration [J]. Journal of Environmental Quality, 2005,34(6):2157-2167.
Influence on water quality and microbial diversity in fish pond by Ipomoea aquatica floating-bed.
LI Jian-zhu, HOU Jie, ZHANG Peng-fei, LIU Yao-quan, XIA Run-hong, MA Xu-fa*(Huazhong Agricultural University, Wuhan 430070,China). China Environmental Science, 2016,36(10):3071~3080
In order to investigate the influence on water quality and microbial diversity in intensive fish pond by Ipomoea aquatica floating-bed, and the composition and diversity of microbial communities in the samples were researched based on high throughput sequencing of 16S rRNA gene. The results revealed that the dominant bacteria were phyla Proteobacteria, Cyanobacteria, Bacteroidetes, Actinobacteria, Chloroflexi and Firmicutes, the dominant bacteria were genera Synechococcus, hgcI_clade, CL500-29_marine_group, Bacillus and Mycobacterium in the Aquaponics System,and the most dominant bacteria of rhizosphere microorganisms were phyla Proteobacteria and Cyanobacteria, the dominant bacteria were genera Rhodobacter, Hydrogenophaga and Synechococcus. Moreover, the results also showed that low coverage (3.5%) of Ipomoea aquatica floating-bed increased the dissolved oxygen content and reduced the concentration of nitrogen compounds, and improved micro-ecological balance and increased the content of the beneficial bacteria and nitrogen cycle bacteria in aquaculture water body.
Ipomoea aquatica floating-bed;environmental microbial diversity;water quality;16S rDNA
X171.1,S917.1
A
1000-6923(2016)10-3071-10
李建柱(1990-),男,湖北孝感人,华中农业大学硕士研究生,主要研究方向为养殖水环境生物监测与调控.
2016-02-18
国家科技支撑计划课题(2012BAD25B05)和湖北省自然科学基金(2013CFA095)资助
* 责任作者, 副教授, xufama@mail.hzau.edu.cn
