OGT在食管癌中的表达及其与临床预后的关系
2016-10-29马震川马跃峰孔冉冉孙良璋李少民
马震川, 马跃峰, 孔冉冉, 孙良璋, 乔 哲, 李少民
(西安交通大学第二附属医院胸外科,西安 710004;*通讯作者,E-mail:li51487@163.com)
OGT在食管癌中的表达及其与临床预后的关系
马震川, 马跃峰, 孔冉冉, 孙良璋, 乔 哲, 李少民
(西安交通大学第二附属医院胸外科,西安 710004;*通讯作者,E-mail:li51487@163.com)
目的 探讨O-GIcNAc转移酶(O-GicNAc transferase,OGT)在食管癌组织中的表达情况及其与预后的关系。 方法 收集66例食管癌组织标本及其对应癌旁组织标本,利用免疫组化法测定OGT蛋白的表达,并与患者的临床资料相结合。比较OGT表达与年龄、性别、淋巴结转移、肿瘤分化和TNM分期之间的关系,并结合随访资料分析OGT表达和临床预后的关系。 结果 66个肿瘤标本中,51例(77.27%)阳性表达,15例(22.73%)阴性表达。癌旁正常组织中OGT阳性表达率为21.21%(14/66)。OGT的表达还与TNM分期、病理分化相关(P<0.001),与年龄、性别和淋巴结转移无关(P>0.05)。OGT阳性表达和阴性表达食管癌患者的3年生存率分别为43.7%和64.2%,两者比较差异有统计学意义(P=0.003)。 结论 OGT可能被用作预测食管癌预后的良好指标。
食管癌; OGT; 预后
食管癌是我国最常见的恶性肿瘤之一,赫捷院士于2016年1月在CACancerJClin杂志上发表的《2015中国癌症统计数据》显示食管癌位于我国癌症发病率排行榜第三位[1]。因此对食管癌发生发展机制的深入研究是早期诊断和治疗食管癌、提高患者生存率的关键。O-GIcNAc 转移酶(O-GIcNAc transferase,OGT)是调控氧连接的氮乙酰葡糖胺(O-GIcNAc)的重要蛋白,O-GIcNAc可以介导细胞浆和细胞核蛋白质丝氨酸和苏氨酸上的动态、可逆的翻译后修饰,是一种磷酸化修饰[2]。本文旨在研究OGT蛋白在食管癌组织中的表达,并分析 OGT的表达与食管癌临床病理特征及预后的关系,评估 OGT作为食管癌的一种新型预后标志物的潜力。
1 材料与方法
1.1 临床资料
收集西安交通大学第二附属医院胸外科2011-01~2013-12的66 例食管癌组织,并配对正常食管黏膜组织(距离病灶>5 cm,经病理证实无肿瘤细胞浸润)作为对照,所取标本均由病理学证实为食管鳞状细胞癌。66名病患中男性41例,女性35例,年龄40-80岁,平均年龄(54.24±7.41)岁;所有病患术中、术前均未接受放、化疗及免疫治疗,患者对实验内容均知情同意,并该研究获得西安交通大学第二附属医学伦理委员会同意。
1.2 采用免疫组化检测OGT表达
常规玻片脱蜡、水化;抗原修复:按试剂盒说明书进行操作,60 ℃脱蜡60 min;石蜡切片脱蜡水化;30 ml/L H2O2。室温10 min以灭活内源性酶;98 ℃微波抗原15 min;切片浸于30 ml/L H2O2中,室温下灭活过氧化物酶10 min;一抗(1∶100稀释)4 ℃孵育过夜,设置PBS代替一抗性做阴对照组;聚合HRP标记二抗37 ℃孵育30 min;DAB显色5 min;苏木素复染2 min;组织切片依次经过梯度酒精(70%,80%,95%,100%)脱水,二甲苯透明化,中性树脂封片。
1.3 结果的判读
免疫组化染色结果由西安交通大学第二附属医院两个未接触过患者临床病理资料的病理科医生以双盲法分别进行评估。染色强度具体标准如下:-(阴性),+(弱黄色),++(黄色或深黄)和+++(褐色或深褐色)。
1.4 统计学方法
采用SPSS 18.0进行处理。采用检验OGT在食管黏膜组织中阳性表达率的差异;采用Kaplan-Meier方法进行生存分析,并采用Log-rank检验比较两组生存率;P<0.05为差异有统计学意义。
2 结果
2.1 食管癌组织和癌旁正常组织中OGT蛋白表达
运用免疫组化(SP法)检测66例食管癌组织和对应癌旁正常组织中OGT的阳性表达,可见棕黄色为阳性染色,OGT的阳性染色主要定位于细胞核,在胞质中也有少量阳性表达(见图1)。免疫组化检测结果显示,在食管癌组织中,OGT的阳性表达率为77.27%(51/66),而癌旁正常组织OGT的阳性表达率为21.21%(14/66),两者比较差异具有统计学意义(P<0.05)。

A.食管癌组织阳性表达 B.癌旁组织阴性表达 图1 免疫组化显示OGT蛋白在食管癌组织和癌旁组织中的表达 (×200)Figure 1 The expression of OGT of esophageal cancer tissue and paracancerous tissue by immunohistochemistry (×200)
2.2 OGT的阳性表达率与临床病理特征的关系
食管癌组织中OGT在高分化癌的阳性表达为70.0%(14/20),在中低分化癌的阳性表达为80.4%(37/46),两者间差异有统计学意义(P<0.001)。OGT阳性表达与TNM分期有关,在不同TNM分期间差异有统计学意义(P<0.001):Ⅰ期65.0%(13/20),Ⅱ期76.0%(19/25),Ⅲ期86.7%(13/15),Ⅳ期100.0%(6/6)。OGT表达量在不同性别、不同年龄和有无淋巴结转移间差异无统计学意义(P>0.05,见表2)。
表1 OGT表达与临床病理特征的关系例(%)
Table 1 Relationship between OGT expression and clinicopathological features cases(%)
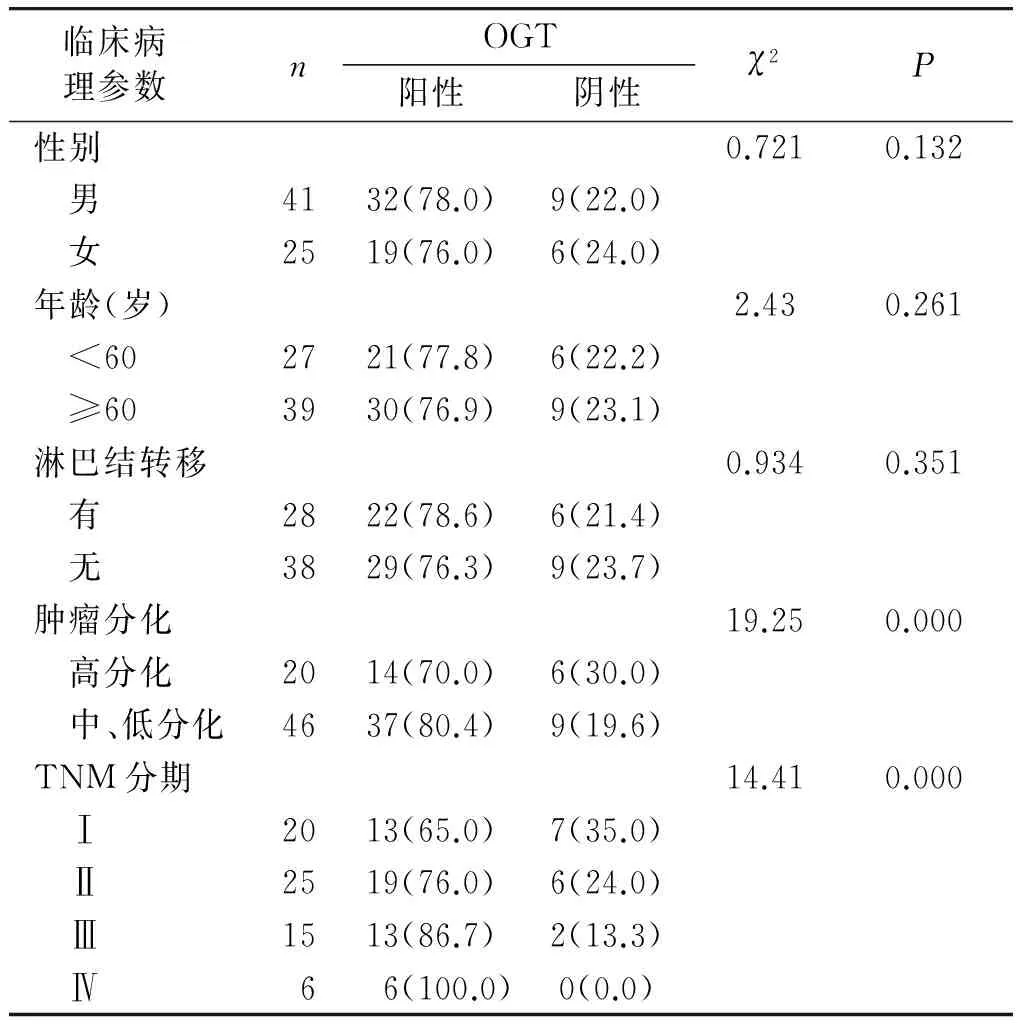
临床病 理参数 nOGT阳性阴性χ2P性别0.7210.132 男4132(78.0)9(22.0) 女2519(76.0)6(24.0)年龄(岁)2.430.261 <602721(77.8)6(22.2) ≥603930(76.9)9(23.1)淋巴结转移0.9340.351 有2822(78.6)6(21.4) 无3829(76.3)9(23.7)肿瘤分化19.250.000 高分化2014(70.0)6(30.0) 中、低分化4637(80.4)9(19.6)TNM分期14.410.000 Ⅰ2013(65.0)7(35.0) Ⅱ2519(76.0)6(24.0) Ⅲ1513(86.7)2(13.3) Ⅳ6 6(100.0)0(0.0)
2.3 OGT表达与食管癌患者生存时间的关系
为了说明OGT与食管癌预后的关系,我们对基于Kaplan-Meier对66例患者进行生存分析,结果显示:OGT阳性表达和阴性表达食管癌患者的3年生存率分别为43.7%和64.2%,两者间差异有统计学意义(χ2=8.13,P=0.003,见图2)。

图2 食管癌组织中OGT表达阳性组和阴性组的生存曲线图Figure 2 The postoperative survival curves of esophageal cancer patients with positive or negative OGT expression
多因素分析显示,肿瘤分化(P=0.006)、TNM分期(P<0.001)和OGT阳性表达(P<0.001)是食管癌患者总生存期的独立预后因素(见表2)。
表2 食管癌患者总生存期多因素Cox回归分析
Table 2 Survival analysis of 66 esophageal cancer patients by Log-rank

因素 阳性率[例(%)]χ2dfP肿瘤分化6.33210.006 高分化14(70.0) 中和低分化37(80.4)TNM分期15.57330.000 Ⅰ13(65.0) Ⅱ19(76.0) Ⅲ13(86.7) Ⅳ6(100.0)OGT表达14.53210.000 阳性51(77.3) 阴性15(22.7)
3 讨论
OGT基因位于X染色体上的Xq13.1区域,同时存在于细胞核和细胞质中,细胞核中丰度较高[3,4]。O-GIcNAc糖基化需要两个酶的参与:β-N-乙酞氨基葡萄糖转移酶(OGT)和β-N-乙酞氨基葡萄糖普酶(OGA)。其中OGT负责O-GIcNAc的添加,OGA负责O-GIcNAc的移除[5]。肿瘤细胞利用葡萄糖的速率显著增加,而O-GIcNAc修饰水平则可以调控进入细胞的葡萄糖浓度。O-GIcNAc糖基化可以影响肿瘤细胞的增殖、糖酵解途径和磷酸戊糖代谢途径[6]。多种癌基因和抑癌基因参与调控O-GIcNAc糖基化修饰,如P53、c-Myc、FOXO和CREB1等[7,8]。研究表明,OGT在乳腺癌[9]、结肠癌[10]、甲状腺癌[11]、前列腺癌[12]等恶性肿瘤中高表达。OGT的高表达不但与肿瘤的增殖有关,而且与肿瘤的复发、转移密切相关。在肝癌患者中,复发转移的患者OGT水平明显升高,提示OGT与肝癌的复发转移密切相关[13]。
本研究运用免疫组化方法检测食管癌组织及癌旁组织中OGT蛋白的表达,结果提示OGT主要表达于食管癌细胞中,而在癌旁组织中主要呈阴性表达,这与OGT在多种类型肿瘤阳性表达相符合。此外,我们分析了OGT的表达与临床病理特征的相关性,结果表明,OGT与病理分化和TNM分期密切相关。高分化鳞癌中阳性率明显低于中低分化鳞癌,而食管鳞状细胞癌分化程度越低,其恶性程度越大,这提示OGT在食管癌的分化、增殖中起重要作用。随着TNM分期变晚,OGT阳性表达率逐渐增加,提示OGT在食管癌的侵袭、转移中起重要作用。OGT阳性表达率与性别、年龄和淋巴结转移无明显相关性。OGT阳性表达和阴性表达食管癌患者的3年生存率分别为43.7%和64.2%,这说明OGT的阳性表达提示食管癌的预后不良。多因素生存分析表明,肿瘤分化、TNM分期和OGT表达是食管癌患者总生存期的独立预后因素。
综上所述,OGT蛋白在食管癌中表达上调,与病理分化、TNM分期和预后密切相关。因此,OGT可作为判断食管癌侵袭转移及预后的新靶点。
[1] Chen W,Zheng R,Baade PD,etal.Cancer statistics in China, 2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Baldini SF,Lefebvre T.O-GIcNAcylation and the metabolic shift in high-proliferating Cells:All the evidence suggests that sugars dictate the flux of lipid biogenesis in tumor processes[J].Front Oncol,2016,6:6.
[3] Ma X,Liu P,Yan H,etal.Substrate specificity provides insights into the sugar donor recognition mechanism of O-GlcNAc transferase(OGT)[J].PLoS One,2013,8(5):e63452.
[4] Selvan N,Mariappa D,van den Toorn HW,etal.The early metazoan trichoplax adhaerens possesses a functional O-GIcNAc system[J].J Biol Chem,2015,290(19):11969-11982.
[5] Hart GW,Housley MP,Slawson C.Cycling of O-linked beta-N-acetylglucosamine on nucleocytoplasmic proteins[J].Nature,2007,446(7139):1017-1022.
[6] Yi W,Clark PM,Mason DE,etal.Phosphofructokinase 1 glycosylation regulates cell growth and metabolism[J].Science,2012,337(6097):975-980.
[7] Yang WH,Kim JE,Nam HW,etal.Modification of p53 with O-linked N-acetylglucosamine regulates p53 activity and stability[J].Nat Cell Biol,2006,8(10):1074-1083.
[8] Gregory MA,Qi Y,Hann SR.Phosphorylation by glycogen synthase kinase-3 controls c-myc proteolysis and subnuclear localization[J].J Biol Chem,2003,278(51):51606-51612.
[9] Krzeslak A,Forma E,Bernaciak M,etal.Gene expression of O-GIcNAc cycling enzymes in human breast cancers[J].Clin Exp Med,2012,12(1):61-65.
[10] Mi W,Gu Y,Han C,etal.O-GIcNAcylation is a novel regulator of lung and colon cancer malignancy[J].Biochim Biophys Acta,2011,1812(4):514-519.
[11] Singh JP,Zhang K,Wu J,etal.O-GIcNAc signaling in cancer metabolism and epigenetics[J].Cancer Lett,2015,356(2 Pt A):244-250.
[12] Lynch TP,Ferrer CM,Jackson SR,etal.Critical role of O-Linked beta-N-acetylglucosamine transferase in prostate cancer invasion, angiogenesis,and metastasis[J].J Biol Chem,2012,287(14):11070-11081.
[13] Caldwell SA,Jackson SR,Shahriari KS,etal.Nutrient sensor O-GIcNAc transferase regulates breast cancer tumorigenesis through targeting of the oncogenic transcription factor FoxM1[J].Oncogene,2010,29(19):2831-2842.
Expression of OGT in esophageal cancer and its relationship with clinical outcome
MA Zhenchuan, MA Yuefeng, KONG Ranran, SUN Liangzhang, QIAO Zhe, LI Shaomin*(DepartmentofThoracicSurgery,SecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China;*Correspondingauthor,E-mail:li51487@163.com)
ObjectiveTo investigate the expression of O-GIcNAc transferase(OGT) in the esophageal cancer and its relationship with prognosis.MethodsEsophageal cancer tissues and the corresponding paracancerous tissues were collected from 66 esophageal cancer patients. The expression of OGT was measured by immunohistochemistry and the correlation between OGT expression and clinicopathological parameters and prognosis were analyzed.ResultsOf the 66 tumor specimens,51(77.27%) were positive and 15(22.73%) were negative. The positive rate of OGT was 21.21%(14/66) in paracancerous tissues. The overexpression of OGT was also positively associated with TNM stage and differentiation(P<0.001). However, it was not significantly associated with age, gender and lymph node metastasis(P>0.05). The 3-year survival rate in patients with high OGT expression was lower than that with low expression(43.7%vs64.2%,P=0.003).ConclusionOGT may be used as a novel biomarker for predicting the prognosis of esophageal cancer.
esophageal cancer; OGT; prognosis
陕西省科技攻关基金资助项目(2015SF058)
马震川,男,1987-09生,硕士,住院医师, E-mail:sxxa1316@sina.com
2016-04-28
R735.1
A
1007-6611(2016)09-0826-04
10.13753/j.issn.1007-6611.2016.09.010
