低级别胶质瘤36例患者术后放疗的预后分析
2016-10-29周苏娜张琰君何东杰张明鑫
周苏娜, 张琰君, 何东杰, 张明鑫, 梁 军
(1第四军医大学唐都医院放疗科,西安 710038; 2第四军医大学唐都医院消化科;*通讯作者, E-mail:zmx3115@163.com;#共同通讯作者,E-mail:liangjun1964@126.com)
低级别胶质瘤36例患者术后放疗的预后分析
周苏娜, 张琰君, 何东杰, 张明鑫, 梁 军
(1第四军医大学唐都医院放疗科,西安 710038;2第四军医大学唐都医院消化科;*通讯作者, E-mail:zmx3115@163.com;#共同通讯作者,E-mail:liangjun1964@126.com)
目的 分析低级别胶质瘤患者的临床特点及预后影响因素。 方法 以在我院就诊被确诊为低级别胶质瘤且完成术后放疗的36例患者为研究对象,分析其临床特点,对患者进行随访,根据年龄(≥40岁)、星形细胞瘤、肿瘤体积(≥60 cm3)、肿瘤跨中线作为高危因素,以具备≥3项高危因素的为高危组,<3项高危因素的为低危组,分析影响预后的因素。 结果 低级别胶质瘤的临床表现以癫痫、头痛头晕及无力居多。36例低级别胶质瘤患者的中位生存期(OS)为48.7个月,中位无进展生存期(PFS)为45.8个月。1年生存率为91.7%,2年生存率为76.6%。1年无进展生存率为88.7%,2年无进展生存率为69.3%。高危组的中位OS为26.4个月,中位PFS为21个月,低危组的中位OS为48.9个月,中位PFS为46.7个月。高危组与低危组的OS、PFS均存在统计学差异(P=0.036,0.026)。 结论 高危因素可用来预测对胶质瘤术后放疗患者生存期,且具备<3项高危因素的低危组低级别胶质瘤患者的预后优于高危组患者。
低级别胶质瘤; 放疗; 生存期; 无进展生存期
低级别胶质瘤(low-grade gliomas,LGGs)是成人脑肿瘤中第二常见的肿瘤,多见于年轻的成人,男性较女性多见[1]。LGG易复发,组织病理学类型主要包括弥漫性星形细胞瘤、少突-星形细胞瘤和少突胶质细胞瘤[2]。虽然手术切除是LGG的主要治疗手段,但是因为受肿瘤位置及最大限度保护神经功能的原则限制,大部分肿瘤无法完全切除,具有高危因素或术后残留的患者建议行放疗或化疗。本文以我院就诊并被确诊为低级别胶质瘤的36例患者为研究对象,分析其临床特点及预后影响因素,旨在为如何提高LGG临床获益的进一步研究提供参考。
1 资料与方法
1.1 一般资料
选取2013-01~2014-03在唐都医院神经外科就诊被确诊为低级别胶质瘤行不同程度手术切除后,于本院放疗科完成术后放疗的36例患者为研究对象。男26例,女10例;年龄6-64岁,平均(38±12)岁;肿瘤分布部位额叶16例,顶叶6例,颞叶7例,枕叶2例,小脑、侧脑室、脊髓、丘脑及基底节各1例;累及≥2个脑叶6例。肿瘤全切除10例,部分切除24例,活检2例。5例为术后超过12周因肿瘤复发接受放疗,余手术至放疗间隔(4.9±1.8)周。
1.2 方法
1.2.1 治疗方法 放疗采用瓦里安直线加速器,6MV-X射线和三维治疗计划系统。使用热塑头模进行头部固定,激光灯摆位,然后行CT连续增强扫描,扫描层厚5 mm,获得影像资料,传入TPS系统,勾画治疗靶区。肿瘤靶区(gross tumor volume,GTV):术前MRI T1增强、FLAIR/T2上的异常信号区域,临床靶区(clinical target volume, CTV):GTV/术腔边缘外扩1-2 cm,计划靶区(plan target volume,PTV):CTV外扩0.3-0.5 cm。要求90%-95%等剂曲线包括PTV,经CT扫描校位验证后实施。放疗剂量为DT 1.8-2.0 Gy/次×27次,5次/周。放疗期间及放疗后2 周根据患者治疗反应情况给予20%甘露醇及地塞米松,减轻脑水肿反应。
1.2.2 观察指标 观察分析患者的临床特点如临床表现、病理类型及是否具有高危因素(包括年龄≥40岁,星形细胞瘤,肿瘤体积≥60 cm3,肿瘤跨中线)。
所有患者均于放疗前行头颅强MRI或CT检查,判断残留肿瘤大小,并在治疗后1个月复查强化MRI或CT,以后每4-6个月复查头颅增强化MRI或CT。评估1年和2年疾病无进展生存率、1年和2 年总生存率。
1.3 统计学分析
使用GraphPad Prism 5.0软件的survival分析资料, 比较采用Log-rank(Mantel-Cox)Test分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床特点分析
临床表现癫痫者占25.0%(9/36),头痛头晕者占36.1%(13/36),无力者占22.2%(8/36),视力改变者占2.8%(1/36),颅神经症状者占5.6%(2/36),无症状者占13.9%(5/36)。病理类型为星形细胞瘤的为18例,少突-星形9例,毛细胞星形细胞瘤1例,少突细胞瘤1例,多形性黄色瘤型星形细胞瘤1例,具体细胞类型不详的6例;无高危因素的5例,1项高危因素的12例,2项高危因素的7例,3项高危因素的12例。跨中线10例,未跨中线26例;≥40岁的17例,<40岁的19例;肿瘤体积≥60 cm3的19例,<60 cm3的17例。
2.2 生存分析
36例LGG的中位OS为48.7个月,生存曲线见图1。1年生存率为91.7%,2年生存率为76.6%。跨中线的中位OS为31.2个月,未跨中线的中位OS为48.9个月; ≥40岁的中位OS为26.4个月,<40岁的中位OS为48.7个月;肿瘤体积≥60 cm3的中位OS为31.2个月,<60 cm3的中位OS为48.9个月。星形细胞瘤的中位OS为31.2个月。具备≥3项高危因素的为高危组,<3项高危因素的为低危组。高危组的中位OS为26.4个月,低危组的中位OS为48.9个月,两组OS存在统计学差异(P<0.05),生存曲线见图2。
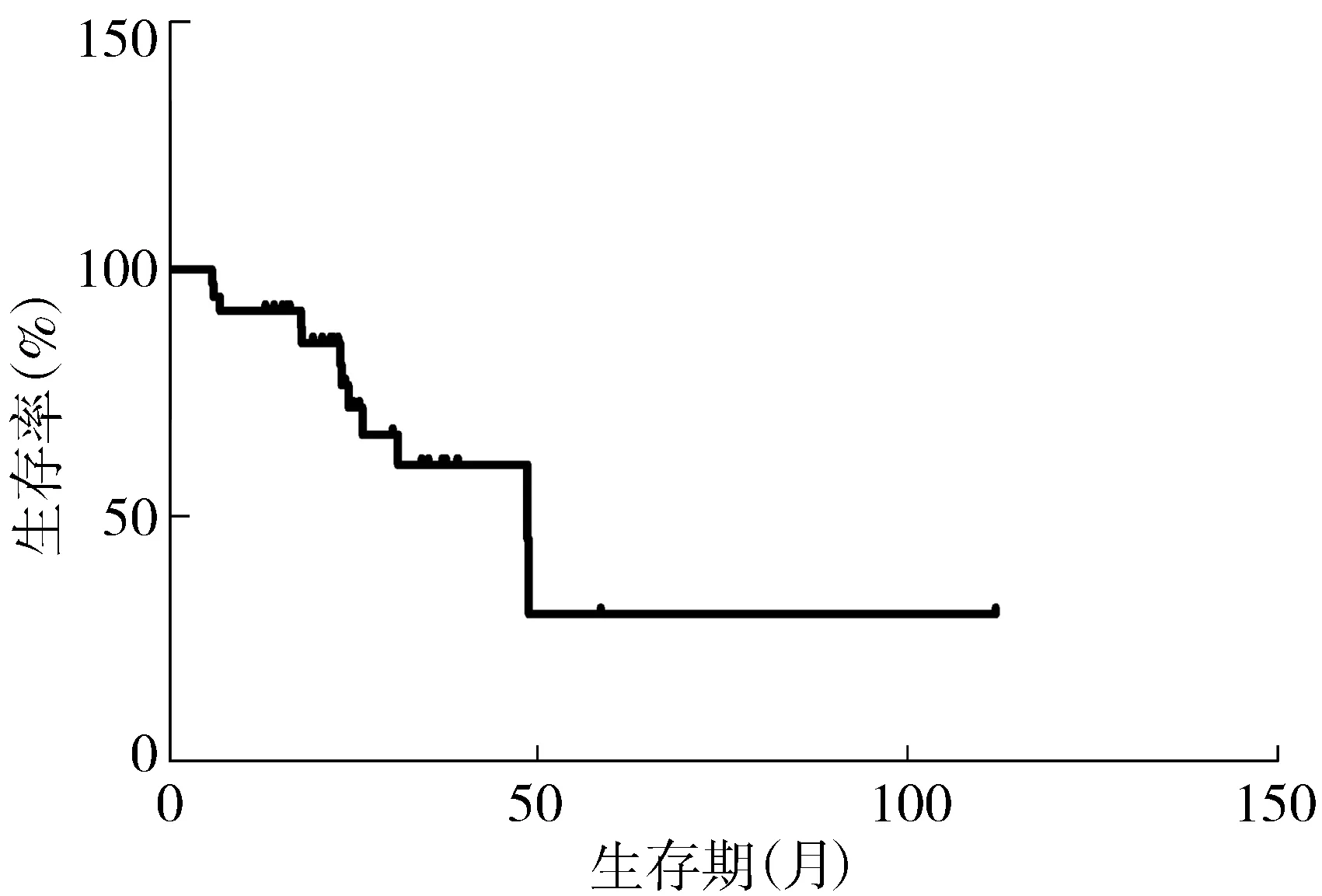
图1 36例LGG的生存曲线Figure 1 Survival curve of 36 cases of LGG

图2 低危组与高危组的生存曲线Figure 2 Survival curves of high-risk and low-risk LGG
2.3 无进展生存期分析
36例LGG的中位PFS为45.8个月,无进展生存曲线见图3。1年无进展生存率为88.7%,2年无进展生存率为69.3%。高危的中位PFS为21个月,低危组的中位PFS为46.7个月,两组间PFS存在统计学差异(P<0.05),无进展生存曲线见图4。
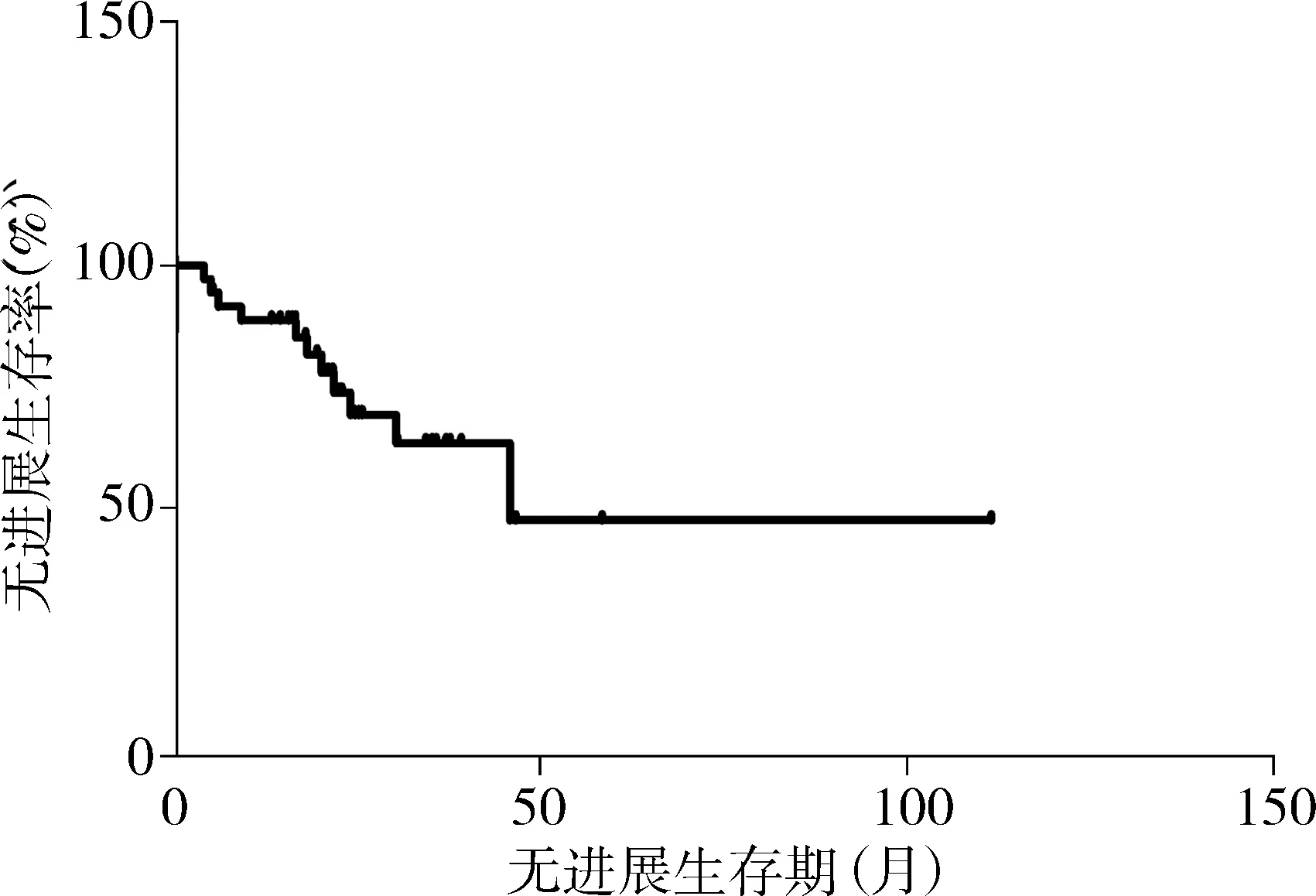
图3 36例LGG的无进展生存曲线Figure 3 Progression free survival curve of 36 cases of LGG

图4 低危组与高危组的无进展生存曲线Figure 4 Progression free survival curve of high-risk and low-risk LGG
3 讨论
低级别胶质瘤患者的临床表现与肿瘤对脑实质的浸润程度相关。癫痫是最常见的临床症状,还包括头痛、恶心呕吐、脑瘫、感觉异常、运动障碍、视力改变等[3]。我们纳入研究的36例患者均在不同程度上存在以上症状,以癫痫、头痛、无力居多,癫痫的出现意味着神经功能可能存在缺损。研究显示年龄≤40岁、术前KPS≥70 分、肿瘤直径<5 cm、病理类型为少突细胞瘤、肿瘤全切除的低级别胶质瘤患者预后较好[4]。本研究同样显示是否存在高危因素(年龄,病理,肿瘤体积,肿瘤是否跨中线)与低级别胶质瘤患者预后密切相关,36例LGG患者中年龄≥40岁、肿瘤跨中线、肿瘤体积≥60 cm3、组织病理类型为星形细胞瘤的低级别胶质瘤患者预后不佳,且具有≥3项高危因素的低级别胶质瘤患者的中位生存期和中位无进展生存期显著小于低危组患者。我们收集的临床资料里缺乏放疗前KPS评分,而放疗前的KPS评分可能影响患者放疗过程的顺利与否从而影响预后,这是本文研究的局限性,有待于进一步改进研究。
有研究报道LGG患者的OS可达5-20年,星形细胞瘤患者的中位OS为3-6年,混合少突星形患者的中位OS为4-7年,少突细胞瘤患者的中位OS为9-12年。LGG患者中位PFS为22个月[5]。本研究中的中位OS未达到类似研究的结果,中位PFS优于22个月,可能原因为本研究纳入的样本数太小,33.3%的患者具有3项以上高危因素,具有2项以上高危因素的患者占52.8%,预后不佳,同时本研究的随访期不够长,有24例患者未达到研究终点(死亡或失访)。36例LGG的中位PFS为45.8个月,优于报道的22个月,说明术后完成放疗的患者可能获得更好的生存质量。我们收集的被研究患者缺乏完善的分子病理资料,而随着研究的不断深入,现已发现组织学形态特征和级别相同的胶质瘤也可具有不同的分子遗传学变异背景及生物学标志物,导致不同的临床预后和治疗反应[6]。这些新的分子标记的应用为提高诊断的准确性和判断预后提供更好的指导。我们研究中按病理分型纳入的WHOII级胶质瘤患者中可能存在分子分型为类似胶质母细胞瘤的预后较差的类型。LGG分子遗传学研究表明,50%-80%的少突胶质细胞瘤患者存在1p/19q联合缺失,预示着这些患者将获得更长无进展生存期[7]。随着研究的深入,认为IDH1/2突变发生于1p/19q缺失之前,50%-90%的LGG患者或继发胶质母细胞瘤患者中存在IDH1/2突变[8]。研究显示携带IDH1/2突变的LGG患生存期更长,MGMT的启动子区甲基化也预示着良好预后[9]。因此,获得胶质瘤患者完整的分子病理资料对推测预后及指导治疗具有重要意义。我们将在下一步的研究中推动患者分子病理资料的获取,纳入更多适合的研究对象,延长观察期,完善数据结果,为LGG患者的治疗提供指导参考。
[1] Nageswara Rao AA,Packer RJ.Advances in the management of low-grade gliomas[J].Curr Oncol Rep,2014,16(8):398.
[2] Louis DN,Ohgaki H,Wiestler OD,etal.The 2007 WHO classification of tumours of the central nervous system[J].Acta Neuropathol,2007,114(2):97-109.
[3] Ruiz J,Lesser GJ.Low-grade gliomas[J].Curr Treat Options Oncol,2009,10(3-4):231-242.
[4] Kashi AS,Rakhsha A,Houshyari M.Overall survival in adult patients with low-grade, supratentorial glioma:Ten years’ follow up at a single institution[J].Electron Physician,2015,7(3):1114-1120.
[5] Sarmiento JM,Venteicher AS,Patil CG.Early versus delayed postoperative radiotherapy for treatment of low-grade gliomas[J].Cochrane Database Syst Rev,2015,6:CD009229.
[6] Vigneswaran K,Neill S,Hadjipanayis CG.Beyond the World Health Organization grading of infiltrating gliomas:advances in the molecular genetics of glioma classification[J].Ann Transl Med,2015,3(7):95.
[7] Molinari C,Iorio P,Medri L,etal.Chromosome 1p and 19q evaluation in low-grade oligodendrogliomas:a descriptive study[J].Int J Mol Med,2010,25(1):145-151.
[8] Yan H,Parsons DW,Jin G,etal.IDH1 and IDH2 mutations in gliomas[J].N Engl J Med,2009,360(8):765-773.
[9] Tanaka K,Sasayama T,Mizukawa K,etal.Combined IDH1 mutation and MGMT methylation status on long-term survival of patients with cerebral low-grade glioma[J]. Clin Neurol Neurosurg, 2015,38:37-44.
Prognostic factors of 36 patients with low-grade gliomas after postoperative radiotherapy
ZHOU Suna1, ZHANG Yanjun1, HE Dongjie1, ZHANG Mingxin2*, LIANG Jun1#
(1DepartmentofRadiotherapy,TangduHospital,FourthMilitaryMedicalUniversity,Xi’an710038,China;2DepartmentofGastroenterology,TangduHospital,FourthMilitaryMedicalUniversity;*Correspondingauthor,E-mail:zmx3115@163.com;#Co-correspondingauthor,E-mail:liangjun1964@126.com)
ObjectiveTo investigate the clinical features and prognostic factors of low-grade gliomas(LGG) patients.MethodsAll 36 patients with low-grade gliomas, who completed radiotherapy after surgery, were enrolled in the study. The patients were followed up to analyze the clinical features and prognostic factors. With age≥40 years, tumor volume≥60 cm3, the tumor across the midline, and the presence of astrocytomas as risk factors, patients with more than 3 risk factors in LGG were defined as high-risk group, and patients with less than 3 risk factors were as low-risk group.ResultsMedian overall survival(OS) and median progression free survival(PFS) of 36 LGG patients were 48.7 and 45.8 months, respectively. The 1-year and 2-year survival rates were 91.7% and 76.6%, respectively. The 1-year and 2-year progression-free survival rates were 88.7% and 69.3%, respectively. Median OS was 26.4 months and median PFS was 21 months in high-risk group. Median OS was 48.9 months and median PFS was 46.7 months in low-risk group.ConclusionThe risk factors can influence the survival of patients with low-grade glioma after surgery and postoperative radiotherapy. The prognosis in low-risk LGG patients is better than that of the high risk patients.
LGG; radiotherapy; survival; progression free survival
国家自然科学基金资助项目(81301922)
周苏娜,女,1983-09生,博士,主治医师,E-mail:annyzhou0913@163.com
2016-06-03
R730.264
A
1007-6611(2016)09-0847-04
10.13753/j.issn.1007-6611.2016.09.015
