端粒酶和CEA联合检测对良恶性腹腔积液的诊断价值
2016-10-29吴敏慧李建华王永锋
李 卓, 吴敏慧, 李建华, 王永锋, 康 炜, 杨 超
(1西安医学院第一附属医院检验科,西安 710077; 2陕西省肿瘤医院中西医结合科;*通讯作者,E-mail:superyang0210@163.com)
端粒酶和CEA联合检测对良恶性腹腔积液的诊断价值
李 卓, 吴敏慧, 李建华, 王永锋, 康 炜, 杨 超
(1西安医学院第一附属医院检验科,西安 710077;2陕西省肿瘤医院中西医结合科;*通讯作者,E-mail:superyang0210@163.com)
目的 探讨腹水端粒酶活性(telomerase activity,TA)和癌胚抗原(carcinoembryonic antigen,CEA)检测对鉴别良、恶性腹腔积液的价值。 方法 采用聚合酶链反应酶联免疫吸附测定(PCR-ELISA)法和化学发光微粒子免疫分析技术分别测定65例恶性腹腔积液和52例良性腹腔积液中TA和CEA表达水平。 结果 腹腔积液中TA和CEA的阳性率在恶性腹腔积液组分别为76.9%(50/65)和61.5%(40/65),在良性腹腔积液组分别为7.7%(4/52)和23.1%(12/52),两组比较差异有统计学意义(χ2=62.921,17.925,P<0.05)。TA测定诊断恶性腹腔积液的敏感性为76.9%(50/65),特异性为92.3%(48/52);CEA诊断的敏感性61.5%(40/65),特异性76.9%(40/52),两组比较差异有统计学意义(χ2=4.113,5.216,P<0.05)。两者联合检测的敏感性为92.3%(60/65),特异性为96.2%(50/52),联合检测的敏感性显著高于TA和CEA单项检测(χ2=4.582,19.231,P<0.05)。 结论 检测腹腔积液TA、CEA表达水平有助于积液性质的良恶性鉴别;联合检测能提高恶性腹腔积液诊断的准确度。
腹腔积液; 端粒酶; 癌胚抗原
腹腔积液(seroperitoneum)又称腹水,是由于各种原因导致的腹腔内液体形成过快或吸收过缓而引起的一种常见的临床体征,如何鉴别腹腔积液的性质对疾病的临床诊断、治疗和预后评估都有着重要的临床意义[1,2]。传统方法多通过查找癌细胞来进行良、恶性腹腔积液的鉴别,但其操作复杂、阳性率低、容易漏检,往往不能满足临床需求[3,4]。因此,明确腹腔积液的良、恶性,一直是一个亟待解决的临床难题。
近年来,随着实验室检测技术的不断发展,肿瘤标志物在腹腔积液的诊断中也显示了一定的临床应用价值[5-8]。本研究通过检测65例恶性腹腔积液和52例良性腹腔积液患者腹水中TA和CEA的水平,探讨TA和CEA在良恶、性腹腔积液中的鉴别诊断价值。
1 资料与方法
1.1 一般资料
收集本院2013-06~2015-12收治的117例腹腔积液患者标本,其中恶性腹腔积液组65例,男性37例,女性28例,年龄34-73岁,中位年龄53.5岁;良性腹腔积液组52例,男性29例,女性23例,年龄22-63岁,中位年龄42.5岁。腹腔积液细胞学或病理活检发现恶性肿瘤细胞为恶性肿瘤组,良性疾病组根据影像学、实验室检查及临床资料综合分析确诊。入组的良恶性腹腔积液患者病因分析,见表1。
表1 腹腔积液病因分析例(%)
Table 1 Cause analysis of seroperitoneum cases(%)

1.2 标本采集
采集患者入院后首次经腹腔穿刺获取的腹腔积液10 ml,1 500 r/min,离心10 min),取上清液用于检测。
1.3 检测方法
采用端粒酶PCR-ELISATM试剂盒测定端粒酶活性,试剂盒由德国Boehringer Mannheim公司提供;选用美国雅培ARCHITECT i2000SR全自动免疫分析仪检测CEA水平。
1.4 统计学处理
运用SPSS 19.0软件进行统计学分析,组间率的比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 良恶性腹腔积液中TA和CEA水平的比较
腹腔积液中TA和CEA阳性率在恶性腹腔积液组分别为77.0%(50/65)和61.5%(40/65),在良性腹腔积液组分别为7.7%(4/52)和23.1%(12/52),恶性腹腔积液组端粒酶和CEA的阳性率均明显高于良性腹腔积液组,差异有统计学意义(P<0.05,见表2)。
表2 良恶性腹腔积液中TA和CEA的表达比较例(%)
Table 2 Comparison of TA and CEA positive rate in benign and malignant seroperitoneum cases(%)

组别nTA表达阳性CEA表达阳性良性腹腔积液组524(7.7)12(23.1)恶性腹腔积液组6550(77.0)40(61.5)χ262.92117.925P<0.05 <0.05
与良性腹腔积液组比较,*P<0.05
2.2 TA和CEA单项及联合检测鉴别良恶性腹腔积液的准确性分析
TA测定对恶性腹腔积液诊断的敏感性和特异性均较CEA高,差异有统计学意义(χ2=4.113、5.216,P<0.05)。两项指标联合检测若以其中一项阳性作为恶性腹腔积液的诊断标准,则联合检测敏感性为92.3%(60/65),明显高于端粒酶和CEA单项检测的敏感性76.9%和61.5%,差异均有统计学意义(χ2=4.582、19.231,P<0.05),而且特异性也有明显提高,为96.2%(见表3)。
表3 TA、CEA单项或联合检测鉴别良恶性腹腔积液的准确性分析(%)
Table 3 Accuracy of single or combined detection of TA and CEA in diagnosis of benign and malignant seroperitoneum(%)
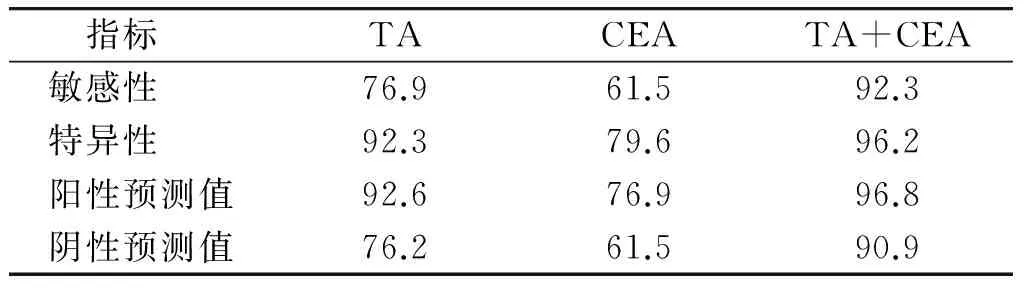
指标 TACEATA+CEA敏感性76.961.592.3特异性92.379.696.2阳性预测值92.676.996.8阴性预测值76.261.590.9
以各指标在恶性腹腔积液中阳性为真阳性,阴性为假阴性,而在良性腹腔积液中阳性为假阳性,阴性为真阴性;敏感性=真阳性/(真阳性+假阴性)×100%;特异性=真阴性/(真阴性+假阳性)×100%
3 讨论
端粒酶是由RNA和蛋白质组成的一种核糖核蛋白酶,具有特殊的逆转录酶性质,它能催化染色体末端特殊结构端粒的复制,在人的生殖细胞、永生化细胞系、肿瘤细胞和增殖组织中大量存在。研究发现,恶性肿瘤细胞的发生、发展及永生化表现,也与端粒酶的激活有关[9,10]。众多研究显示,虽然端粒酶的活性不是引起细胞癌变的初始因素,但却是一个维持肿瘤生长的继发性改变,85%的人类肿瘤组织有端粒酶表达,而与肿瘤相邻的正常组织或良性病变仅有4%表达,且表达水平较低[11],另有研究发现,端粒酶活性的测定对恶性腹腔积液的诊断敏感性远高于传统的细胞学检查[12]。癌胚抗原是一种分子量为200 kD的糖蛋白[13],因最初发现于结肠癌和胎儿肠组织中而得名,它可广泛存在于内胚叶起源的消化系统肿瘤中,也可存在于胚胎的消化管组织中,在正常人血清中也可有微量存在,临床上多用于对结直肠癌、乳腺癌和肺癌的疗效判断、病情发展、监测和预后估计。但由于特异性不强,灵敏度不高,其单独检测对疾病的诊断价值有限。
本文研究发现,恶性腹腔积液组端粒酶和CEA的阳性率均明显高于良性腹腔积液组(P<0.05),但是TA和CEA单独检测鉴别良恶性腹腔积液的特异性和敏感性均有限。两项指标联合检测,可使敏感性、特异性、阳性预测值和阴性预测值较单项指标均有不同程度的提高(P<0.05),这提示联合检测腹水中TA和CEA水平,对于判断腹腔积液性质具有更高的临床价值。
多种恶性肿瘤均可引起腹腔积液的生成,重视腹腔积液的检查对于癌症的临床诊断、治疗和预后意义重大[14,15]。本研究中腹腔积液TA联合CEA检测腹腔积液良恶性时,与单一指标相比,检测的敏感性及特异性均有提高,提示联合检测两种或以上的肿瘤标志物更有助于腹腔积液良恶性的判断。因此,对于腹腔积液患者的诊断,尤其是不明原因者,在细胞学检查无明确诊断的情况下,联合检测TA、CEA有助于腹腔积液良恶性的鉴别。
[1] Gerbes AL,Jungst D,Xie YN,etal.Ascitic fluid analysis for the differentiation of malignancy-related and nonmalignant ascites.Proposal of a diagnostic sequence[J].Cancer,1991,68(8):1808-1814.
[2] Sangisetty SL,Miner TJ.Malignant ascites:A review of prognostic factors,pathophysiology and therapeutic measures[J].World J Gastrointest Surg,2012,4(4):87-95.
[3] Karoo RO,Lloyd TD,Garcea G,etal.How valuable is ascitic cytology in the detection and management of malignancy?[J].Postgrad Med J,2003,79(931):292-294.
[4] Motherby H,Nadjari B,Friegel P,etal.Diagnostic accuracy of effusion cytology[J].Diagn Cytopathol,1999,20(6):350-357.
[5] Liu F,Kong X,Dou Q,etal.Evaluation of tumor markers for the differential diagnosis of benign and malignant ascites[J].Ann Hepatol,2014,13(3):357-363.
[6] Abdel-Razik A,Eldars W,Elhelaly R,etal.C-reactive protein and insulin-like growth factor-1 in differential diagnosis of ascites[J].J Gastroenterol Hepatol,2016:Epub ahead of print.
[7] Kaleta EJ,Tolan NV,Ness KA,etal.CEA,AFP and CA 19-9 analysis in peritoneal fluid to differentiate causes of ascites formation[J].Clin Biochem,2013,46(9):814-818.
[8] Trape J,Gurt G,Franquesa J,etal.Diagnostic accuracy of tumor markers CYFRA21-1 and CA125 in the differential diagnosis of ascites[J].Anticancer Res,2015,35(10):5655-5660.
[9] Dobija-Kubica K,Zalewska-Ziob M,Brulinski K,etal.Telomerase activity in non-small cell lung cancer[J].Kardiochir Torakochirurgia Pol,2016,13(1):15-20.
[10] Kulic A,Plavetic ND,Gamulin S,etal.Telomerase activity in breast cancer patients:association with poor prognosis and more aggressive phenotype[J].Med Oncol,2016:Epub ahead of print.
[11] Maneechotesuwan K,Lertworawiwat A,Tscheikuna J,etal.Comparison of telomerase activity between malignant and tuberculous pleural effusions[J].J Med Assoc Thai,2006,89(Suppl 5):S46-54.
[12] Park ES,Lee J,Kang SY,etal.A comparative study of telomerase activity and cytologic diagnosis in malignant ascites[J].Anal Quant Cytopathol Histpathol,2013,35(3):146-151.
[13] Tellez-Avila FI,Garcia-Osogobio SM.The carcinoembryonic antigen:apropos of an old friend[J].Rev Invest Clin,2005,57(6):814-819.
[14] Runyon B A.Care of patients with ascites[J].N Engl J Med,1994,330(5):337-342.
[15] 罗蕾蕾,陈建,邵建国.良恶性腹水鉴别诊断的实验室检查指标[J].第二军医大学学报,2010,31(6):674-677.
Diagnostic value of TA, CEA for differentiating benign and malignant ascites
LI Zhuo1, WU Minhui2, LI Jianhua1, WANG Yongfeng1, KANG Wei1, YANG Chao1*
(1DepartmentofLaboratoryMedicine,FirstAffiliatedHospitalofXi’anMedicalUniversity,Xi’an710077,China;2DepartmentofIntegratedTCMandWesternMedicine,ShaanxiProvincialTumorHospital;*Correspondingauthor,E-mail:superyang0210@163.com)
ObjectiveTo explore the diagnostic value of telomerase activity(TA) and carcinoembryonic antigen(CEA) for differentiating malignant and benign seroperitoneum.MethodsThe levels of TA and CEA in 65 cases of malignant seroperitoneum and 52 cases of benign seroperitoneum were respectively detected by PCR-ELISA assay and chemiluminescent microparticle immunoassay technique.ResultsThe positive rate of TA was 76.9%(50/65) in malignant seroperitoneum group and 7.7%(4/52) in benign seroperitoneum group(χ2=62.921,P<0.05). The positive rate of CEA in malignant seroperitoneum group was 61.5%(40/65) and 23.1%(12/52) in benign seroperitoneum group(χ2=17.925,P<0.05). Sensitivity of TA and CEA in the diagnosis of malignant peritoneal effusion was 76.9%(50/65) and 61.5%(40/65), respectively(χ2=4.113,P<0.05). Meanwhile, the specificity of TA and CEA in the diagnosis of malignant peritoneal effusion was 92.3%(48/52) and 76.9%(40/52),respectively, and the difference was statistically significant(χ2=5.216,P<0.05). The specificity of combined detection was 96.2%(50/52), and the sensitivity was 92.3%(60/65), which was higher than that of TA(χ2=4.582,P<0.05) and CEA detection(χ2=19.231,P<0.05).ConclusionThe expression of TA and CEA in the peritoneal fluid is helpful in the identification of the malignant and benign effusion, and the combined detection could improve the accuracy in the diagnosis of malignant ascites.
seroperitoneum; telomerase activity; carcinoembryonic antigen
陕西省教育厅专项科研基金资助项目(12JK0764);西安医学院第一附属医院科研基金资助项目(XYFY11-08);西安医学院校级重点扶持学科资助项目
李卓,女,1982-01生,博士,主治医师,讲师,E-mail:lizhuo721@163.com
2016-06-22
R442.5
A
1007-6611(2016)09-0850-03
10.13753/j.issn.1007-6611.2016.09.016
