香草酸酰胺衍生物的制备及其止血活性的动力学法研究
2016-10-10杜传荣林发全逯东伟陈丹丹樊希望林翠梧
杜传荣,林发全,逯东伟,陈丹丹,樊希望,林翠梧,4*
(1.广西大学 化学化工学院,广西 南宁 530004;2.广西医科大学 第一附属医院,广西 南宁 530021;3.南宁市化工研究设计院,广西 南宁 530022; 4.广西高校应用化学技术与资源开发重点实验室,广西 南宁 530004)
香草酸酰胺衍生物的制备及其止血活性的动力学法研究
杜传荣1,林发全2,逯东伟1,陈丹丹1,樊希望3,林翠梧1,4*
(1.广西大学 化学化工学院,广西 南宁530004;2.广西医科大学 第一附属医院,广西 南宁530021;3.南宁市化工研究设计院,广西 南宁530022;4.广西高校应用化学技术与资源开发重点实验室,广西 南宁530004)
以香草酸为母体,分别与6-氨基己酸(EACA)、止血芳酸(AMBA)和止血环酸(AMCA)反应,合成3种未见文献报道的香草酸酰胺衍生物,并采用IR、ESI-MS、1H NMR和13C NMR进行结构鉴定。以传统方法、荧光动力学法和紫外动力学法测定其对血浆复钙时间(PRT)的影响。为了研究衍生物在血液中的稳定性,在模拟生理条件下,运用荧光光谱、紫外光谱及分子对接技术研究了它分别与人血清白蛋白(HSA)的结合。结果表明,3种衍生物在一定浓度范围内都可以有效缩短PRT,具有显著的止血活性。新的动力学测定方法,不仅有效避免了传统方法引入的人为误差,重现性良好,而且判断标准更加科学,并可以获得更多血浆凝结过程中的信息。3种衍生物均主要通过氢键和范德华力与HSA结合形成稳定的复合物,表明它可通过HSA在血液中传递并运输到相应部位而发生药理作用。
香草酸;酰胺衍生物;止血;人血清白蛋白(HSA);光谱法
*Corresponding Author,E-mail:cuiwulin114@163.com
1 引 言
许多疾病和意外伤害往往引发危重出血,如恶性肿瘤、病理产科、外伤、外科手术及弥散性血管内凝血(DIC)等。造成许多患者早期死亡的主要原因之一恰恰就是无法有效控制危重出血。因此,快速、安全、有效地止血不仅可以为抢救生命赢取宝贵时间,还可以大大降低危重出血死亡率。这使得止血药成为抢救生命必不可少的关键药物之一[1-3]。临床常用的止血药有6-氨基己酸、止血芳酸、止血环酸,但存在腹泻、恶心及呕吐、瞳部不适、头痛、头晕等副作用。因此,通过体外药理活性实验筛选更加有效且毒副作用更小的潜在止血药,越来越受到人们的关注和重视,并成为探索及开发新型止血药的研究趋势[4-6]。
香草酸又名香荚兰酸,是胡黄连、蜂胶、高丽参等众多传统中药材中的有效成分之一。国内外对香草酸及其衍生物的生理活性研究报道较少,主要集中于抗菌消炎、抗氧化、抑制酪氨酸酶活性、化感作用、调节神经等方面[7-11],而有关促凝血活性鲜有报道。基于活性叠加、减少不良反应两方面考虑,以香草酸为母体,分别与6-氨基己酸、止血芳酸和止血环酸反应,合成了3种未见报道的香草酸酰胺衍生物。采用传统方法、荧光动力学法和紫外动力学法测定并确定其能有效缩短血浆复钙时间(PRT),具有显著的止血活性。新动力学测定方法,不仅有效避免了传统方法引入的人为误差,重现性良好,而且判断标准更加科学,还能获得更多血浆凝结过程中的信息。另外,药物进入人体后,是通过血液进行运输,而大多情况下药物会先与血浆中的蛋白结合。人血清白蛋白(HSA)是血浆中含量最大的蛋白,具有结合和运输药物小分子、氨基酸及脂肪酸等很多内源性和外源性物质的作用。药物与HSA的结合,不仅能够增加其在血液中的溶解度,还能避免被氧化及延长治疗半衰期[12-13]。为了研究衍生物在血液中的稳定性,在模拟生理条件下,本文运用光谱法及分子对接技术研究了其与HSA的相互作用。结果表明,3种衍生物均可与HSA形成稳定复合物,即都可通过HSA在血液中传递及运输到相应部位而发生药理作用。本研究为香草酸酰胺衍生物在人体内的运输、作用机理及临床促凝药物的筛选提供了可靠的理论信息和实验依据。
2 实 验
2.1仪器与试剂
仪器:Agilent Cary 60 UV-Vis紫外-可见分光光度计(有恒温装置,美国Agilent Technologies公司);Agilent Cary Eclipse Fluorescence Spectrophotometer荧光分光光度计(有恒温装置,美国Agilent Technologies公司);Bruker Tensor 27红外光谱仪(德国Bruker公司);Shimadzu LCMS-8040液质联用仪(日本Shimadzu公司);Bruker Avance-600 NMR Spectrometer 核磁共振仪(600 MHz,德国Bruker);Boetius显微熔点测定仪(德国Boetius公司);Milli-Q Advantage A10(美国Millipore公司)。
试剂:人血清白蛋白(HSA,99%,美国Sigma公司);pH=7.4的PBS缓冲液(粉剂,美国Sigma);香草酸、6-氨基己酸、止血芳酸、止血环酸均购于珠海嘉信康医药科技有限公司(HPLC ≥ 95%)。其余试剂均为国产分析纯,实验用水为Milli-Q超纯水。
2.2衍生物的制备及结构表征
2.2.1衍生物的制备
将香草酸40 mmol、乙酸酐40 mL、吡啶2 mL在120 ℃下回流反应12 h。减压旋蒸除去溶剂,加入大量冰水,并剧烈搅拌过夜,产生大量白色固体。静置,抽滤,用水洗至滤液为中性,干燥,收率约为97%。取对乙酰基香草酸20 mmol、SOCl215 mL在85 ℃下回流反应6 h。减压旋蒸除去溶剂,冷却后用5 mL的 THF溶解。将40 mmol 的6-氨基己酸(止血芳酸/止血环酸)溶于20 mL浓度为2 mol/L的NaOH溶液,在10~15 ℃下滴入对乙酰基香草酰氯溶液,反应过程中维持反应液pH=8~9,室温反应5 h后用HCl溶液调节pH=4~5,有白色固体(或粘稠状物)析出,过滤,无水乙醇重结晶,得到块状或片状晶体。合成路线如图1所示。

图13种衍生物的合成路线
Fig.1Synthetic route of the three derivatives
2.2.2衍生物的结构表征

2.3传统方法测定PRT
向内径8 mm的试管中分别加入0.1 mL血浆和0.1 mL样品溶液,轻摇混匀,37 ℃恒温5 min,加入0.1 mL CaCl2溶液,立即启动秒表计时,每隔10 s倾斜试管一次,至混和液中出现大量弥漫的白色颗粒纤维蛋白丝,液面不动时,记为PRT。以生理盐水为正常对照,AMBA为阳性对照。各组重复6次,取平均值。
2.4荧光动力学法测定PRT
向石英比色皿中加入0.1 mL血浆和0.1 mL样品溶液,轻摇混匀,37 ℃恒温5 min,加入0.1 mL CaCl2溶液,立即开启荧光动力学测试,至荧光强度基本不随时间变化为止。以生理盐水为正常对照,AMBA为阳性对照。各组重复3次,取平均值。设置激发波长为299 nm,发射波长为346 nm,激发/发射狭缝为5 nm,测试时间为500 s。
2.5紫外动力学法测定PRT
操作步骤与荧光动力学法相似。测试波长为411 nm,测试时间间隔为1 s,扫描时间为500 s。
2.6衍生物与HSA的相互作用
光谱测定:激发波长为280 nm,激发/发射狭缝为5/2.5 nm,测定不同衍生物-HSA溶液的发射光谱(扫描范围300~500 nm)、同步荧光光谱(Δλ=60 nm和Δλ=15 nm)。以PBS缓冲液为参比,测定各溶液的吸收光谱(扫描范围200~500 nm)。
分子模拟:通过AutoDock 4.2将不同衍生物小分子对接到HSA中,拉马克遗传算法(LGA)计算结合模型,预测可能存在的构象。分别计算了各衍生物可能存在的10种结合模型,以结合能最负的最佳。LigPlot+软件[14]进一步分析其微观结合模型。
3 结果与讨论
3.1传统方法测定的PRT
(1)
由表1可知,与生理盐水正常组比较,3种衍生物在0.062 5~0.25 mmol·L-1浓度范围均能明显缩短PRT,有显著的止血活性。其中衍生物Ⅱ的止血活性最好,在0.031 25~0.125 mmol·L-1浓度范围内优于阳性对照止血芳酸组。但受试药物均在高浓度时止血活性下降,甚至PRT稍大于正常对照组。

表1 传统方法不同衍生物的PRT(n=6)
注:与正常对照组比较,*p < 0.05,**p<0.01。
3.2荧光动力学法测定的PRT
采用荧光动力学测试方法,测试了血浆从加入CaCl2开始至完全凝结这一过程中荧光强度的变化曲线,如图2所示。结果显示,随衍生物浓度的增大,血浆的荧光明显变弱,表明衍生物对血浆有猝灭作用。荧光动力学曲线呈Z字形,即加入CaCl2一段时间后,血浆荧光强度先是不断降低,最后基本保持不变。这可能是由于随着血浆内源性凝血系统功能的恢复,血浆逐渐开始凝结,血浆形态逐渐从流动液态转变为胶状,这种转变不仅导致有效到达血浆中发光官能团的激发光强度降低,而且发射光也因血浆的凝结而产生更大的内滤效应。将荧光动力学曲线求一阶导数,获得对应的一阶导数曲线。一阶导数曲线反映出血浆荧光强度减弱的速率,将峰值对应的时间即荧光强度降低最快的点定为血浆复钙凝血时间。在此时间点,肉眼观察血浆中已产生大量白色颗粒纤维蛋白丝,并且液面不动,血浆基本完全凝结。这表明该判断标准与传统方法一致。不同衍生物的PRT缩短率见图4。结果表明,衍生物在0.062 5~0.25 mmol·L-1浓度范围均能明显缩短PRT,且在0.125 mmol·L-1时促凝效果最好。但浓度继续变大时止血效果反而下降,甚至PRT稍大于正常对照组。荧光动力学法与传统方法测试PRT结果一致,且测试稳定,重现性良好。
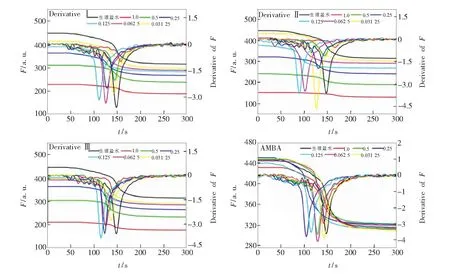
图2 不同衍生物作用下PRT荧光动力学曲线及其一阶导数曲线
3.3紫外动力学法测定的PRT
采用紫外动力学法测试了血浆从加入CaCl2开始至完全凝结这一过程中紫外吸收强度随时间的变化曲线,如图3所示。结果显示,紫外动力学曲线呈反Z字形,即加入CaCl2一段时间后,血浆吸收强度先是不断升高,最后基本保持不变。这可能是由于随着血浆的不断凝结,呈胶状后的血浆对光的反射增强,导致光的透过率降低。对紫外动力学曲线求一阶导数,获得一阶导数曲线。一阶导数曲线反映出血浆紫外透过率减弱的速率,将峰值对应的时间即紫外透过率强度降低最快的点作为血浆复钙凝血时间。在该时间点,肉眼观察血浆中同样已产生大量白色颗粒纤维蛋白丝,并且液面不动,血浆基本完全凝结。这表明该判断标准与传统方法一致。不同衍生物的PRT缩短率图见图4。结果表明,衍生物的加入,引起血浆的最终吸收强度变大。这可能是由于衍生物在血浆的凝结过程中促进其产生更多的白色颗粒纤维蛋白丝,导致光透过率降低。衍生物在0.062 5~0.5 mmol·L-1浓度范围均能明显缩短PRT,且浓度为0.125 mmol·L-1时促凝效果最好,表现出显著的止血活性。但浓度继续变大时止血效果反而下降,甚至PRT稍大于正常对照组。紫外动力学法与荧光动力学法以及传统方法测试PRT结果一致,且测试稳定,重现性良好。
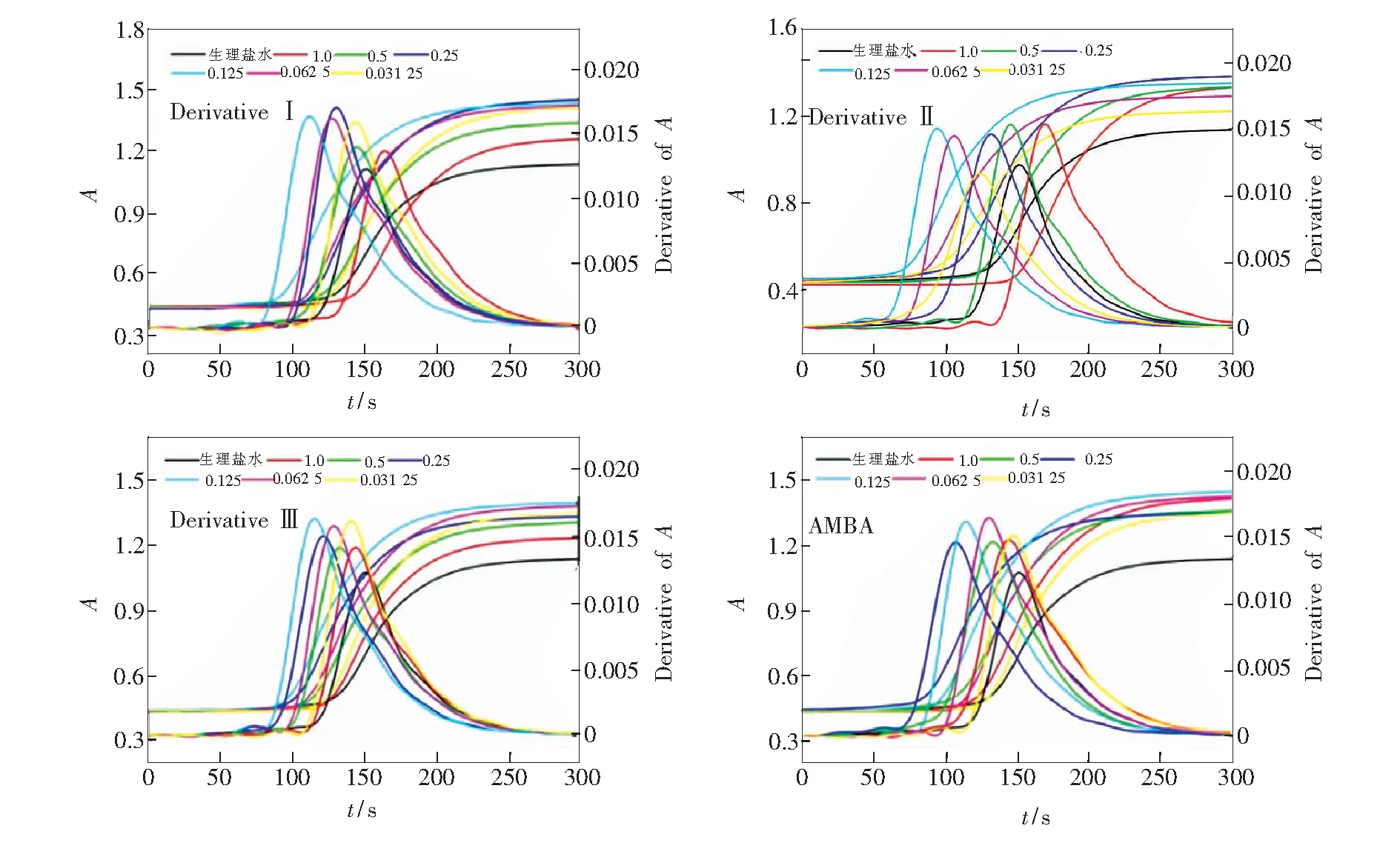
图3 不同衍生物作用下的PRT紫外动力学曲线及其一阶导数曲线
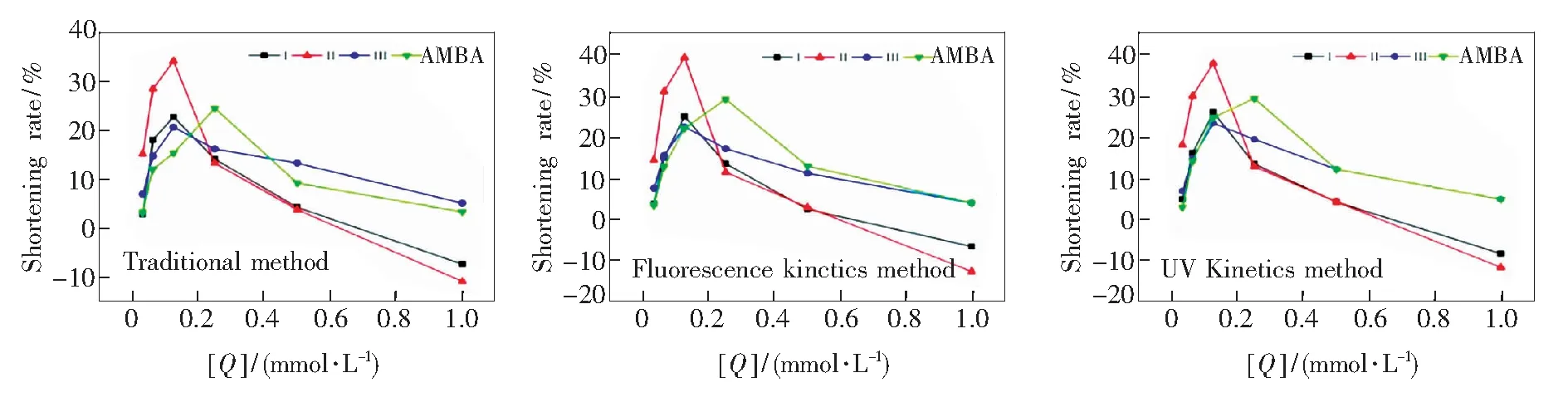
图4 不同方法的PRT缩短率
3.43种方法测试PRT的比较
传统方法不需要复杂的仪器设备,简便易行,但存在着不可避免的缺陷:
(1)肉眼判断血浆凝结过程,不同测试者的认定差异及视力差别无法避免,即便是同一测试者,也无法精确辨别血浆凝结80%~100%的程度,必然引起不同程度的误差;
(2)测试过程中需要将试管移出水槽观察,试管内血浆无法保证持续恒温,影响血浆的凝结;
(3)测试过程中每隔10 s倾斜一次试管,判断是否凝结,此过程中会产生不同程度的震动,导致血浆凝结延缓,且各试管取放次数、震动强弱不一定相同,引入很大人为误差,严重影响测定结果的真实性;
(4)每隔10 s观测一次,有可能自上一次观察后的3,4,5 s时血浆产生凝结,会导致判断延误;
(5)为了减少上述误差,测试时往往需要多次重复测量,使得工作强度加大,且浪费血浆和试剂。
荧光/紫外动力学法需使用荧光/紫外-可见分光光度计。具有以下优点:
(1)通过恒温装置,可以有效避免传统方法引入的温度因素误差;
(2)不需要反复取出观察,避免了震动对血浆凝结过程的干扰;
(3)判断标准统一,实验证明,光强度变化最快的时间点,肉眼观察血浆中已产生大量白色絮状物质,倾斜液面不会流动,血浆凝结完全,这一判定标准与传统方法吻合;
(4)根据动力学曲线可获得更多血浆凝结过程中的信息,如凝结速率;
(5)重现性良好,且节约血浆和试剂。
但荧光动力学存在局限性:若药物对血浆的荧光产生极强的猝灭作用,就无法测试其荧光强度随时间变化情况,即无法测试该药物对PRT的影响。紫外动力学虽可以有效地避免荧光动力学存在的猝灭作用,但仪器精密度普遍低于荧光。
3.5衍生物与HSA的相互作用
3.5.1不同衍生物-HSA体系的荧光发射光谱
由图5(a)可见,HSA内源性荧光随衍生物Ⅱ浓度的增大,发生明显猝灭,峰形不变(衍生物Ⅰ/Ⅲ-HSA体系图形与之类似)。最大荧光发射峰对应波长出现略微红移现象(Ⅰ-HSA:由353 nm移至356 nm;Ⅱ-HSA:由353 nm移至359 nm;Ⅲ-HSA:由353 nm移至358 nm)。这表明3种衍生物与HSA的结合导致组成色氨酸残基(Trp)周围疏水腔的肽链呈现部分伸展,极性增大,疏水性减小,改变了HSA二级空间结构[16]。
3.5.2不同衍生物-HSA的猝灭机理
不同温度下衍生物Ⅱ-HSA体系Stern-Volmer曲线见图5(b),可以看出各曲线的线性良好(衍生物Ⅰ/Ⅲ-HSA体系图形与之类似)。表2是不同温度下各体系的猝灭常数,由表可知,随着温度的升高,Ksv变小,Kq值均显著大于2.0×1010L·mol-1·s-1[17-18]。这表明各衍生物均与HSA结合形成新的非共价复合物,且其稳定性随着温度升高而降低,是静态猝灭。
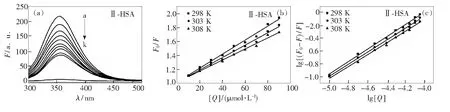
a~j:c(HSA)=1.0×10-5mol·L-1; c(Ⅱ)=(0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0)×10-5mol·L-1; k:c (Ⅱ) = 1.0×10-5mol·L-1
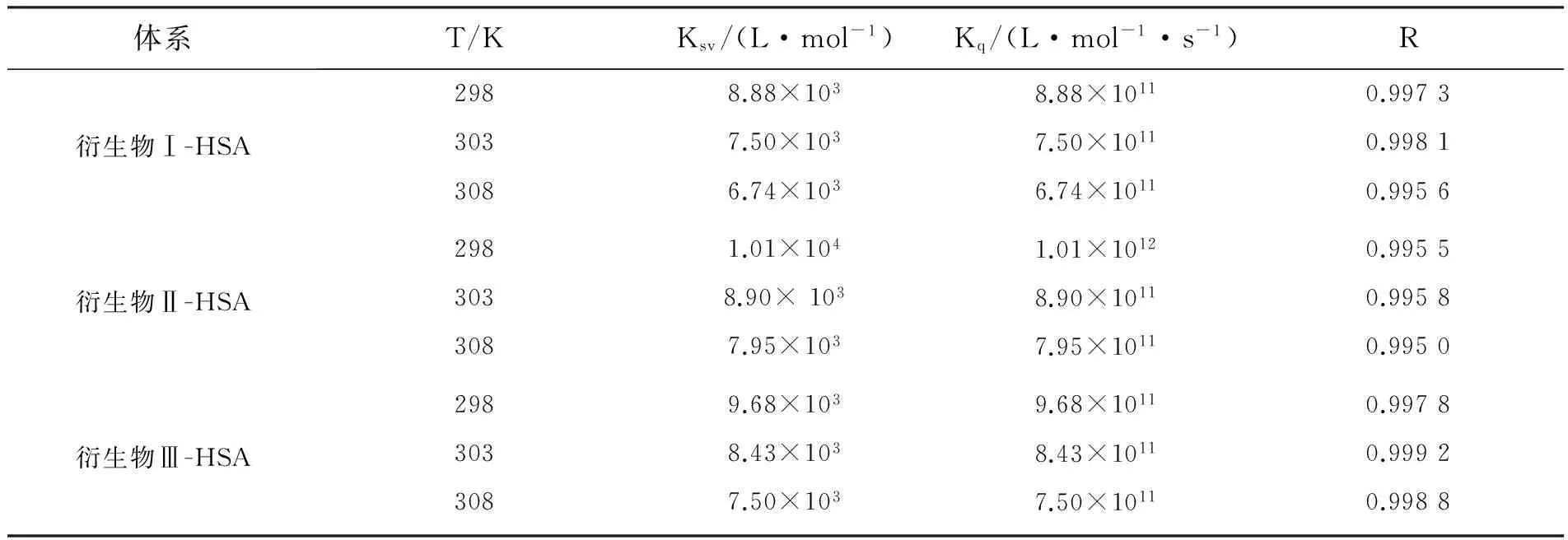
图5 (a) 衍生物Ⅱ与HSA相互作用的荧光光谱;(b) Stern-Volmer曲线;(c) lg[(F0-F)/F]vs.lg[Q]。
3.5.3衍生物-HSA的结合常数和结合位点数
图5(c)是衍生物Ⅱ与HSA结合的lg[(F0- F)/F]对lg[Q]的双对数曲线,可以看出线性关系良好(衍生物I/Ⅲ-HSA体系图形与之类似)。不同衍生物与HSA结合的KA、n见表3。所有n值均约为1,表明不同衍生物分别与HSA结合时都只有1个结合位点。温度升高,KA值减小,表明复合物稳定性降低,为静态猝灭[19-20]。
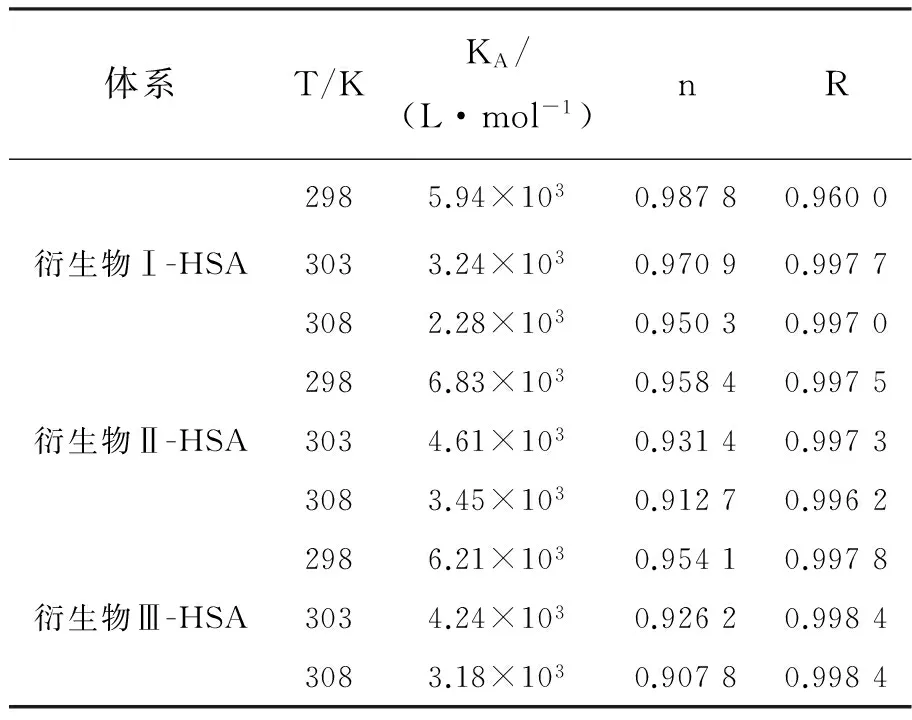
表3 HSA与不同衍生物结合的结合参数
3.5.4不同衍生物-HSA的能量转移和结合距离
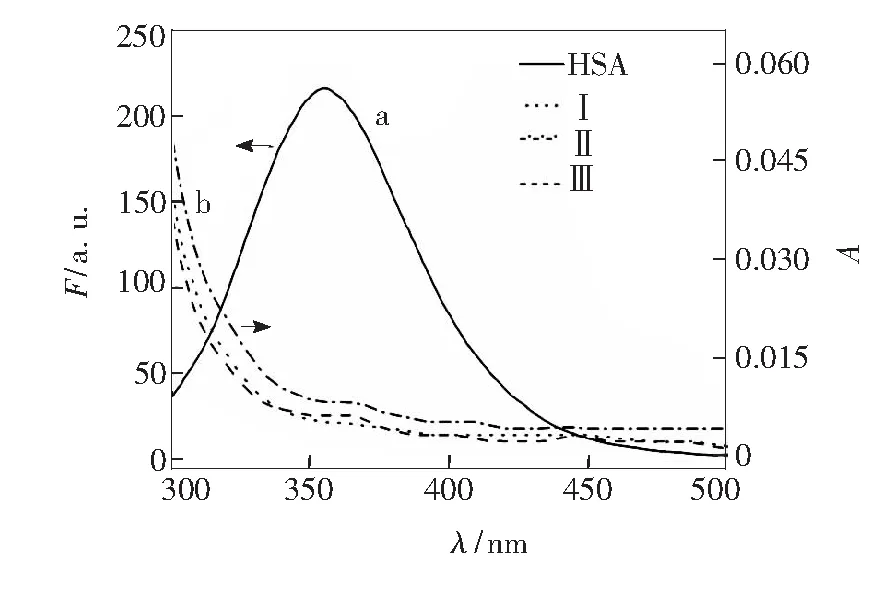
蛋白质大分子与小分子相互结合的结合距离(r)与能量转移效率(E)之间的关系用Föster偶极-偶极非辐射能量转移理论计算[21-22]。不同衍生物紫外吸收光谱与HSA荧光光谱的重叠图见图6,J、E、r值见表4。不同衍生物-HSA的r<7 nm,并满足0.5R0
T= 298 K,c(HSA)=c(Ⅰ/Ⅱ/Ⅲ)=1.0×10-5 mol·L-1
图6HSA荧光发射光谱(a)与不同衍生物紫外吸收光谱(b)重叠图
Fig.6Overlap of fluorescence emission spectrum of HSA (a) and absorption spectra of different derivatives (b)

表4 HSA与不同衍生物的结合距离参数
3.5.5不同衍生物-HSA体系的相互作用力类型
根据van’t Hoff定律[21,25],两物质间结合的热力学参数ΔG、ΔH、ΔS值见表5。不同衍生物-HSA体系的ΔG<0,ΔH<0,ΔS<0,表明两者间的结合均是焓驱动的自发过程,范德华力和氢键作用力是维持其结合的主要作用力类型[25-26]。
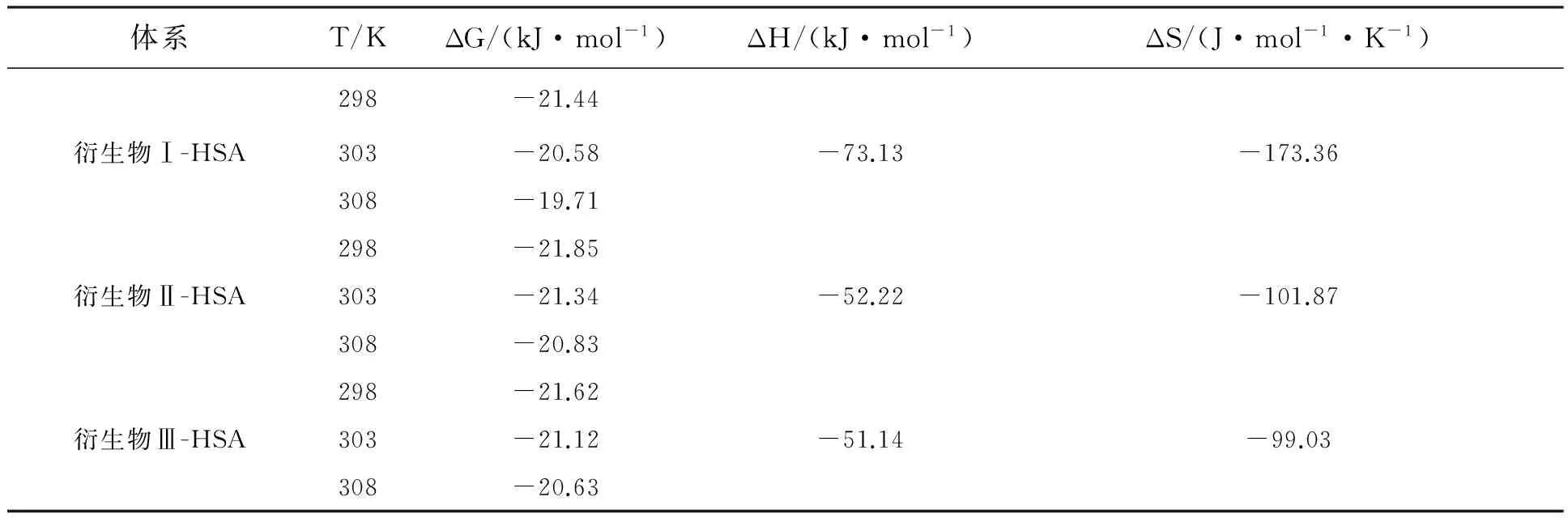
表5 HSA与不同衍生物结合的热力学参数
3.5.6不同衍生物对HSA构象的影响
衍生物Ⅱ与HSA结合的同步荧光光谱见图7(衍生物Ⅰ/Ⅲ-HSA体系图形与之类似)。随着衍生物浓度的升高,HSA内源性荧光强度明显降低。Δλ=15 nm时,最大发射波长基本保持不变,表明Tyr周围环境基本不变;而Δλ=60 nm时,最大发射波长出现了明显红移,表明Trp周围环境极性变大,疏水性减小[26-27]。这是由于衍生物与HSA结合形成复合物后,HSA二级结构构象发生明显变化,内部肽链伸展程度出现一定程度的增加,疏水腔内部结构发生不同程度瓦解,导致Trp基本全部裸露于介质的亲水环境中[28-29]。

a~j:c(HSA) = 1.0×10-5mol·L-1,c(Ⅱ)=0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0 ×10-5mol·L-1; k:c(Ⅱ) = 1.0×10-5mol·L-1
图7衍生物Ⅱ与HSA结合的同步荧光光谱
Fig.7Synchronous fluorescence spectra of derivative Ⅱ-HSA
3.5.7分子模拟研究衍生物与HSA的相互作用
3种衍生物分别与HSA的分子对接模型见图8,结合时均主要处于其亚结构域ⅡA口袋。衍生物Ⅰ与Lys195、Trp214、Val344、Arg348、Glu450、Asp451、Leu481、Val482、Arg484、Arg485形成氢键,周围还存在着疏水作用残基Val343、Ser454、Asn483、Pro486。衍生物Ⅱ与Trp214、Val343、Leu345、Arg348、Met446、Leu457、Asn458、Ser480、Leu481、Arg484、Arg485形成氢键,周围还存在着疏水作用残基Trp214、Val344、Glu450、Ser454。衍生物Ⅲ与Lys195、Trp214、Arg218、Arg222、Glu450、Leu453、Ser454、Leu457、Asn458、Arg484形成氢键,周围还存在着疏水作用残基Leu198、Val343、Val344、Asp451、Leu481、Arg485。结果表明,HSA分别与3种衍生物的结合都影响了分子内部Trp214周围的微环境,导致内源性荧光出现猝灭现象。衍生物与HSA结合的主要作用力是范德华力和氢键,兼有部分疏水作用。对接得到不同衍生物与HSA结合的-G分别为-21.52 kJ·mol-1(Ⅰ-HSA),-26.79 kJ·mol-1(Ⅱ-HSA)和-25.49 kJ·mol-1(Ⅲ-HSA),计算值与实验值存在略微差异,可能是因为对接时以HSA晶体形态进行,而实验时两者均处于溶液环境[14,30]。
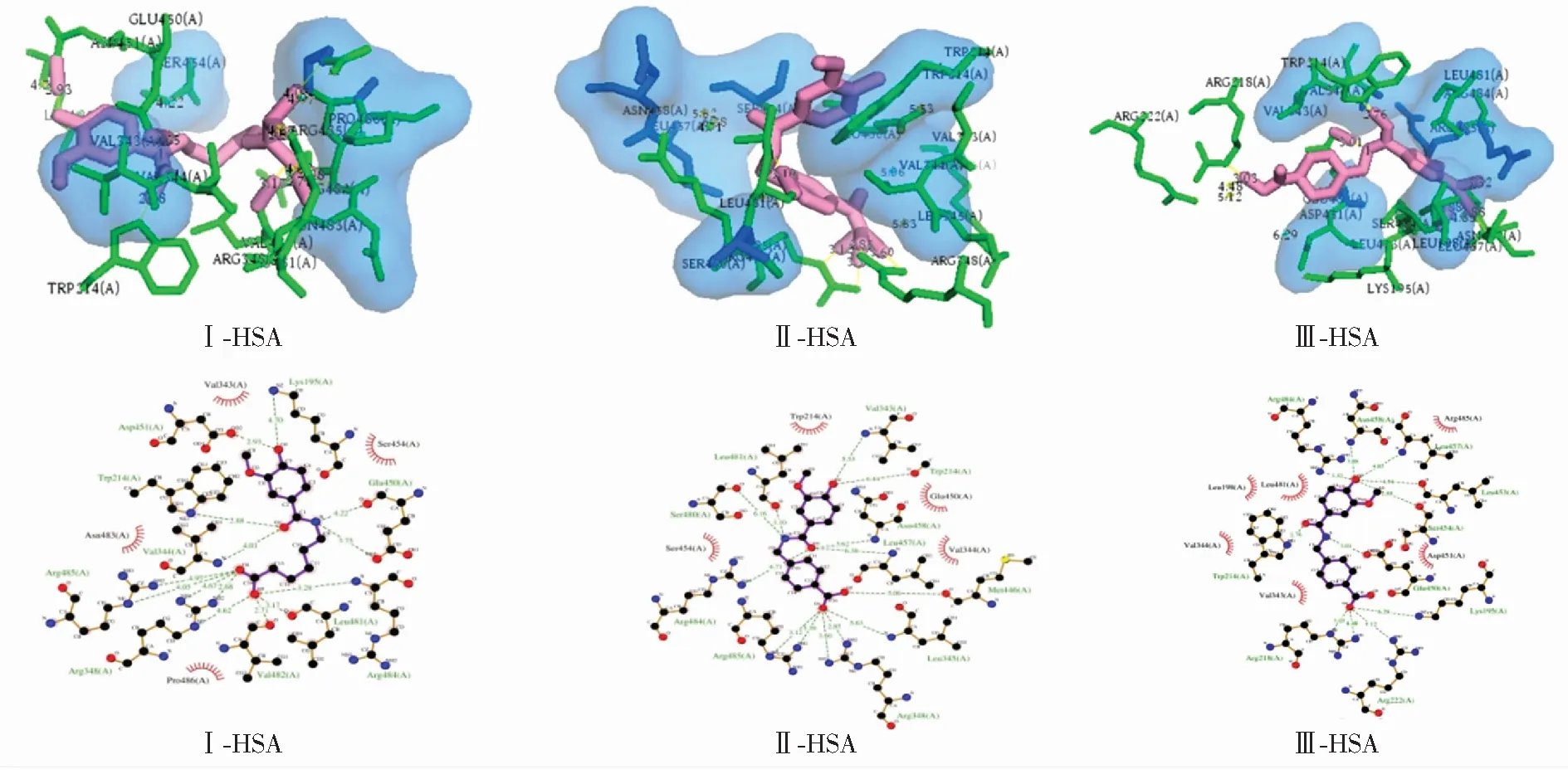
图8 HSA与不同衍生物结合的分子对接图
4 结 论
血浆复钙实验测试结果表明,与正常对照组比较,3种衍生物在一定浓度范围内可明显缩短PRT,表现出良好的止血活性。其中衍生物Ⅱ促凝效果最佳,在一定浓度范围内优于阳性对照止血芳酸组。荧光动力学法和紫外动力学法不仅可以有效避免传统方法引入的人为误差,而且重现性良好,判断标准更加科学,同时可以获得更多血浆凝结过程的信息。光谱实验和分子对接结果表明,3种衍生物均可以与HSA相互结合形成稳定复合物,作用力类型均主要是范德华力和氢键。3种香草酸酰胺衍生物均可以HSA为载体,通过血液运输到达作用部位发生药理作用,有望进入临床促凝药物的筛选范围。
[1]PUSATERI A E,HOLCOMB J B,KHEIRABADI B S,et al..Making sense of the preclinical literature on advanced hemostatic products [J].J.Trauma,2006,60(3):674-682.
[2]李冬冬,吴岳林,缪震元,等.羧甲基壳聚糖络合碘复合材料的合成和止血活性评价 [J].药学实践杂志,2015,33(2):125-126.
LI D D,WU Y L,MIAO Z Y,et al..Synthesis and hemostasis activity of iodine complex with carboxymethyl chitosan [J].J.Pharm.Practice,2015,33(2):125-126.(in Chinese)
[3]吕小星.新型战伤急救止血剂中各组分比例的实验研究 [D].西安:第四军医大学,2010.
LV X X.Study on The Components of A New Type of Hemostat for Combat Injury [D].Xi’an:Fourth Military Medical University,2010.(in Chinese)
[4]SUGAMORI T,IWASE H,MAEDA M,et al..Local hemostatic effects of microcrystalline partially deacetylated chitin hydrochloride [J].J.Biomed.Mater.Res.,2000,49(2):225-232.
[5]WANG X H,YAN Y N,ZHANG R J.A comparison of chitosan and collagen sponges as hemostatic dressings [J].J.Bioact.Compat.Polym.,2006,21(1):39-54.
[6]杨美玲,宋玉民,卢小泉.水溶性β-环糊精与华法林/阿魏酸包合物的制备及抗凝血性质测试和机理分析 [J].分析化学,2015,43(6):836-842.YANG M L,SONG Y M,LU X Q.Preparation,anticoagulant property test and mechanism discussion of water soluble compound of β-cyclodextrin with warfarin/frulic acid [J].Chin.J.Anal.Chem.,2015,43(6):836-842.(in Chinese)
[7]MANSOURI A,MAKRIS D P,KEFALAS P.Determination of hydrogen peroxide scavenging activity of cinnamic and benzoic acids employing a highly sensitive peroxyoxalate chemiluminescence-based assay:structure-activity relationships [J].J.Pharm.Biomed.Anal.,2005,39(1-2):22-26.
[8]KANSKI J,AKSENOVA M,STOYANOVA A,et al..Ferulic acid antioxidant protection against hydroxyl and peroxyl radical oxidation in synaptosomal and neuronal cell culture systems in vitro:structure-activity studies [J].J.Nutr.Biochem.,2002,13(5):273-281.
[9]CHON S U,CHOI S K,JUNG S,et al..Effects of alfalfa leaf extracts and phenolic allelochemicals on early seedling growth and root morphology of alfalfa and barnyard grass [J].Crop Prot.,2002,21(10):1077-1082.
[10]IWATA M,CORN T,IWATA S,et al..The relationship between tyrosinase activity and skin color in human foreskins [J].J.Invest.Dermatol.,1990,95(1):9-15.
[11]GUNTHORPE M J,BENHAM C D,RANDALL A,et al..The diversity in the vanilloid (TRPV) receptor family of ion channels [J].Trends Pharmacol.Sci.,2002,23(4):183-191.
[12]赵芳,黄超锋,梁慧,等.大黄酸锌配合物与牛血清白蛋白相互作用的研究 [J].分析化学,2011,39(3):401-404.ZHAO F,HUANG C F,LIANG H,et al..Interaction of Zn Ⅱ complex of rhein with bovine serum albumin [J].Chin.J.Anal.Chem.,2011,39(3):401-404.(in Chinese)
[13]GE Y S,JIN C,SONG Z,et al..Multi-spectroscopic analysis and molecular modeling on the interaction of curcumin and its derivatives with human serum albumin:a comparative study [J].Spectrochim.Acta,Part A,2014,124:265-276.
[14]ZHANG X H,LIN Y J,LIU L N,et al..Study on the synthesis of sulfonamide derivatives and their interaction with bovine serum albumin [J].J.Lumin.,2015,30(3):269-279.
[15]隋婧.青蒿体外止血活性部位筛选及其应用研究 [D].重庆:重庆大学,2009.
SUI J.Screening The Hemostatic Active Fraction of Artemisia Annua L.in Vitro and The Exploratory Development [D].Chongqing:Chongqing University,2009.(in Chinese)
[16]LUO X,DU C R,WEI J R,et al..Study of the interaction between sodium salts of (2E)-3-(4'-halophenyl)prop-2-enoyl sulfachloropyrazine and bovine serum albumin by fluorescence spectroscopy [J].J.Lumin.,2013,28(2):202-210.
[17]银鸿雁,郑学仿,曹洪玉,等.4-硫胸苷的合成及其与人血清白蛋白的相互作用 [J].发光学报,2013,34(1):104-110.
YING H Y,ZHENG X F,CAO H Y,et al..Synthesis of 4-thiothymidine and its interaction with human serum albumin [J].Chin.J.Lumin.,2013,34(1):104-110.(in Chinese)
[18]DU C R,LUO X,WEI J R,et al..Preparation of (2E)-3-(4′-halophenyl)prop- 2-enoyl sulfachlorpyridazine sodium salts and their interaction with bovine serum albumin by fluorescence spectroscopy [J].Chem.Res.Chin.Univ.,2013,29(5):854-860.
[19]TUNC S,DUMAN O,SOYLU I,et al..Study on the bindings of dichlorprop and diquat dibromide herbicides to human serum albumin by spectroscopic methods [J].J.Hazard.Mater.,2014,273:36-43.
[20]刘保生,王晶,薛春丽,等.头孢噻肟钠和氯霉素与牛血清白蛋白相互作用的荧光光谱分析 [J].发光学报,2011,32(6):628-635.
LIU B S,WANG J,XUE C L,et al..Fluorescence analysis of the interaction between cefotaxime sodium and chloramphenicol as well as bovine serum albumin [J].Chin.J.Lumin.,2011,32(6):628-635.(in Chinese)
[21]GENG B,LIU X,TIAN Y L,et al..Investigation on the interaction between endocrine disruptor triphenyltin with human serum albumin [J].Spectrochim.Acta,Part A,2014,120:512-516.
[22]RASOULZADEH F,ASGARI D,NASERI A,et al..Spectroscopic studies on the interaction between erlotinib hydrochloride and bovine serum albumin [J].Daru,J.Pharm.Sci.,2010,18(3):179-184.
[23]CUI F L,FAN J,LI W,et al..Fluorescence spectroscopy studies on 5-aminosalicylic acid and zinc 5-aminosalylicylate interaction with human serum albumin [J].J.Pharm.Biomed.Anal.,2004,34(1):189-197.
[24]谢孟峡,徐晓云,王英典,等.4′,5,7-三羟基二氢黄酮与人血清白蛋白相互作用的光谱学研究 [J].化学学报,2005,63(22):2055-2062.
XIE M X,XU X Y,WANG Y D,et al..Spectroscopic investigation of the interaction between 2,3-dihydro-4′,5,7-trihydroxyflavone and human serum albumin [J].Acta Chim.Sinica,2005,63(22):2055-2062.(in Chinese)
[25]QIAN Y J,ZHOU X F,CHEN J B,et al..Binding of bezafibrate to human serum albumin:insight into the non-covalent interaction of an emerging contaminant with biomacromolecules [J].Molecules,2012,17:6821-6831.
[26]ALI M S,AL-LOHEDAN H A.Interaction of human serum albumin with sulfadiazine [J].J.Mol.Liq.,2014,197:124-130.
[27]WANG Y Q,ZHANG H M,ZHANG G C,et al..Studies of the interaction between paraquat and bovine hemoglobin [J].Int.J.Biol.Macromol.,2007,41(3):243-250.
[28]LI J F,LI J Z,JIAO Y,et al..Spectroscopic analysis and molecular modeling on the interaction of jatrorrhizine with human serum albumin (HSA) [J].Spectrochim.Acta,Part A,2014,118:48-54.
[29]CUI F L,WANG J L,CUI Y R,et al..Fluorescent investigation of the interactions between N-(p-chlorophenyl)-N′-(1-naphthyl) thiourea and serum albumin:synchronous fluorescence determination of serum albumin [J].Anal.Chim.Acta,2006,571(2):175-183.
[30]JANA S,DALAPATI S,GHOSH S,et al..Binding interaction between plasma protein bovine serum albumin and flexible charge transfer fluorophore:a spectroscopic study in combination with molecular docking and molecular dynamics simulation [J].J.Photochem.Photobiol.,A,2012,231(1):19-27.

杜传荣(1988-),女,山东滕州人,博士研究生,2010年于广西大学获得学士学位,主要从事天然药物化学方面的研究。
E-mail:duchuanrong123@163.com

林翠梧(1958-),女,广西北流人,教授,博士生导师,2000年于中山大学获得博士学位,主要从事天然药物化学方面的研究。
E-mail:cuiwulin114@163.com
Synthesis of Vanillylamide Derivatives and Their Hemostatic Activity in Vitro by Kinetics Methods
DU Chuan-rong1,LIN Fa-quan2,LU Dong-wei1,CHEN Dan-dan1,FAN Xi-wang3,LIN Cui-wu1,4*
(1.School of Chemistry and Chemical Engineering,Guangxi University,Nanning 530004,China;2.First Affiliated Hospital of Guangxi Medical University,Nanning 530021,China;3.Nanning Chemical Industry Research & Design Institute,Nanning 530022,China;4.Guangxi Colleges and Universities Key Laboratory of Applied Chemistry Technology and Resource Development,Nanning 530004,China)
Three novel amide derivatives were designed and prepared by the reaction of vanillic acid with 6-aminocaproic acid (EACA),p-aminomethylbeozoic acid (AMBA) or tranexamic acid (AMCA),respectively.The structures were identified by IR,ESI-MS,1H NMR and13C NMR.In order to study their hemostatic activity in vitro,the plasma recalcification time (PRT) was determined by traditional method,fluorescence kinetics method and UV kinetics method,respectively.In order to study the stability of derivatives in blood,the interaction between derivatives and human serum albumin (HSA) was investigated under imitated physiological condition by fluorescence spectroscopy,UV-visible absorption spectroscopy and molecular docking,respectively.The results stated clearly that derivatives could reduce PRT significantly and exhibit obvious procoagulant effect in vitro.Moreover,in some concentrations,the hemostatic activity of derivative Ⅱ was better than AMBA.The results obtained by three different methods were in correspondence.New kinetics methods not only avoided artificial error effectually but also had good repeatability.In addition,more reasonable and credible information could be obtained in the process of serum agglutination.On the other hand,the spectra experiments showed that three derivatives could all form stable complexes with HSA respectively.The binding types between derivatives and HSA were all van der Waals force and hydrogen bonds.The results were accordant with molecular docking.It indicates that all the derivatives can be transferred and delivered by HSA to play pharmacological effects at corresponding site.Consequently,there is a strong possibility that the three vanillylamide derivatives can be applied to practice.
vanillic acid; amide derivatives; hemostasia; human serum albumin (HSA); spectroscopic methodology
1000-7032(2016)04-0487-11
2015-11-26;
2016-01-12
广西研究生教育创新计划(YCBZ2013011);广西自然科学基金重点项目(2013GXNSFDA019005);国家自然科学基金(21362001)资助项目
O625.5
A
10.3788/fgxb20163704.0487
