光谱法结合分子模拟技术研究左氧氟沙星与胃蛋白酶的相互作用机理
2016-10-10曾华金李梦婷胡菲菲
曾华金,李梦婷,李 晴,胡菲菲
(郑州大学 药学院,河南 郑州 450001)
光谱法结合分子模拟技术研究左氧氟沙星与胃蛋白酶的相互作用机理
曾华金*,李梦婷,李晴,胡菲菲
(郑州大学 药学院,河南 郑州450001)
在模拟生理条件下,采用荧光光谱法结合分子对接技术研究了左氧氟沙星与胃蛋白酶的相互作用。不同温度下的Stern-Volmer曲线结果表明,左氧氟沙星主要以静态猝灭的方式使胃蛋白酶的荧光产生猝灭。由热力学数据确定了两者之间存在的作用力主要为静电作用力。三维荧光光谱实验结果表明,在左氧氟沙星与胃蛋白酶发生作用过程中引起了胃蛋白酶中酪氨酸和色氨酸残基构象的变化,从而导致胃蛋白酶发生了猝灭作用。为了进一步探讨左氧氟沙星与胃蛋白酶相互作用的分子机理,利用分子对接技术对两者的相互作用进行模拟。结果表明两者发生作用的区域位于胃蛋白酶的催化活性中心,左氧氟沙星的进入导致酶催化中心氨基酸残基的微环境发生改变,从而对胃蛋白酶的活性造成影响,这可能也是左氧氟沙星引起消化不良的主要原因。
左氧氟沙星;胃蛋白酶;相互作用;荧光光谱;分子对接
*Corresponding Author,E-mail:zenghuajin@sina.com.cn
1 引 言
左氧氟沙星(Levofloxacin,LEFX)属第3代喹诺酮类抗菌药物,其主要的作用机制是通过抑制细菌DNA旋转酶的活性来阻碍细菌DNA的合成,最终导致细菌死亡。结构上,左氧氟沙星是氧氟沙星(Oflaxacin,OFLX)的左旋体,但体外抗菌活性却是氧氟沙星的2 倍,因而在临床上比氧氟沙星更广泛地应用于各种感染性疾病的预防与治疗[1]。然而,随着左氧氟沙星在临床上使用频率的增加,与之相关的药物不良反应也在不断地呈现,如过敏性休克、皮肤瘙痒、血管神经性水肿、恶心、呕吐、腹泻等[2]。
胃蛋白酶(Pepsin,PEP)是Theodor Schwann在1836年发现的第一个动物酶,属于天冬氨酸酶家族中的一员,由机体胃部的胃粘膜主细胞分泌,能高效地将食物中的蛋白质分解为小肽片段,在机体的消化系统中起着非常重要的作用[3]。然而,当药物分子经口服进入胃后,必定会与胃蛋白酶发生作用,继而可能影响胃蛋白酶的消化活性,从而引起诸如恶心、呕吐等症状。因此,研究药物小分子与胃蛋白酶的相互作用能对药物引起的消化不良反应提供科学依据。目前,已有研究人员利用光谱法研究普卢利沙星[4]、加替沙星[5]、乳酸左氧氟沙星[6]等与胃蛋白酶相互作用的报道,但利用光谱法结合分子模拟技术研究左氧氟沙星与胃蛋白酶的相互作用却未见报道。
基于以上原因,本文应用荧光光谱法研究了不同温度条件下左氧氟沙星与胃蛋白酶的相互作用,并利用分子对接技术对其相互作用过程进行了分子模拟,旨在探讨左氧氟沙星与胃蛋白酶之间的作用机制,从而为左氧氟沙星引起的消化不良反应做出科学的解释。
2 实 验
2.1主要仪器与试剂
实验中使用的仪器主要有荧光分光光度计(Hitatch F-4500,Japan)、紫外分光光度计(UV-2660,Japan)、电子分析天平(CP214,China)、恒温水浴(DK-98-ПA,China)和酸度计(pH-3S,China)。
左氧氟沙星标准品(购于中国药品生物制品检定所)用双蒸水配成1.0×10-3mol·L-1的溶液于4 ℃下保存备用。胃蛋白酶储备液用0.2 mol·L-1磷酸氢二钠-柠檬酸缓冲液(pH=2.0)配成,浓度为2.5×10-4mol·L-1,在4 ℃下保存备用。
2.2实验方法
2.2.1荧光光谱测定
在具塞试管(10 mL)中,依次加入100 μL 胃蛋白酶溶液(2.5×10-4mol·L-1)和不同量的左氧氟沙星溶液,然后用缓冲液定容至5 mL。将试管置于恒温水浴(20 ℃和37 ℃)中温育10 min,在290~500 nm波长范围内进行光谱扫描,记录胃蛋白酶的荧光光谱变化(λex/λem=280/338 nm,狭缝宽度5.0/5.0 nm)。
2.2.2分子对接
胃蛋白酶晶体(PDB ID∶5PEP)结构来自蛋白质数据库(Protein Data Bank)。左氧氟沙星的二维结构在ChemDraw Ultra 8.0软件中绘制,同时采用3D模型中的分子力学(MM+力场)对其三维结构进行优化。使用AutoDock 4.0软件对左氧氟沙星和胃蛋白酶分子进行对接,用Larmarckian genetic algorithm来预测两者对接时左氧氟沙星可能存在的分子构象。
3 结果与讨论
3.1左氧氟沙星对胃蛋白酶荧光光谱的影响
蛋白质的内源荧光主要表现为分子内苯丙氨酸、酪氨酸和色氨酸残基的发射[7]。由图1可见,随着左氧氟沙星浓度的增加,胃蛋白酶的荧光发射强度均呈现有规律的猝灭,并且还伴随着一定程度的红移。荧光强度的下降及红移现象表明氧氟沙星与胃蛋白酶的结合导致胃蛋白酶中生色基团的微环境发生了改变[8-9],使生色基团进入一个更加亲水的环境中,左氧氟沙星与胃蛋白酶彼此发生了相互作用。

CPEP=3.0×10-6mol·L-1; 由上到下 CLEFX=(0,2.0,4.0,6.0,8.0,10.0,12.0,14.0,16.0,18.0)×10-6mol·L-1
图1左氧氟沙星对胃蛋白酶荧光光谱的影响
Fig.1Effect of LEFX on fluorescence spectra of PEP
3.2荧光猝灭机理
荧光猝灭作用根据作用机理的不同通常可以分为动态猝灭和静态猝灭。对于荧光猝灭是动态还是静态,可以通过动态猝灭常数(Ksv)和静态猝灭常数(Kq)的结合程度来判断[5]。为了探讨左氧氟沙星与胃蛋白酶之间的猝灭机理,我们首先将猝灭机理按动态猝灭来处理。根据Stern-Volmer方程[10]:
(1)
式中F0为左氧氟沙星加入前胃蛋白酶的荧光强度,F为左氧氟沙星加入后的胃蛋白酶的荧光强度,Kq为双分子猝灭过程的速率常数,τ0是猝灭剂不存在时生物大分子的平均荧光寿命(10-8s),C为左氧氟沙星的浓度,Ksv为动态猝灭常数。以F0/F对C作图,得到不同实验条件下的Stern-Volmer图(图2)。

图2 左氧氟沙星与胃蛋白酶相互作用的Stern-Volmer图
根据方程(1)计算得出相应的参数,结果见表1。由表1可以看出,Ksv和Kq都随温度的升高而降低,表明左氧氟沙星对胃蛋白酶荧光的猝灭是由静态猝灭引起的。此外,不同猝灭剂对生物大分子的最大扩散碰撞猝灭常数为2.0×1010L·mol-1·s-1[11-12],而实验中所得到的Kq值无论在293 K还是310 K,均远远大于2.0×1010L·mol-1·s-1,这一结果进一步说明左氧氟沙星对胃蛋白酶的猝灭是由于形成了化合物而引起的静态猝灭。

表1 左氧氟沙星与胃蛋白酶相互作用的Stern-Volmer猝灭常数
3.3结合常数与结合位点数计算
药物小分子与生物大分子之间的结合常数和结合位点数可通过以下方程计算获得[7]:

图3左氧氟沙星与胃蛋白酶相互作用的lg(F0-F)/F对lg{1/[Cd-(F0-F) Cp/F0]}曲线
Fig.3Plots of lg(F0-F)/F vs.lg{1/[Cd-(F0-F) Cp/F0]} of LEFX-PEP system
(2)
式中,Cp为胃蛋白酶总浓度,Cd为左氧氟沙星总浓度,n为结合位点数,Ka为结合常数。以lg(F0-F)/F对lg{1/[Cd- (F0-F)Cp/F0]}作图(图3),然后根据所得到的方程,计算结合常数和结合位点数,结果见表2。从表2可以看出,左氧氟沙星与胃蛋白酶的结合位点数均约为1,表明一分子的胃蛋白酶可以结合一分子的左氧氟沙星;Ka值均大于1×104L·mol-1,说明左氧氟沙星与胃蛋白酶之间发生了较强的相互作用。

表2 左氧氟沙星与胃蛋白酶的结合常数和结合位点数
3.4作用力类型
药物小分子与蛋白质的相互作用力通常包括氢键、范德华力、静电作用力、疏水作用力4种,而药物小分子与蛋白质的相互作用力的类型可以从热力学参数的大小进行判断。当ΔH>0,ΔS>0时,相互作用力主要表现为疏水作用力;当ΔH<0,ΔS>0时,主要表现为静电作用力;当ΔH<0,ΔS<0时,则主要表现为氢键或者是范德华力[13]。根据热力学公式:
(3)

(4)
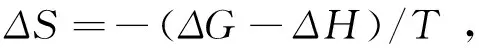
(5)
计算得到左氧氟沙星与胃蛋白酶相互作用的热力学参数及主要作用力类型,结果见表3。由表3可知,ΔG都小于0,说明左氧氟沙星与胃蛋白酶的作用过程是自发进行的;而ΔH<0,ΔS>0表明左氧氟沙星与胃蛋白酶的结合主要以静电引力为主。
表3左氧氟沙星与胃蛋白酶相互作用的热力学参数和主要作用力类型
Tab.3Thermodynamic parameters and acting forces of PEP with LEFX

T/K△H/(kJ·mol-1)△S/(J·K-1·mol-1)△G/(kJ·mol-1)293-1.4988.49-27.43310-1.4988.49-28.93
3.5三维荧光光谱
三维荧光图谱不仅能提供更加完整的荧光光谱信息,也能更加直观地呈现猝灭剂引起荧光大分子的荧光强度变化以及分析蛋白质或酶的构象变化[14]。图4为胃蛋白酶和左氧氟沙星与胃蛋白酶复合物的三维荧光光谱等高线图。从图中可以看出,胃蛋白酶荧光峰的位置为λem=335 nm和λex=280 nm,而与左氧氟沙星发生相互作用后,胃蛋白酶荧光峰的位置发生了红移(λem=340 nm和λex=285 nm),这一结果表明,左氧氟沙星的加入导致了胃蛋白酶微环境及构象上的变化,从而引起了胃蛋白酶内源荧光的猝灭作用。此外,从荧光强度可以看出,加入左氧氟沙星后,胃蛋白酶的荧光强度明显降低,这一结果进一步表明两者发生了相互作用,且是由于引起胃蛋白酶中酪氨酸和色氨酸残基所处的微环境变化而引起的猝灭。
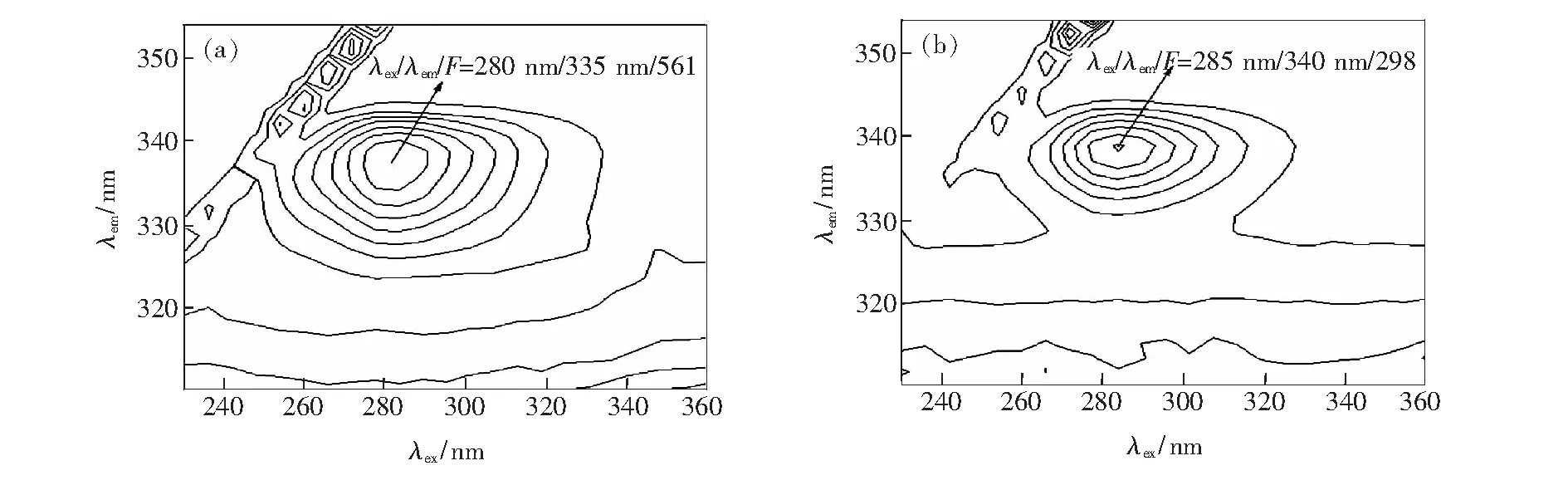
图4胃蛋白酶和左氧氟沙星与胃蛋白酶复合物三维等高线图。 (a) 胃蛋白酶三维荧光图,CPEP=3.0×10-6mol·L-1; (b) 左氧氟沙星与胃蛋白酶复合物三维荧光图,CPEP=3.0×10-6mol·L-1,CLEFX=12.0×10-6mol·L-1。
Fig.4Three-dimensional fluorescence contour spectra of PEP (a) and LEFX-PEP systems (b).(a) CPEP=3.0×10-6mol·L-1.(b) CPEP=3.0×10-6mol·L-1,CLEFX=12.0×10-6mol·L-1.
3.6分子对接
胃蛋白酶是一种由326个氨基酸残基组成的单链蛋白酶,催化活性位点位于整个蛋白酶分子的中间区域,由六股反平行的β-折叠所组成[15]。为了进一步说明左氧氟沙星与胃蛋白酶结合并发生相互作用时对胃蛋白酶的构象及活性的影响,我们运用分子模拟技术将这一过程作更深入的探讨。由分子对接结果可知,左氧氟沙星与胃蛋白酶的结合能ΔG为-6.48 kcal·mol-1(即-27.10 kJ·mol-1),这一结果与实验所得的结果(-27.43 kJ·mol-1)较为一致,表明这一结合模式可以较为真实地反映左氧氟沙星与胃蛋白酶的相互作用方式。图5为左氧氟沙星与胃蛋白酶最佳构象图。由图5可以看出,左氧氟沙星与胃蛋白酶的作用中心位于胃蛋白酶的催化活性中心,并且左氧氟沙星分子周围包围着多个氨基酸残基,其中包括疏水性氨基酸残基8个:ILE30、GLY34、TYR75、GLY76、PHE111、ILE120、TYR189和GLY217;亲水性氨基酸残基6个:GLU13、ASP32、SER35、THR74、THR77和THR218,这一结果表明,左氧氟沙星与胃蛋白酶之间的作用力主要以静电引力为主,但同时也可能存在疏水作用力。这些氨基酸残基中含有TYR75、PHE111、TYR189等发色基团,当左氧氟沙星进入胃蛋白酶的催化活性中心时,必然对这些发色基团的微环境造成影响,使它们的疏水环境发生改变,因而造成胃蛋白酶的荧光发生猝灭作用。

图5LEFX与PEP相互作用的分子对接图。(a)胃蛋白酶的活性中心;(b)左氧氟沙星与胃蛋白酶发生作用区域;(c)左氧氟沙星与胃蛋白酶催化活性中心发生作用的氨基酸残基,虚线为氢键。
Fig.5Computation docking model of the interaction between LEFX and PEP.(a) Catalytic site of PEP.(b) Binding site in the PEP cavity.(c) Detailed illustration of the amino acid residues lining the binding site in the PEP cavity.Broken lines display hydrogen bonds.
此外,由于还存在离子型氨基酸残基(如GLU13、ASP32和GLY34),左氧氟沙星与这些氨基酸残基还会形成氢键,如图5所示,左氧氟沙星与GLU13、ASP32和GLY34所形成的氢键键长分别为0.175,0.274,0.221 nm(1.75,2.74,2.21 Å),因此,左氧氟沙星与胃蛋白酶之间的作用力还存在氢键。胃蛋白酶属于天冬氨酸蛋白酶家族,其催化位点上天冬氨酸ASP32和ASP215两种残基所组成,当一个天冬氨酸残基质子化、另一个天冬氨酸残基去质子化时,蛋白酶就会产生活性[16]。从对接结果可以看到,左氧氟沙星只与一个天冬氨酸ASP32形成氢键,而与ASP215不发生相互作用,这样就导致胃蛋白酶的活性受到抑制,这可能也是左氧氟沙星引起消化不良的原因。
4 结 论
采用荧光光谱法和分子对接技术研究了左氧氟沙星与胃蛋白酶的相互作用。左氧氟沙星和胃蛋白酶形成基态复合物,导致胃蛋白酶的荧光猝灭。通过计算,确定了左氧氟沙星和胃蛋白酶作用的猝灭机理、结合常数、结合位点及主要作用力,并且利用分子对接技术,对左氧氟沙星与胃蛋白酶相互作用的过程进行了分子模拟,从而为阐明左氧氟沙星引起消化不良症状提供科学依据。
[1]DAVIS R,BRYSON H M.Levofloxacin:a review of its antibacterial activity,pharmacokinetics and therapeutic efficacy [J].Drugs,1994,47(4):677-700.
[2]陈百泉,王楠.409例左氧氟沙星不良反应/事件文献分析 [J].中国医药,2015,24(2):61-63.
CHEN B Q,WANG N.Literature analysis on 409 cases of adverse drug reactions/events caused by levofloxacin [J].China Pharm.,2015,24(2):61-63.(in Chinese)
[3]GOLE A,DASH C,RAO M,et al..Encapsulation and biocatalytic activity of the enzyme pepsin in fatty lipid films by selective electrostatic interactions [J].Chem.Commun.,2000(4):297-298.
[4]HUANG Y B,YAN J,LIU B Z,et al..Investigation on interaction of prulifloxacin with pepsin:a spectroscopic analysis [J].Spectrochim.Acta Part A,2010,75(3):1024-1029.
[5]廉淑芹,杨冬芝,郑笑笑,等.应用荧光光度法研究加替沙星与胃蛋白酶的相互作用 [J].理化分析,B:化学分析,2013,49(3):253-255.
LIAN S Q,YANG D Z,ZHENG X X,et al..Study on interaction of gatifloxacin with pepsin by fluorospectrophotometry [J].Phys.Test.Chem.Anal.Part B:Chem.Anal.,2013,49(3):253-255.(in Chinese)
[6]WU K.The Fluorescence Study on The Reciprocities Between The Quinolones Antibiotics and Biological Molecules [D].Chengdu:Sichuan Normal University,2009.(in Chinese)
[7]BI S Y,DING L,TIAN Y,et al..Investigation of the interaction between flavonoids and human serum albumin [J].J.Mol.Struct.,2004,703(1-3):37-45.
[8]刘保生,韩荣,李志云,等.硝基羟乙唑与溶菌酶反应机制的荧光光谱研究 [J].发光学报,2015,36(12):1458-1463.
LIU B S,HAN R,LI Z Y,et al..Investigation of the interaction mechanism between lysozyme and trichazol using fluorescence spectroscopic method [J].Chin.J.Lumin.,2015,36(12):1458-1463.(in Chinese)
[9]王宁,刘忠英,金蕊,等.应用磁金纳米粒子研究牛血清白蛋白与牛蒡子苷之间的相互作用 [J].分析化学,2015,43(4):528-533.
WANG N,LIU Z Y,JIN R,et al..Application of magnetic gold nanoparticles for interaction between bovine serum albumin and arctiin [J].Chin.J.Anal.Chem.,2015,43(4):528-533.(in Chinese)
[10]YANG R,YU L L,ZENG H J,et al..The interaction of flavonoid-lysozyme and the relationship between molecular structure of flavonoids and their binding activity to lysozyme [J].J.Fluoresc.,2012,22(6):1449-1459.
[11]LAKOWICZ J R,WEBER G.Quenching of protein fluorescence by oxygen.Detection of structural fluctuations in proteins on the nanosecond time scale [J].Biochemistry,1973,12(21):4171-4179.
[12]CHI Z X,LIU R T,ZHANG H.Noncovalent interaction of oxytetracycline with the enzyme trypsin [J].Biomacromolecules,2010,11(9):2454-2459.
[13]ROSS P D,SUBRAMANIAN S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[14]DONG C Y,MA S Y,LIU Y.Studies of the interaction between demeclocycline and human serum albumin by multi-spectroscopic and molecular docking methods[J].Spectrochim.Acta Part A,2013,103:179-186.
[15]QI W,SU R X,HE Z M,et al..Pepsin-induced changes in the size and molecular weight distribution of bovine casein during enzymatic hydrolysis[J].J.Dairy Sci.,2007,90(11):5004-5011.
[16]ANTONOV V K,GINODMAN L M,KAPITANNIKOV Y V,et al..Mechanism of pepsin catalysis:general base catalysis by the active-site carboxylate ion [J].FEBS Lett.,1978,88(1):87-90.

曾华金(1977-),男,广东五华县人,博士,副教授,2006年于中国药科大学获得博士学位,主要从事天然产物相关活性及其分析方面的研究。
E-mail:zenghuajin@sina.com
Mechanism of Interaction Between Levofloxacin and Pepsin by Spectroscopic and Molecular Docking Methods
ZENG Hua-jin*,LI Meng-ting,LI Qing,HU Fei-fei
(School of Pharmaceutical Sciences,Zhengzhou University,Zhengzhou 450001,China)
The binding of levofloxacin (LEFX) with pepsin (PEP) was investigated by spectroscopic and molecular docking methods under simulated physiological conditions.LEFX effectively quenched the fluorescence of PEP by a static quenching process.Based on the results of binding capacity,the thermodynamic parameters were calculated and the molecular docking was studied.It is concluded that the LEFX can spontaneously bind with PEP mainly through electrostatic forces.The three-dimensional fluorescence spectra reveal that the microenvironment and conformation of PEP are demonstrably changed in the presence of LEFX.Since the binding of LEFX can affect the microenvironment of the PEP activity site,LEFX causes the inhibition of PEP activity.
levofloxacin; pepsin; interaction; fluorescence spectroscopy; molecular docking
1000-7032(2016)04-0481-06
2015-12-13;
2016-01-24
O657.3
A
10.3788/fgxb20163704.0481
