甲型副伤寒沙门氏菌cdtB亚基的原核表达及对巨噬细胞IL-6、IL-8、TNF-α分泌的影响
2016-08-25陈鸿鹄吴圆圆梅玲玲
陈鸿鹄,吴圆圆,占 利,梅玲玲
甲型副伤寒沙门氏菌cdtB亚基的原核表达及对巨噬细胞IL-6、IL-8、TNF-α分泌的影响
陈鸿鹄1,吴圆圆2,占利1,梅玲玲1
目的研究甲型副伤寒沙门氏菌感染过程中,cdtB对宿主巨噬细胞分泌促炎细胞因子的影响。NF-κB信号通路阻断剂对cdtB诱导的巨噬细胞分泌细胞因子的影响。方法对甲型副伤寒沙门氏菌cdtB亚基进行原核表达,制备并模型纯化重组蛋白,建立其刺激人THP-1巨噬细胞模型,ELISA检测THP-1分泌IL-6,IL-8和TNF-α等细胞因子。在共培养体系中加入NF-κB 信号通路阻断剂,ELISA检测THP-1分泌IL-6,IL-8和TNF-α等细胞因子。结果成功构建甲型副伤寒沙门氏菌cdtB原核表达系统,表达并纯化重组cdtB蛋白,与空白对照相比,受到cdtB刺激的THP-1细胞上清中的IL-6,IL-8和TNF-α浓度显著上升,而在THP-1细胞培养基中加入NF-κB信号通路阻断剂SN50可以显著抑制重组cdtB诱导的IL-6、IL-8、TNF-α分泌。结论甲型副伤寒沙门氏菌cdtB能够通过NF-κB信号通路诱导巨噬细胞分泌IL-6、IL-8和TNF-α,在甲型副伤寒相关的炎症反应中发挥促进作用。
甲型副伤寒沙门氏菌; cdtB;细胞因子;巨噬细胞
甲型副伤寒沙门氏菌(SalmonellaparatyphiA)引起的甲型副伤寒是常见的肠道传染病,被列为国家重点监测的13种传染病之一。近年来,伤寒和副伤寒的总发病率一直保持稳定,但是其中甲副伤寒的发病比例显著增高[1-2]。 可见,甲型副伤寒沙门氏菌已替代伤寒沙门氏菌成为优势致病菌。在感染急性期,伤寒和甲副伤寒病人血清中炎症因子IL-6,IL-8和TNF-α显著升高[3]。但是,甲型副伤寒沙门氏菌或甲型副伤寒沙门氏菌的组分如何导致机体产生炎症的机理还有待阐明。
细胞致死性肿胀毒素(cytolethal distending toxin, CDT)是首先发现于空肠弯曲杆菌的一种外毒素,重组的空肠弯曲杆菌CDT具有类DNA酶的作用,能损伤巨噬细胞DNA,而使得细胞周期停滞,导致巨噬细胞肿胀、凋亡。CDT由cdtA、 cdtB和cdtC 3种多肽组成,其中,cdtB引起染色体DNA降解,cdtA和cdtC运送cdtB进入宿主细胞内。 伤寒沙门氏菌只表达cdtB,不表达cdtA和cdtC,由于伤寒沙门氏菌可以被巨噬细胞内吞到胞内,伤寒沙门氏菌可以直接在胞内致死宿主细胞[4]。伴放线杆菌CDT可以直接介导巨噬细胞释放炎症细胞因子[5]。巨噬细胞是病原菌引发的炎症反应的核心,通过抗原提呈和释放炎症细胞因子激活宿主固有免疫系统,巨噬细胞在宿主控制和清除沙门氏菌感染的过程中发挥了重要作用[6]。甲型副伤寒沙门氏菌携带编码cdtB的基因cdtB(GenBank accession No.: NC_006511.1),不携带cdtA和cdtC。本研究对甲型副伤寒沙门氏菌cdtB亚基进行原核表达,制备并模型纯化了重组蛋白并建立其刺激人THP-1巨噬细胞模型。利用ELISA等检测细胞因子的分泌水平,从细胞水平上研究甲副伤寒沙门氏菌cdtB亚基对巨噬细胞分泌IL-6,IL-8和TNF-α的影响。
1 材料与方法
1.1菌株来源和培养甲型副伤寒沙门菌参考标准株(CMCC 50001)由本实验室保存,采用营养肉汤(Oxoid)培养。
1.2cdtB基因原核表达系统的构建及鉴定采用细菌基因组DNA制备试剂盒(Axygen)提取甲型副伤寒沙门菌CMCC 50001株基因组DNA,分光光度法测定其浓度。PCR扩增全长cdtB基因(GenBank accession No. NC_006511.1),引物序列如下:上游 5′-CGC CAT ATG (NdeI) AAAAAACCTGTTTTTTTCCT-3′,下游 5′-CGC CTC GAG (XhoI) ACAGCTTCGTGCCAAAAAGG-3′。反应条件为:94 ℃ 5 min,94 ℃ 30 s、52 ℃ 30 s、72 ℃ 90 s,30个循环;72 ℃ 10 min。采用1 μg/mL溴乙锭预染色的1.5%琼脂糖凝胶电泳检测扩增产物,采用T-A克隆试剂盒(TaKaRa)cdtB基因扩增产物克隆入pMDl9-T形成重组质粒pMDl9-TcdtB,委托上海Invitrogen公司测序。pMDl9-TcdtB和表达载体pET42a(Novagen)分别用NdeI(TaKaRa)和XhoI(TaKaRa)双酶切,琼脂糖电泳分离酶切片段后切胶回收目的片段。在T4 DNA连接酶(TaKaRa)作用下,将cdtB基因片段与线性化pET42a连接后转化入表达宿主菌大肠杆菌BL21DE3 (Novagen)形成E.coliBL21DE3pET42a-cdtB表达重组cdtB。用10%分离胶的SDS-PAGE联合Bio-Rad凝胶图像分析系统检查重组cdtB的表达情况,Ni-NTA亲和层析柱(BioColor)提纯重组cdtB。
1.3去除重组cdtB中的LPS为了避免大肠杆菌表达得到的重组cdtB中可能出现的大肠杆菌LPS污染,本研究通过Detoxi-Gel内毒素去除胶(Thermo Scientific, USA)去除重组cdtB中的LPS。为了检测LPS是否完全去除,我们利用鲎试剂检测重组cdtB,重组cdtB稀释到不同浓度,各取100 μL加入等量鲎试剂,37 ℃孵育1 h。倒置试管,内容物凝固不能从管壁滑落为阳性结果;内容物从管壁滑落为阴性结果。本实验中,无热原水作为阴性对照,大肠杆菌LPS (Invivogen, USA)作为阳性对照。
1.4人单核分化巨噬细胞THP-1的分化与培养THP-1细胞接种于6孔培养板中(1×106细胞/孔,2 mL每孔),于37 ℃、 5%CO2条件下培养过夜使成单层细胞。THP-1细胞在实验前加入终浓度为50 ng/mL佛波酯(PMA)刺激分化48 h,使之分化为巨噬细胞。
1.5重组cdtB蛋白刺激人单核分化巨噬细胞THP-1在经过PMA处理的THP-1(105/mL)的培养基中分别加入终浓度为0.1,1和10 μg/mL的重组cdtB,置于37 ℃、5% CO2培养箱中培养24 h后,收集上清,ELISA(ebioscience)检测上清中IL-6、IL-8、TNF-α的浓度。本实验中,不外加重组cdtB的THP-1细胞培养上清作为空白对照。
1.6NF-κB信号通路阻断研究 为了研究NF-κB信号通路阻断对重组cdtB诱导巨噬细胞IL-6、IL-8、TNF-α分泌的影响,20 μmol/L NF-κB信号通路阻断剂SN50 (Tocris Bioscience, USA) 加入经过PMA预处理的THP-1细胞(2×10/孔)培养基中,1 h后用1 μg/mL重组cdtB刺激THP-1细胞,置于37 ℃、5% CO2培养箱中培养24 h后,收集上清,ELISA检测培养上清中的IL-6、IL-8和TNF-α的浓度。本实验中,不外加NF-κB信号通路阻断剂SN50和重组cdtB的THP-1细胞培养上清作为空白对照,重组cdtB刺激的THP-1细胞培养上清作为阳性对照。
1.7统计学处理采用SPSS 18.0统计软件对数据进行卡方检验。
2 结 果
2.1重组表达载体的构建和鉴定甲型副伤寒沙门菌CMCC 50001株基因组DNA中可以扩增出预期大小的cdtB基因片段(图1)。测序及序列分析结果显示,与GenBank中甲型副伤寒沙门菌ATCC26695株cdtB基因核苷酸和氨基酸序列相似性分别为97.62%和99.82%。
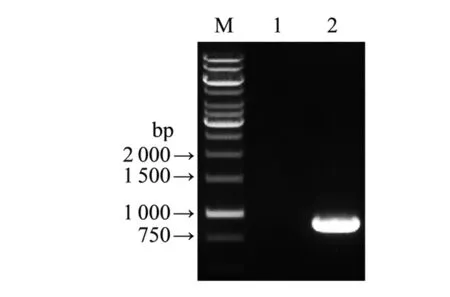
M: DNA marker; Lane 1: Blank control; Lane 2: Amplification fragments of cdtB gene from S.para CMCC 50001 strains.图1 甲型副伤寒杆菌CMCC 50001株cdtB基因PCR结果Fig.1 PCR result of cdtB gene from S.para CMCC 50001 strains
2.2重组cdtB的表达及提纯效果在IPTG诱导下,E.coliBL21DE3pET42a-cdtB能够高效表达重组cdtB,该重组蛋白以可溶的形式存在。利用Ni-NTA亲和层析法提纯重组cdtB蛋白,SDS-PAGE结果显示,重组cdtB蛋白在胶上表现为单一的蛋白条带(图2)。

M: protein marker; Lane 1: Blank control (wild-type pET42a). Lane 2 and 3: The expressed and purified SPA-rCdtB protein, respectively.图2 甲型副伤寒杆菌CMCC 50001株重组CdtB表达和提纯效果Fig.2 Effects of rCdtB expression and purification effects of S.para CMCC 50001 strains
2.3重组cdtB对巨噬细胞IL-6、IL-8、TNF-α分泌的影为了研究重组cdtB对巨噬细胞的促炎作用,我们用不同浓度的重组cdtB(0.1 μg/mL,1 μg/mL和10 μg/mL)刺激THP-1细胞。24 h后,ELISA检测培养上清中的IL-6、IL-8和TNF-α。结果显示,与没有受到重组cdtB刺激的对照组相比,受到cdtB刺激的THP-1细胞上清中IL-6,IL-8和TNF-α浓度上升,并呈现剂量依赖效应(t=4.13,P<0.05)。不同刺激时间(h)对上清中IL-6,IL-8和TNF-α浓度影响的研究结果显示,上清中的IL-6浓度在6~12 h间显著上升(t=4.38,P<0.05),约在24~48 h时到达峰值。IL-8的分泌在2~6 h开始显著升高(t=6.07,P<0.05),约在24~48 h时到达峰值。TNF-α的表达在2~6 h间显著上升(t=3.78,P<0.05),约在12~24 h时到达峰值(图3)。
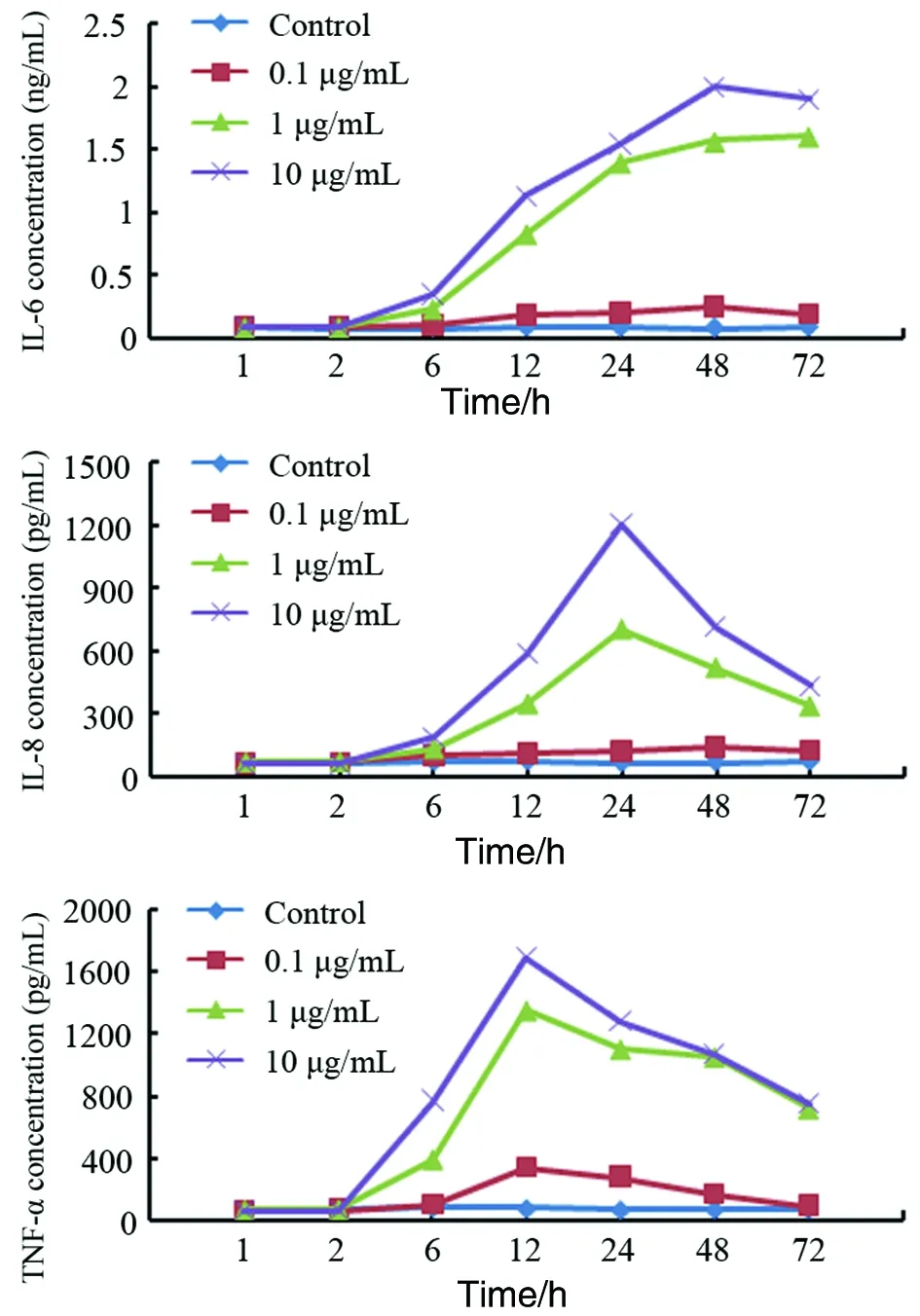
图3 不同浓度重组CdtB对THP-1细胞因子分泌的影响Fig.3 Ability of rcdtB proteins to induce IL-6, IL-8 and TNF-α in THP-1 cells
2.4NF-κB信号通路阻断对重组cdtB诱导巨噬细胞IL-6、IL-8、TNF-α分泌的影响在THP-1细胞培养基中加入NF-α信号通路阻断剂SN50,1 h后用重组cdtB刺激THP-1细胞,24 h后,ELISA检测培养上清中的IL-6、IL-8和TNF-α。结果显示,与没有加入NF-κB信号通路阻断剂的阳性对照组相比,在THP-1细胞培养基中加入NF-κB信号通路阻断剂SN50可以显著抑制重组cdtB诱导的IL-6、IL-8、TNF-α分泌(t=2.41,P<0.05)(图4)。
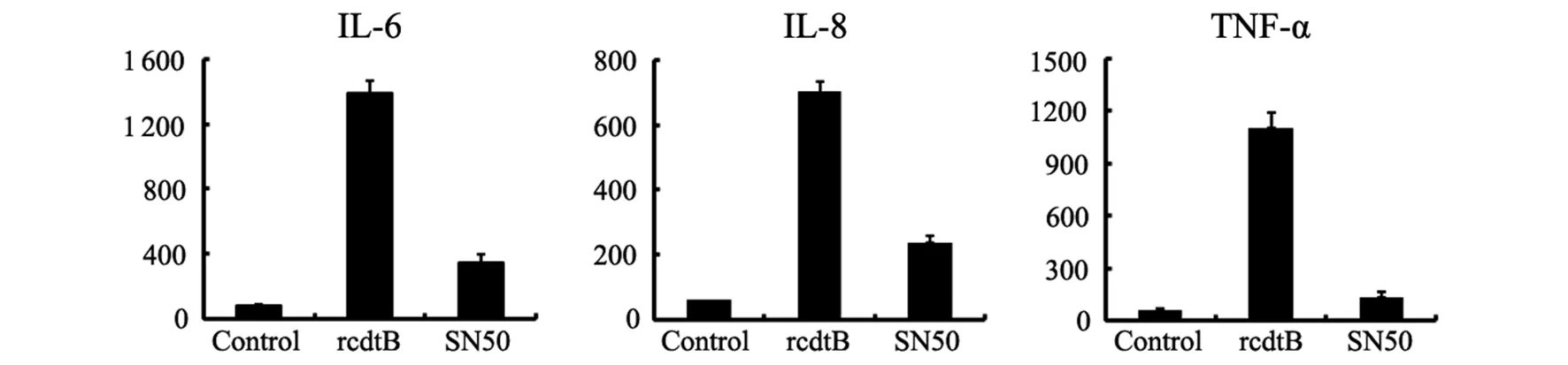
图4 NF-κB信号通路阻断对重组cdtB诱导THP-1分泌细胞因子的影响Fig.4 Influence of NF-κB signaling pathways inhibitor in rcdtB inducing IL-6, IL-8 and TNF-α
3 讨 论
宿主对抗伤寒或甲型副伤寒沙门氏菌感染的特点是释放促炎细胞因子,LPS被认为是伤寒和甲型副伤寒沙门氏菌的主要促炎组分。但是大多数伤寒病人血清中不能检测到内毒素的存在,同时,伤寒沙门氏菌LPS耐受的动物模型在受到伤寒沙门氏菌攻击时,还是表现伤寒热的症状,说明伤寒和甲型副伤寒沙门氏菌LPS不是唯一促炎组分。伤寒和甲型副伤寒沙门氏菌的其他组分,如鞭毛蛋白,菌毛等也能诱导宿主细胞分泌促炎因子[7-8]。本研究发现,甲型副伤寒沙门氏菌重组cdtB能促使巨噬细胞分泌IL-6、IL-8和TNF-α,通过使用Detoxi-Gel内毒素去除胶处理重组cdtB,这些促炎细胞因子的释放可以排除LPS污染的可能性。TNF-α是早期反应的促炎细胞因子,IL-6和IL-8是炎症反应中重要的趋化因子,可以趋化和激活多种特异和非特异性的免疫细胞,从而激活宿主固有免疫系统[9-10]。这与以往的李铁民报道的伤寒沙门氏菌能使人巨噬细胞分泌TNF-α的结果是一致的[11]。
NF-κB信号通路是调控促炎细胞因子基因表达的主要信号通路,NF-κB信号通路通过级联信号放大和NF-rd3的表达,可以辅助促炎细胞因子的表达[12]。本研究通过NF-κB信号通路阻断剂,证明甲型副伤寒沙门氏菌重组cdtB主要通过NF-κB信号通路诱导的巨噬细胞分泌IL-6、IL-8和TNF-α。但是,NF-κB信号通路阻断剂不能完全阻断甲型副伤寒沙门氏菌重组cdtB诱导的巨噬细胞分泌IL-6、IL-8和TNF-α,这结果说明,甲型副伤寒沙门氏菌重组cdtB可能还通过其他信号通路诱导巨噬细胞分泌促炎细胞因子。
我们的研究结果证明,甲型副伤寒沙门氏菌致死性肿胀毒素能够通过NF-κB信号通路诱导人巨噬细胞分泌IL-6、IL-8和TNF-α,在甲型副伤寒相关的炎症反应中发挥了促进作用。
[1] Wang HQ, Pan JC, Ge YM, et al. Molecular characteristics ofSalmonellatyphiandSalmonellaparaophia isolates in Hangzhou[J]. Chin J Microbiol Immunol, 2012, 32(8): 711-715. (in Chinese)
汪皓秋, 潘劲草, 葛玉梅, 等. 杭州地区伤寒及甲型副伤寒沙门菌流行菌株分子特征的研究[J]. 中华微生物和免疫学杂志, 2012,32(8):711-715.
[2] Yan MY, Liang WL, Li W, et al. Epidemiological analysis of typhoid and paratyphoid cases in China during 1995 to 2004[J]. Dis Ctrl, 2005, 20(8): 40l-403. (in Chinese)
闫梅英, 梁未丽, 李伟, 等. 1995—2004年全国伤寒副伤寒的流行分析[J]. 疾病监测, 2005, 20(8):401-403.
[3] Keuter M, Dharmana E, Gasem MH, et al. Patterns of proinflammatory cytokines and inhibitors during typhoid fever[J]. J Infect Dis, 1994, 169(6): 1306-1311. DOI:10.1093/infdis/169.6.1306
[4] Jinadasa RN, Bloom SE, Weiss RS, et al. Cytolethal distending toxin: a conserved bacterial genotoxin that blocks cell cycle progression, leading to apoptosis of a broad range of mammalian cell lineages[J]. Microbiology, 2011, 157(Pt 7): 1851-1875. DOI:10.1099/mic.0.049536-0
[5] Haghjoo E, Galan JE.Salmonellatyphiencodes a functional cytolethal distending toxin that is delivered into host cells by a bacterial-internalization pathway[J]. Proc Natl Acad Sci U S A, 2004, 101(13): 4614-4619. DOI:10.1073/pnas.0400932101
[6] Ando-Suguimoto ES, da Silva MP, Kawamoto D, et al. The cytolethal distending toxin ofAggregatibacteractinomycetemcomitansinhibits macrophage phagocytosis and subverts cytokine production[J]. Cytokine, 2014, 66(1): 46-53. DOI: 10.1016/j.cyto.2013.12.014
[7] Wyant TL, Tanner MK, Sztein MB.Salmonellatyphiflagella are potent inducers of proinflammatory cytokine secretion by human monocytes[J]. J Infect Dis, 1999, 67(7): 3619-3624.
[8] Wang FB, Zhang XL. Type IVB pili ofSalmonellatyphiinduce interleukin-6 expression in THP-1 cells by activating PKC signal pathway[J]. Immunol J, 2005, 21(3): 67-69. (in Chinese)
汪付兵, 章晓联. 伤寒杆菌IVB型菌毛激活PKC信号通路诱导THP-1细胞IL-6表达 [J]. 免疫学杂志, 2005, 21(3):67-69.
[9] Amber KT, Bloom R, Mrowietz U, et al. TNF-alpha: a treatment target or cause of sarcoidosis[J]. J Eur Acad Dermatol, 2015, 29(11): 2104-2111. DOI: 10.1111/jdv.13246
[10] Nielsen AR, Pedersen BK. The biological roles of exercise-induced cytokines: IL-6, IL-8, and IL-15[J]. Appl Physiol Nutr Metab, 2007, 32(5): 833-839. DOI: 10.1139/H07-054
[11] Li TM, Xu H, Jiangqi XX. Research on mechanisms of mononuclear phagocyte in response toSalmonellatyphistrains[J]. Chin J Public Health, 2003, 19(1): 51-52. (in Chinese)
李铁民, 徐浩, 江崎孝行.单核吞噬细胞应答伤寒沙门菌的实验研究[J]. 中国公共卫生, 2003,19(1): 51-52
[12] Idzko M, Ferrari D, Eltizschig HK. Nucleotide signalling during inflammation[J]. Nature, 2014, 509(7500): 310-317. DOI: 10.1038/nature13085
Cloning and expression of recombinantSalmonellaparatyphiA cytolethal distending toxin proteins and its effect on cytokine production by human monocyte-derived macrophages
CHEN Hong-hu1, WU Yuan-yuan2, ZHAN Li1, MEI Ling-ling1
(1.DepartmentofMicrobiology,ZhejiangProvincialCenterforDiseaseControlandPrevention,Hangzhou310051,China;2.DepartmentofClinicalLaboratory,theChildren'sHospital,ZhejiangUniversitySchoolofMedicine,Hangzhou310003,China)
To investigate the role ofSalmonellaparatyphiA cytolethal distending toxin (CDT) in pro-inflammatory cytokines induction in macrophages, we cloned and expressed cdtB, a subunit of CDT fromSalmonellaparatyphi(S.paratyphi) A inEscherichiacoli, and purified the recombinant cdtB proteins (SPA-rcdtB) to homogeneity by Ni-NTA affinity chromatography. By co-cultured SPA-rcdtB with human monocyte-derived macrophages (THP-1) and detected IL-6, IL-8 and TNF-α in supernatant by ELISA, we determined if SPA-rcdtB were able to induce human monocyte-derived macrophages to produce cytokines. In addition, NF-κB inhibitor SN50 was used to research the effect of NF-κB signaling pathways in SPA-rcdtB induced macrophage IL-6, IL-8 and TNF-α secretion. In this study, we proved that the cdtb gene segment amplified fromS.paratyphiA CMCC 50001 strains showed high nucleotide and amino acid sequence identities (97.62% and 99.82%) compared withcdtbgene in the GenBank (GenBank accession No. NC_006511.1). And the SPA-rcdtB were able to induce the synthesis by THP-1 of interleukin-6, IL-8 and TNF-α, and the IL-6, IL-8 and TNF-α induction by SPA-rCdtB was significantly suppressed by NF-κB inhibitor. This result indicated that SPA-rcdtB plays a promoting role inflammatory response associated with SPA infection.
SalmonellaparatyphiA; cytolethal distending toxin; cytokines; macrophages.
Supported by the grants from the Zhejiang Provincial Center for Disease Control and Provention (No. 2013-11)
Mei Ling-ling, Email: llmei@cdc.zj.cn
梅玲玲,Email:llmei@cdc.zj.cn
1. 浙江省疾病预防控制中心微生物所,杭州310051;2. 浙江大学医学院附属儿童医院实验检验中心,杭州310003
R378.2
A
1002-2694(2016)06-0535-04
2015-11-13;
2016-03-30
DOI:10.3969/j.issn.1002-2694.2016.06.006
浙江省疾病预防控制中心青年科技项目(No.2013-11)资助
