慢性HBV感染者HBsAg/ HBV DNA比率的检测及其临床意义
2016-08-25郑怡娟余雪平郭如意柯邵鹏李菊兰何秀华林志鹏林成祖苏智军
郑怡娟,余雪平,郭如意,柯邵鹏,李菊兰,王 星,何秀华,林志鹏,林成祖,苏智军
慢性HBV感染者HBsAg/ HBV DNA比率的检测及其临床意义
郑怡娟,余雪平,郭如意,柯邵鹏,李菊兰,王星,何秀华,林志鹏,林成祖,苏智军
目的探讨慢性乙型肝炎病毒(hepatitis B virus, HBV)感染者HBsAg/HBV DNA比率的临床意义。方法收集46例轻中度慢性乙型肝炎(CHB-LM)患者、24例重度慢性乙型肝炎(CHB-S)患者和28例乙型肝炎肝硬化(HBV-LC)患者入院时及40例CHB患者治疗12周的外周血;采用全自动生化仪检测谷丙转氨酶(ALT)、总胆红素(TBil)等指标,化学发光法定量检测HBsAg水平,实时荧光PCR定量检测HBV DNA。结果HBV-LC组HBsAg和HBV DNA均明显低于CHB-LM(Z=-3.416和-2.636,均P<0.05)、CHB-S组(Z=-2.499和-2.407,均P<0.05),HBsAg/HBV DNA比率均稍高于CHB-LM、CHB-S组(均P>0.05);CHB-LM和CHB-S组之间比较无统计学差异(Z=-0.649、-0.032和-0.885,均P>0.05)。HBeAg阴性组的HBsAg、HBV DNA水平均高于HBeAg阳性组(Z=-2.662和-4.950,P=0.008和<0.001),HBsAg/HBV DNA比率较HBeAg阳性组明显升高(Z=-2.544,P=0.011)。治疗12周与治疗前比较,完全应答组HBsAg、HBV DNA均明显下降(Z=-2.103和-3.297,P=0.035和0.0002),HBsAg/HBV DNA比率明显升高(Z=-3.233,P=0.01);部分应答组HBV DNA明显下降(Z=-2.666,P=0.005),HBsAg/HBV DNA比率明显升高(Z=-2.666,P=0.000 4),HBsAg水平稍下降(Z=-1.600,P=0.110);无应答组HBV DNA明显下降(Z=-3.059,P=0.023),HBsAg稍下降(Z=-0.341,P=0.733),但HBsAg/HBV DNA比率升高(P>0.05)。HBsAg/HBV DNA比率与PLT(r=0.561,P=0.002)呈明显正相关。 HBsAg/HBV DNA比率预测病毒学完全应答的曲线下面积AUC(0.643)高于HBsAg(0.580)和HBVDNA(0.433)。结论进展性HBV-LC和HBeAg阴性CHB患者HBsAg/HBV DNA比率偏高,且升高的HBsAg/HBV DNA比率与抗HBV治疗疗效欠佳有关。
慢性乙型肝炎;HBsAg;HBV DNA;HBsAg/HBV DNA比率;核苷(酸)类似物
Supported by the National Science Foundation of China (No. 81400625), the National Science Foundation of Fujian Province (No. 2015J01413), the Fujian Provincial Department of Public Health Youth Project (No. 2013-1-45), and the Quanzhou Science and Technique Program Funing Project (No. 2013Z53 and 2012Z11)
乙型肝炎病毒(HBV)感染是一个世界性的公共问题,我国HBV感染者众多,且大多数为慢性感染,并最终可发展为肝衰竭(LF)、肝硬化(LC)和原发性肝癌(HCC)。长期的抗乙肝病毒治疗已成为延缓慢性乙型肝炎(CHB)病情进展的核心措施,对CHB抗病毒疗效的预测已成为临床重要的问题。近年来较多的文献表明HBsAg与HBV DNA可作为预测抗病毒疗效的指标[1-3],且韩国学者通过对HBsAg/HBV DNA比率的研究发现其对预测持续病毒应答(VR)有一定的意义[4],但两者在慢性HBV感染的不同阶段的相关性报道不一[1-2,5-8],故HBsAg/HBV DNA比率及其预测效能也可能存在差异。本文通过动态监测70例CHB患者及28例HBV-LC患者的HBsAg、HBV DNA、HBsAg/HBV DNA变化,以探讨HBsAg/HBV DNA比率预测乙肝初治患者的抗病毒疗效的意义。
1 对象与方法
1.1研究对象选取福建医科大学附属泉州第一医院2010年7月—2011年8月感染科住院的70例CHB患者(其中46例轻中度CHB[CHB-LM]、24例重度CHB[CHB-S])及28例乙型肝炎肝硬化(HBV-LC)患者,男性76例,女性22例,年龄18~79岁,平均(37.53±13.50)岁。所有患者诊断均符合2015年制定的《慢性乙型肝炎防治指南》标准[9],排除合并药物性、酒精性、自身免疫性、原发性肝癌及甲、丙、丁、戊型等病毒感染的重叠感染病例。
1.2治疗方案所有患者均签署知情同意书,均接受核苷(酸)类似物(NA)抗病毒治疗,至12周,只有40例CHB患者接受随访,其中服用抗恩替卡韦(ETV,0.5 mg/d,中美上海施贵宝制药有限公司)30例、阿德福韦酯(ADV,10 mg/d,天津药物研究院药业有限责任公司)4例、拉米夫定(LAM,100 mg/d,葛兰素史克中国天津分公司)4例、拉米夫定(100 mg/d)+阿德福韦酯(10 mg/d)2例。
1.3指标检测采用全自动酶免分析生化仪(BeckMan LX-20,美国BeckMan公司)及美国BeckMan公司提供的试剂检测总胆红素(TBIL)、谷丙转氨酶(ALT)等生化学指标;采用全自动免疫分析仪(ARCHITECT i2000SR,美国Abbott公司)检测血清HBsAg滴度(HBsAg阳性定量检测范围为0.05~250 U/mL,超过250 U/mL时用HBsAg稀释液稀释500倍后再检测),试剂由美国Abbott公司提供(批号:37021LF00);采用定量荧光PCR仪(PE9700,美国)检测HBV DNA定量(检测下限为1.0×103copies/mL),试剂盒由上海科华生物工程股份有限公司提供(批号:14040111);采用全自动血细胞分析仪(Coulter LH750 analyzer,美国BeckMan公司)检测外周血的血小板(PLT)计数。
1.4疗效分组40例CHB患者在服用NA 12周后,根据抗病毒疗效分为3组[10]。完全应答组为HBV DNA阴转,ALT复常;部分应答组为ALT下降或复常,HBV DNA转阴或下降2 log拷贝/mL以上;无应答组为未达到上述指标者。
2 结 果
2.1CHB-LM、CHB-S、HBV-LC 3组资料的比较CHB-LM、CHB-S、HBV-LC 3组组间性别差异无统计学意义(均P>0.05)。3组组间年龄相比,肝硬化组年龄较各组均大。CHB-S组TBil、ALT、AST、WBC均明显高于CHB-LM、HBV-LC组;且HBV-LC组TBil、ALT、AST均高于CHB-LM组,Hgb低于CHB-LM组,差异有统计学意义(均P<0.05)。HBV-LC组HBsAg、HBV DNA均明显低于CHB-LM(Z=-3.416,P<0.01)和CHB-S组(Z=-2.499,P=0.012),HBsAg/HBV DNA比率均高于CHB-LM(Z=-0.231,P=0.817)、CHB-S组(Z=-1.065,P=0.287),但差异无统计学意义,而CHB-LM和CHB-S组之间比较均无统计学差异(均P>0.05)。(表1、图1 A)
表1各组研究对象的基线资料
Tab.1Baseline data of CHB-LM, CHB-S and HBV-LC groups

GroupCHB-LM(n=46)CHB-S(n=24)HBV-LC(n=28)P Gender(M,%)36(78.26%)19(79.17%)21(75.00%)0.927Age(year)32.000(25.750-41.250)28.5000(24.250-34.000)51.000(35.750-60.750)4,10P<0.001TBIL(umol/L)18.050(14.650-24.925)144.800(60.750-216.000)135.850(24.025-66.700)5,11P<0.001ALT(IU/L)229.500(127.250-443.250)477.000(666.750-1192.750)260.000(44.000-231.750)6,120.001AST(IU/L)112.500(57.000-228.250)275.000(111.500-786.500)393.000(53.000-149.750)130.001WBC(×109/L)5.550(4.800-6.525)6.100(4.925-9.550)4.300(3.150-5.175)7,14P<0.001Hgb(g/L)148.500(140.750-160.000)142.500(123.250-154.750)127.000(101.000-149.000)80.002PLT(×109/L)192.000(156.750-224.000)195.500(148.000-313.000)81.000(54.250-122.500)9,15P<0.001
与CHB-LM组比较,1Z=-6.051,2Z=-2.431,3Z=-3.112,4Z=-3.998,5Z=-4.553,6Z=-3.232,7Z=-3.412,8Z=-3.364,9Z=-5.790,均P<0.01;与CHB-S组比较,10Z=-4.482,11Z=-4.029,12Z=-3.938,13Z=-3.708,14Z=-3.82,15Z=-4.782,均P<0.05。

A:在所有患者中(n=98);B:在HBeAg阳性(n=56)和HBeAg阴性(n=42)患者中的比较;C: 在肝硬化代偿期(n=8)和肝硬化失代偿期(n=20)患者中的比较;D:在肝硬化生存者(n=20)和死亡者(n=8)中的比较。A: All patients (n=98); B: The comparison of HBeAg-positive patients (n=56) and HBeAg-negative patients (n=42); C:. The comparison of compensatory phase cirrhosis patients (n=8) and decompensatory phase cirrhosis patients (n=20); D: The comparison of survival group (n=20) and non-survival group (n=8).图1 HBsAg、HBV DNA、HBsAg/HBV DNA比率在各组中的变化Fig.1 Changes in HBsAg, HBV DNA and HBsAg-to-HBV DNA ratio among patients with CHB-LM, CHB-S and HBV-LC
2.2各亚组HBsAg、HBV DNA、HBsAg/HBV DNA比率比较HBeAg阳性组(n=56)的HBsAg(Z=-2.662,P=0.008)、HBV DNA(Z=-4.950,P<0.001)水平均高于HBeAg阴性组(n=42),差异均有统计学意义。HBeAg阳性组的HBsAg/HBV DNA比率较阴性组低(Z=-2.544,P=0.011)。(图1 B)
肝硬化代偿期组(n=8)的HBsAg(Z=0.000,P=1.000)、HBV DNA(Z=-1.661,P=0.097)水平均稍高于肝硬化失代偿期组(n=20),而HBsAg/HBV DNA比率低于肝硬化失代偿期组(Z=-0.814,P=0.416),差异无统计学意义。(图1 C)
肝硬化生存组(n=20)的HBsAg(Z=-0.153,P=0.901)、HBV DNA(Z=-1.583,P=0.113)水平均稍高于死亡组(n=8),而HBsAg/HBV DNA比率低于死亡组(Z=0.000,P=1.000),差异均无统计学意义。(图1D)
2.3完全应答组、部分应答组、无应答组抗病毒治疗前后各指标的水平变化治疗前完全应答组、部分应答组、无应答组HBsAg、HBV DNA、HBsAg/HBV DNA比率基线水平差异均无统计学意义(均P>0.05)。治疗12周时的完全应答组、部分应答组和无应答组3组间HBV DNA(χ2=25.260,P<0.001)、HBsAg/HBV DNA比率(χ2=17.584,P<0.001)呈显著性差异;3组间两两比较,HBV DNA水平在完全应答组和部分应答组中均明显低于无应答组(Z=-4.814和-2.666,P<0.01),无应答组HBsAg/HBV DNA比率高于完全应答组和部分应答组(Z=-3.722和-3.024,P<0.01)。治疗12周与治疗前比较,完全应答组HBsAg(Z=-2.103,P=0.035)和HBV DNA(Z=-3.297,P=0.000 2)均明显下降,HBsAg/HBV DNA比率(Z=-3.233,P=0.01)明显升高;部分应答组HBV DNA明显下降(Z=-2.666,P=0.005),HBsAg/HBV DNA比率明显升高(Z=-2.666,P=0.000 4),HBsAg(Z=-1.600,P=0.110)水平下降,但差异无统计学意义;无应答组HBV DNA下降,差异有统计学意义(Z=-3.059,P=0.023),HBsAg(Z=-0.341,P=0.733)下降不明显,HBsAg/HBV DNA比率升高(Z=-2.201,P=0.663),差异无统计学意义。(图2)

A:抗病毒治疗前3组比较;B:抗病毒治疗后3组比较;C:抗病毒治疗前后比较A: The comparison in three groups before antiviral treatment; B: The comparison in three groups after antiviral treatment; C: The comparison between before and after antiviral treatment.图2 HBsAg、HBV DNA、HBsAg/HBV DNA比率在抗病毒治疗前后的变化Fig.2 Changes of HBsAg, HBV DNA and HBsAg-to-HBV DNA ratio before and after antiviral treatment
2.4HBsAg、HBV DNA、HBsAg/HBV DNA比率与其它指标的相关性98例患者中,HBsAg定量与TBIL呈负相关(r=-0.201,P=0.048),与PLT(r=0.351,P=0.001)呈明显正相关;HBV-DNA定量与ALT(r=0.212,P=0.038)呈正相关,与AST(r=0.026 3,P=0.010)呈正相关;HBsAg/DNA比率与ALT(r=-0.208,P=0.042)呈正相关,与AST(r=-0.272,P=0.007)呈正相关。
在28例肝硬化患者中,HBsAg/DNA比率与PLT(r=0.561,P=0.002)呈明显正相关,与HGB呈明显负相关(r=-0.505,P=0.007)。
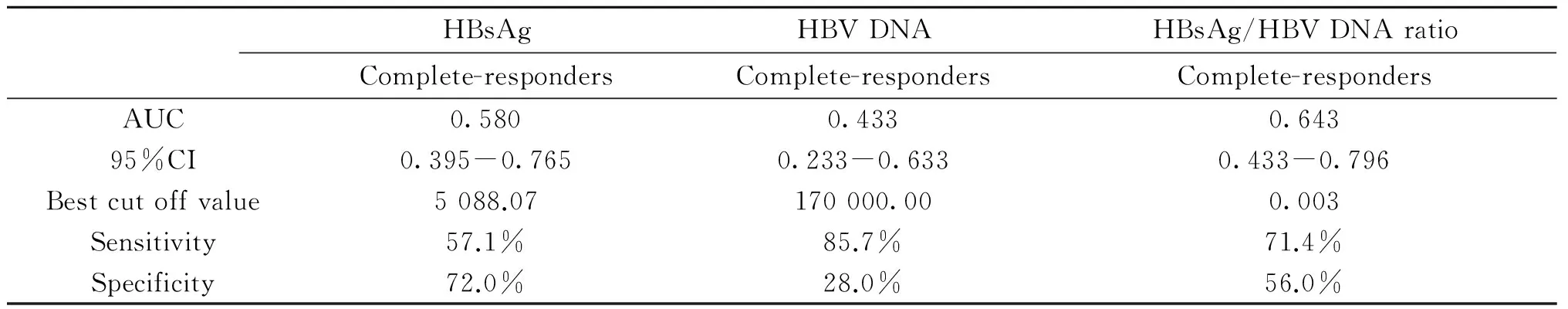
2.540例抗病毒治疗前HBsAg、HBVDNA和HBsAg/HBVDNA比率预测应答的ROC曲线40例CHB患者在抗病毒前,HBsAg、HBVDNA和HBsAg/HBVDNA比率预测病毒学完全应答的ROC曲线下面积,分别为0.580、0.433、0.643,在HBsAg/HBV DNA比率为0.003时,对应的敏感度为71.4%,特异度为56.0%。(见表2)
表240例抗病毒治疗前HBsAg、HBVDNA和HBsAg/HBVDNA比率预测完全应答的ROC曲线
Tab.2Receiver operating characteristic curve analysis of HBsAg, HBVDNA and HBsAg-to-HBV DNA ratio about 40 patients with CHB before antiviral treatment in predicting complete-response
HBsAgHBVDNAHBsAg/HBVDNAratioComplete-respondersComplete-respondersComplete-respondersAUC0.5800.4330.64395%CI0.395-0.7650.233-0.6330.433-0.796Bestcutoffvalue5088.07170000.000.003Sensitivity57.1%85.7%71.4%Specificity72.0%28.0%56.0%
3 讨 论
抗乙肝病毒治疗已成为延缓慢性乙型肝炎进展为肝硬化、原发性肝癌的核心措施,有限的抗病毒疗程为大多数患者所期望,故寻找一种或多种预测抗病毒疗效的指标意义重大。自1965年发现HBsAg以来,较多的研究表明血清HBsAg在抗病毒药物选择及预测抗病毒疗效方面有较显著的意义[11-12],目前仍是研究热点,同时相关文献[1-2]表明血清HBsAg与HBV DNA呈正相关,并且与CHB的活动性及传染性直接相关。另有研究发现,在慢性HBV感染的不同阶段,HBsAg与HBV DNA相关性不尽相同,Nguyen T等[5]研究表明仅在免疫清除期时二者呈正相关,而在免疫耐受期及非活动期,两者无相关性。国内学者孙奎霞[6]等研究表明在HBeAg阳性孕妇中,HBsAg与HBV DNA呈正相关(r=0.774,P=0.000),但在HBeAg阴性孕妇中,二者无相关性(r=0.042,P=0.426)。以上表明HBsAg和HBV DNA总体相关,而在HBV感染不同阶段两者相关性存在差异。为进一步研究两者之间的相互关系,韩国学者Song JC等[4]通过对52例CHB患者进行为期26个月的研究发现,HBsAg/HBV DNA比率预测ETV治疗过程中的VR优于HBsAg和HBV DNA(其灵敏度和特异度分别达到51.1%和100%),并通过多因素COX分析提示HBsAg/HBV DNA比率是预测恩替卡韦病毒应答的独立因子。但此研究样本量较少,并且仅仅局限于CHB患者,而且国内尚没有HBsAg/HBV DNA比率预测病毒学应答作用的报道。
本实验结果显示HBsAg、HBV DNA在CHB-LM、CHB-S和HBV-LC 3组中比较有统计学差异,且HBV-LC组HBsAg、HBV DNA均明显低于CHB-LM、CHB-S组,HBsAg/HBV DNA比率却稍高于CHB-LM和CHB-S组;亚组分析发现,随着HBV-LC病情向代偿期或死亡方向进展,HBsAg、HBV DNA水平降低,而HBsAg/HBV DNA比率却升高,可能原因是随着HBV引发免疫损伤的加重,正常肝细胞的破坏,肝脏纤维化的进展,依赖于肝细胞进行复制的HBsAg和HBV DNA也会相应的减少,HBV DNA滴度较HBsAg水平下降幅度较大,而导致HBsAg/HBV DNA比率升高。并且HBsAg/HBV DNA比率与PLT(反映肝脏纤维化程度指标)呈强正相关,进一步支持HBsAg/HBV DNA比率与肝纤维化进展有关。此外,本研究还发现,HBeAg阳性组的HBsAg和HBV DNA均高于HBeAg阴性组,与Nguyen T等[5]研究结果一致,而HBsAg/HBV DNA比率明显低于HBeAg阴性组。以上结果初步表明和HBsAg、HBV DNA一样,HBsAg/HBV DNA比率在不同的慢性HBV感染阶段及不同免疫状态中存在差异,且升高的HBsAg/HBV DNA比率可能与病情向HBV-LC进展或病情加重有关。
为进一步研究HBsAg/HBV DNA比率在CHB抗病毒中的预测价值。本研究随访了40例经NA抗病毒治疗12周的患者,结果表明获得完全应答和部分应答的患者的HBV DNA均较治疗前明显下降,无应答组稍下降;完全应答组HBsAg明显下降,而部分应答组及无应答组无明显下降,最终完全应答组和部分应答组HBsAg/HBV DNA比率明显升高,而无应答组HBsAg/HBV DNA比率升高不明显,提示免疫应答者的HBsAg、HBV DNA下降幅度明显高于无应答者,这与Seto WK[13]的研究结果一致。值得注意的是,经抗病毒治疗后HBsAg水平与HBV DNA滴度均明显下降,但免疫应答有效组(完全应答者和部分应答者)的HBsAg/HBV DNA比率明显升高,差异有统计学意义,而无免疫应答组则稍上升,提示免疫应答有效组HBV DNA滴度较HBsAg水平下降更明显,而无应答组二者下降幅度均不明显,从而导致HBsAg/HBV DNA比率无明显升高,HBsAg/HBV DNA比率升高不明显可能预示抗病毒效果不佳。影响这种变化的可能解释是HBsAg与HBV DNA合成及分泌的路径不完全相同,在抗病毒的作用下HBsAg、HBV DNA变化不同步,从而出现HBsAg/HBV DNA比率的变化。本研究进一步对治疗前的HBsAg、HBV DNA、HBsAg/HBV DNA比率进行ROC曲线分析,结果显示治疗前HBsAg/HBV DNA比率预测CHB可能不出现免疫学应答的ROC曲线下面积为0.643,高于HBsAg的预测价值(0.580),最佳cutoff值为0.003,其预测敏感度为71.4%,特异度为56.0%,进一步表明HBsAg/HBV DNA比率可预测初治CHB患者的抗病毒治疗疗效。
总之,本研究表明,HBsAg/HBV DNA比率在不同的慢性HBV感染阶段及不同免疫状态中存在差异。HBsAg/HBV DNA比率可预测初治CHB患者抗病毒治疗疗效,为抗病毒疗效判断提供一种新的无创指标。若能够扩大样本量,增加HBV感染不同的疾病状态,延长随访时间,分析不同治疗时间的HBsAg/HBV DNA比率的变化,可能更好的阐述其预测初治CHB患者抗病毒疗效的临床意义。
[1] Cai W, Xie Q, An B, et al. On-treatment serum HBsAg level is predictive of sustained off-treatment virologic response to telbivudine in HBeAg-positive chronic hepatitis B patients[J]. Clin Virol, 2010, 48(1): 22-26. DOI: 10.1016/j.jcv. 2010.02.014
[2] Alghamdi A, Aref N, El-Hazmi M, et al. Correlation between hepatitis B surface antigen titers and HBV DNA levels[J]. Saudi J Gastroenterol, 2013, 19(6): 252-257. DOI: 10.4103/1319-3767.121035
[3] Rijckborst V, Hansen BE, Cakaloglu Y, et al. Early on-treatment prediction of response to peginterferon alfa-2a for HBeAg-negative chronic hepatitis B using HBsAg and HBV DNA levels[J]. Hepatology, 2010, 52(2): 454-461. DOI: 10.1002/hep.23722
[4] Song JC, Min BY, Kim JW, et al. Pretreatment serum HBsAg-to-HBV DNA ratio predicts a virologic response to entecavir in chronic hepatitis B[J]. Korean J Hepatol, 2011, 17(4): 268-273. DOI: 10.3350/kjhep.2011.17.4.268
[5] Nguyen T, Thompson AJ, Bowden S, et al. Hepatitis B surface antigen levels during the natural history of chronic hepatitis B: a perspective on Asia[J]. J Hepatol, 2010, 52(4): 508-513. DOI: 10.1016/j.jhep.2010.01.007
[6] Sun KX, Li J, Zhuang H. Quantitative detection of HBsAg and HBeAg its correlation with serum HBV DNA levels[J]. Chin J Viral Dis, 2012, 2(3): 173-178. (in Chinese)
孙奎霞,李杰,庄辉. HBsAg和HBeAg定量检测技术与HBV DNA相关性研究进展[J]. 中国病毒病杂志,2012,2(3):173-178.[7] Park H, Lee JM, Seo JH, et al. Predictive value of HBsAg quantification for determining the clinical course of genotype C HBeAg-negative carriers[J]. Liver Int, 2012, 32 (5): 796-802. DOI: 10.1111/j.1478-3231.2011.02693.x
[8] Yu XP, Guo RY, Ke SP, et al. Changes in HBsAg titer and HBV DNA load and their correlation in patients withchronic hepatitis B and HBV-related liver cirrhosis[J]. J South Med Univ, 2015, 35(5): 682-686. DOI: 10.3969/j.issn.1673-4254.2015.05.11 (in Chinese)
余雪平,郭如意,柯邵鹏,等. 慢性乙型肝炎及其肝硬化患者HBsAg与HBVDNA定量变化及其相关性研究[J].南方医科大学学报,2015,35(5):682-686. DOI: 10.3969/j.issn.1673-4254.2015.05.11
[9] The Chinese medical association of liver branch. Infection epidemiology branch of Chinese medical association. The guideline of prevention and treatment for chronic hepatitis B(2010 version)[J]. Chin J Infect Dis, 2011, 29(2): 65-80. DOI: 10.3760/cma.j.issn.1000-6680.2011.02.001 (in Chinese)
中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J].中华传染病杂志,2011,29(2):65-80. DOI: 10.3760/cma.j.issn.1000-6680.2011.02.001
[10] Chisari FV. Rous-Whipple Award Lecture. Viruses, immunity, and cancer: lessons from hepatitis B[J]. Am J Pathol, 2000, 156(4): 1117-1132. DOI: 10.1016/S0002-9440(10)64980-2
[11] Sonneveld MJ, Zoutendijk R, Janssen HL. Hepatitis B surface antigen monitoring and management of chronic hepatitis B[J]. J Viral Hepat, 2011, 18(7): 449-457. DOI: 10.1111/j.1365-2893.2011.01465.x
[12] Lee MH, Lee da M, Kim SS, et al. Correlation of serum hepatitis B surface antigen level with response to entecavir in naïve patients with chronic hepatitis B[J]. J Med Virol, 2011, 83(6): 1178-1186. DOI: 10.1002/jmv.22089
[13] Seto WK, Lam YF, Fung J, et al. Changes of HBsAg and HBV DNA levels in Chinese chronic hepatitis B patients after 5 years of entecavir treatment[J]. J Gastroenterol Hepatol, 2014, 29(5): 1028-1034. DOI: 10.1111/jgh.12476
Detection of serum HBsAg-to-HBV DNA ratio in patients with chronic HBV infection and its clinical significance
ZHENG Yi-juan, YU Xue-ping, GUO Ru-yi, KE Shao-peng, LI Jü-lan, WANG Xing,HE Xiu-hua, LIN Zhi-peng, LIN Cheng-zu, SU Zhi-jun
(DepartmentofInfectiousDiseases,theFirstHospitalofQuanzhouAffiliatedtoFujianMedicalUniversity,Quanzhou362000,China)
We investigated the clinical significance of serum HBsAg-to-HBV DNA ratio in patients with chronic HBV infection. Peripheral blood of 46 patients with mild to moderate chronic hepatitis B (CHB-LM), 24 patients with severe CHB (CHB-S) and 28 patients with hepatitis B virus related liver cirrhosis (HBV-LC) as well as 40 CHB patients followed up 12 weeks were collected. Alanine aminotransferase (ALT) and total bilirubin (TBil) were detected using automatic biochemical analyzer. Serum HBsAg titer and HBV DNA load were measured using the Architect QT assay and real-time fluorescence PCR, respectively. Results showed that serum HBsAg titer, HBV DNA load were significantly higher in CHB-LM and CHB-S groups than that in HBV-LC group (Z=-3.416 and -2.636; -2.499 and -2.407; respectively, allP<0.05), and HBsAg-to-HBV DNA ratio in HBV-LC group was slightly higher than that in CHB-LM and CHB-S groups (allP>0.05). But there were no obviously difference of the three indexes between CHB-LM and CHB-S groups (Z=-0.649, -0.032 and -0.885;P=0.516, 0.974 and 0.376). Serum HBsAg titer, HBV DNA load were markedly higher in HBeAg-positive group than that in HBeAg-negative group (Z=-2.662 and -4.950,P=0.008 and <0.001; respectively), while serum HBsAg-to-HBV DNA ratio was markedly lower in HBeAg-positive group compared with HBeAg-negative group (Z=-2.544,P=0.011).After 12 weeks of antiviral treatment, in complete-responders group and patrial-responders group, the HBsAg titer (Z=-2.103,P=0.035) and serum HBV DNA load (Z=-3.297, -2.666; bothP<0.01) were significantly decreased, except HBsAg titer was slightly reduced (Z=-1.600,P=0.110), while serum HBsAg-to-HBV DNA ratio was markedly increased (Z=-3.233, -2.666, bothP<0.01). In non-responders group, the HBV DNA load was significantly declined (Z=-3.059,P=0.002), and HBsAg titer was slightly declined (Z=-0.341,P=0.744), while serum HBsAg-to-HBV DNA ratio was slightly increased (Z=-0.341,P=0.733). Serum HBsAg-to-HBV DNA ratio were markedly negatively correlated with PLT (r=0.561,P=0.002). The area under the curve (AUC) of HBsAg-to-HBV DNA ratio (0.643) in predicting virological complete-response was higher than HBsAg (0.580) and HBV DNA (0.433). In conclusion, the increased serum HBsAg-to-HBV DNA ratio was observed in advanced HBV-LC and HBeAg-negative patients, and it maybe related with poor therapeutic effect.
chronic hepatitis B; HBsAg titer; HBV DNA load; HBsAg-to-HBV DNA ratio; Nucleos(t)-ide analogs
Su Zhi-jun, Email: su2366@sina.com
苏智军,Email: su2366@sina.com
福建医科大学附属泉州第一医院感染科,泉州362000
R512.6
A
1002-2694(2016)06-0558-06
2016-01-13;
2016-04-11
DOI:10.3969/j.issn.1002-2694.2016.06.010
国家自然科学基金(No.81400625);福建省自然科学基金(No.2015J01413);福建省卫生厅青年研究课题(No.2013-1-45)和泉州市科技计划项目资助课题(No.2013Z53,2012Z11)联合资助
