糖尿病肾病尿毒症患者成纤维细胞生长因子23和骨保护素与桡动脉血管钙化的相关性
2016-06-16刘静静任伟王科兰雷王冬梅
刘静静,任伟,王科,兰雷,王冬梅
(安徽医科大学附属省立医院、安徽省立医院肾脏内科,合肥 230001)
·论著·
糖尿病肾病尿毒症患者成纤维细胞生长因子23和骨保护素与桡动脉血管钙化的相关性
刘静静,任伟,王科,兰雷,王冬梅
(安徽医科大学附属省立医院、安徽省立医院肾脏内科,合肥 230001)
[摘要]目的检测糖尿病肾病尿毒症患者血清及桡动脉成纤维细胞生长因子-23(FGF-23)和骨保护素(OPG)的表达,探讨其与桡动脉血管钙化(VC)的相关性。方法选取36例糖尿病肾病尿毒症且尚未开始血液透析的患者为研究对象,并选取年龄、性别与之相匹配的健康人群40例作为对照组。在病例组建立自体动静脉内瘘吻合手术时留取修剪下的桡动脉,行von kossa 染色检测有无钙化,并计算钙化积分;免疫组织化学检测桡动脉FGF-23和OPG的表达。测定两组血清FGF-23、OPG、血红蛋白浓度(Hb)、白蛋白(ALB)、钙(Ca)、磷(P)、全段PTH (iPTH)、糖化血红蛋白(HbA1c)、C反应蛋白(CRP)的水平。结果病例组血清FGF-23、OPG水平明显高于对照组(P<0.05)。随着血管钙化程度加重,FGF-23和OPG在血清的水平升高,并且在血管壁免疫组织化学染色阳性表达吸光度值升高,病例组血P、FGF-23、OPG与桡动脉血管钙化有相关性。结论糖尿病肾病尿毒症患者普遍存在桡动脉血管钙化,FGF-23和OPG与桡动脉血管钙化呈正相关。
[关键词]糖尿病肾病;尿毒症;成纤维细胞生长因子;骨保护素;血管钙化
血管钙化(VC)是在糖尿病、肾脏损害等疾病中常见的血管病变。尿毒症患者血管钙化为动脉中膜钙化[1],有部分学者认为,肾动脉钙化的程度是糖尿病患者进展为尿毒症的独立预测因素[2]。随着分子生物学和免疫组织化学等科研技术的发展,尿毒症患者血管钙化,被证实为一多因素参与的类似骨和软骨发育的主动调节过程,是主动的、可预防的,并且可以逆转的高度可调控的复杂的生物学过程[3]。发生机制可能为,血液循环中抑制钙化的因子如:骨保护素(OPG)、骨形态发生蛋白-7(BMP-7)、胎球蛋白A等的缺乏;以及随着肾小球滤过率下降,促进钙化的因子如:成纤维细胞生长因子-23(FGF-23)、骨形态发生蛋白-2 (BMP-2)、胰岛素样生长因素-1(IGF-1)等的增加,导致血管钙化的发生发展。FGF-23和OPG,是新近研究发现的由骨细胞、成骨细胞及血管内皮细胞分泌的与动脉血管钙化相关的蛋白因子,本文就其在糖尿病肾病尿毒症患者血清和桡动脉血管壁的表达水平与桡动脉血管钙化程度的相关性作一分析。
1对象与方法
1.1研究对象病例组:选取36例(男19例,女17例)于2014年1月至2015年1月在安徽省立医院肾脏内科住院的尚未开始血液透析治疗的糖尿病肾病尿毒症患者,平均年龄(60.3±7.5)岁。收入标准为:①有较长时间的糖尿病病史,临床上出现蛋白尿,低白蛋白血症,肾功能异常,糖尿病眼底改变,根据美国肾脏病基金会慢性肾脏病的分期:GFR水平<15 mL/min,病程大于3个月;② 完善相关检查已排除结缔组织病、乙型肝炎、甲状腺、肿瘤、遗传性疾病(多囊肾、遗传性肾炎)、梗阻性、药物等继发肾脏损害。主要排除标准:肝功能损害、严重感染性疾病、营养不良等。对照组:选取同一时间我院健康体检中心的40例(男21例,女19例)体检人群,平均年龄(63.3±10.4)岁,尿常规检查无异常,肝肾功能正常,无高血压、糖尿病等慢性病史。两组研究对象年龄、性别匹配,具有可比性。本研究所有研究对象均签署知情同意书,研究方案经本院医学伦理委员会批准。
1.2血常规及生化检查所有研究人群,空腹8 h以上,于次日清晨抽取静脉血3 mL,在我院检验科生化实验室协助下测定血红蛋白(Hb)、白蛋白(ALB)、钙(Ca)、磷(P)、全段PTH (iPTH)、糖化血红蛋白(HbA1c)、C反应蛋白(CRP)。血清FGF-23、OPG水平测定采用酶联免疫复合物法(ELISA法),严格按照试剂盒操作步骤进行检测,试剂盒为上海源叶分装美国R&D公司。
1.3病例组血管处理在病例组建立自体动静脉内瘘吻合手术时,留取修剪后废弃的桡动脉0.5~1 cm,经0.9%氯化钠注射溶液充分冲洗后,置于4%甲醛中固定48 h,标本常规脱水、石蜡包埋、切片。von kossa染色:切片经二甲苯脱蜡后,于10% 硝酸银避光浸染30 min,紫外线灯下照射30 min,经伊红-苏木素溶液中依次染色。结果判定:切片背景为红色,棕黑色为钙盐沉积。血管免疫组织化学:切片脱蜡后置于盛有枸橼酸钠缓冲液的高压锅中,煮沸2 min。冷却后,0.01%PBS缓冲液冲洗。滴加I抗,37 ℃保温箱中孵育30 min,滴加检测试剂PV-6000山羊抗兔IgG/HRP聚合物后,放置于37 ℃保温箱中孵育20 min,应用二氨基联苯胺(DAB)显色。冲洗水冲洗、苏木素复染、脱水、中性树脂封片观察。FGF-23、OPG I抗体购买于美国Bioworld Technology公司。II抗购买于北京中杉金桥生物技术有限公司。免疫组织化学结果:阳性反应细胞呈棕黄色,阴性对照无色。
1.4血管钙化程度判定von kossa染色读片标准[3]:背景为红色,钙盐沉积为棕黑色。0分,无钙盐沉积;1分,点状沉积;2分,单个片状沉积;3分,多个片状沉积;4分,弥漫性围绕管腔沉积。根据评分结果,将病例组血管分为无钙化组(0分)、轻度钙化组(1~2分)、重度钙化组(3~4分),三组间年龄、性别差异无统计学意义。
1.5血管免疫组织化学结果 每个标本随机取5个高倍镜视野观察。依照细胞阳性着色程度分级,弱阳性1分;中等强度2分;强阳性3分。依照阳性细胞总数分级为:<25%,≥25%且<49%,≥50%。采用积分综合计量对每个标本进行评分分级。
1.6统计学处理采用SPSS 16.0 统计软件进行分析,计量资料比较采用两样本比较t检验及单因素方差分析,两两比较采用LSD 法,血管钙化程度与各血清指标之间的关系采用Spearman 相关分析,FGF-23和OPG与各指标之间的相关性采用Pearson 相关分析。P<0.05为差异有统计学意义。
2结果
2.1两组生化指标分析病例组血清FGF-23、OPG、P、iPTH、 CRP水平均明显高于对照组,差异均有统计学意义(均P<0.05)。病例组血清Hb、ALB、Ca均明显低于对照组,差异均有统计学意义(均P<0.05),见表1。
2.2病例组血管钙化情况36例糖尿病肾病尿毒症患者桡动脉标本中,有16例发生钙化(44.4%),钙化均发生在动脉中膜,其中轻度钙化4例(11.1%),中度钙化8例(22.2%),重度钙化4例(11.1%),见图1。在三组间比较,血P、FGF-23、OPG水平差异有统计学意义(P<0.05)。LED法组间比较重度钙化组与轻度钙化组差异有统计学意义(P<0.05),见表2。
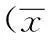
表1 两组各项生化指标的比较±s)
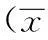
表2 不同桡动脉钙化积分组的血清学指标比较±s)
2.3免疫组织化学分析在所有钙化组标本中,桡动脉均可见FGF-23、OPG的表达,见图2,3。重度钙化组与轻度钙化组阳性表达差异有统计学意义(P<0.05)。
2.4相关性分析Spearman 相关分析提示血清P、iPTH、CRP水平与血管钙化呈正相关。Pearson 相关分析提示血清FGF-23、OPG水平与血P水平呈正相关,见表3。
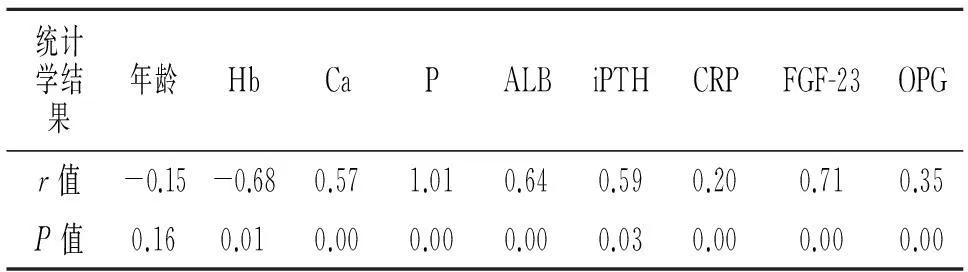
表3 桡动脉钙化积分与其他血清学指标的相关性分析
3讨论
糖尿病导致的肾脏疾病是西方国家尿毒症发病的最重要的病因。流行病学研究表明,糖尿病的患病率正逐年增加,在我国因糖尿病导致的肾脏病的发病率仅次于原发性慢性肾小球肾炎之后[4]。动脉血管中膜钙化是慢性肾脏病患者最常见的并发症,亦是尿毒症患者因心血管疾病(CVD)死亡的主要预测因子[5]。超过50%的尿毒症患者死于心血管意外[6]。糖尿病肾病尿毒症患者因高血糖、高血脂、高血磷等复杂因素致血管内皮功能障碍,其血管钙化发生率较慢性肾小球肾炎等导致的尿毒症更早期、更常见[7]。
FGF-23是主要由骨细胞分泌的重要的血清磷调控蛋白,在肾脏的无机磷代谢中发挥重要作用,而血磷是导致血管钙化的重要病理生理基础。已有国外学者研究发现,FGF-23是影响尿毒症患者血管钙化的独立影响因素,是尿毒症患者死亡风险的独立预测因子[8]。我们通过对糖尿病肾病尿毒症患者桡动脉血管钙化和血清FGF-23水平变化的研究,进一步探讨糖尿病肾病尿毒症患者FGF-23与血管钙化的关系。
FGF-23可以通过抑制近端肾小管对磷的重吸收,并促进尿磷的排泄;同时抑制1α-羟化酶的活性,减少1,25(OH)2D3的合成,以减少肠道磷的吸收,从而调节血清中磷的动态平衡[9]。在正常人及有残余肾功能的患者,尿中可发现有FGF-23的C肽片段,但在尿毒症患者,随着残余肾功能的丧失,FGF-23的排泄率降低,其在血清水平逐渐升高,但此时即使较高浓度的血FGF-23水平,磷的清除也不会增加,导致高磷血症。高磷血症进一步刺激FGF-23明显升高,升高的FGF-23使1,25(OH)2D3的合成减少,导致继发性甲状旁腺功能亢进症。本研究结果显示,糖尿病肾病尿毒症患者的血清FGF-23明显升高,与国外大量研究结果一致。
国外多个研究发现,尿毒症患者血清OPG水平与血管钙化程度呈正相关,是尿毒症患者心血管病死率的独立预测因子[10]。Moe等[11]的研究发现,尿毒症患者血管钙化程度与血清OPG浓度呈正相关。OPG可由骨骼细胞及血管内皮细胞产生,其可抑制破骨细胞生成,还抑制破骨细胞的骨吸收功能。现在越来越多的研究指向OPG的血管内皮功能维持和保护方面。其发挥作用可能是通过OPG-OPGL-RANK信号途径进行调节的。动物实验研究表明[12],敲除小鼠OPG基因,使小鼠体内缺乏OPG。小鼠即表现出现严重的动脉血管钙化及骨质疏松。但是在动物试验中,予以重组骨保护素治疗妊娠中期骨保护素基因缺乏小鼠治疗可逆转骨质疏松,而且这种基因型小鼠钙化则被显著抑制,血管钙化发生率大大降低。故有学者认为[13],OPG是血管保护因子,其通过防止血管钙化起作用。但是有研究[14]发现尿毒症患者及急性心肌梗死伴发心力衰竭患者血清OPG浓度升高,与本文研究结果相符,然而这似乎与OPG的血管保护作用相反。有研究[15]结果显示,给以缺乏低密度脂蛋白(LDL)受体的小鼠高脂饮食,并检测小鼠体内的OPG,发现其水平较前明显升高,若再予以OPG治疗,这些小鼠动脉钙化水平较前明显减轻。因此证实在血管钙化、粥样硬化及其他形式的血管受损的疾病中,OPG水平升高是机体对抗血管损害进一步进展的自我保护的代偿机制,即OPG水平升高,不是导致动脉钙化的原因,而是防止血管损害加重的保护机制[16]。在本实验研究中,病例组血清OPG水平明显高于对照组,且随着桡动脉血管钙化程度加重,血清OPG水平升高。本研究结果显示,血清FGF-23、OPG水平与血管钙化存在正相关关系,血清FGF-23、OPG参与了糖尿病肾病尿毒症患者血管钙化的发生发展,其是否是糖尿病肾病尿毒症患者发生血管钙化的预警指标值得我们进一步研究。
(本文图1~3见插图2-3)
参考文献
[1]常明,刘红,刘书馨,等.尿毒症患者血管钙化及相关因素的研究[J].中华肾脏病杂志,2006,22(9):578-579.
[2]Chiu YW,Adler S,Budoff M,et al.Prevalence and prognostic significance of renal artery calcification in patients with diabetes and proteinuria.[J].J Amer Soc Nephr,2010,5(11):2093-2100.
[3]王科,任伟,汪鹏,等.终末期肾脏病患者血清ucMGP及PIVKA—Ⅱ与桡动脉钙化的相关性[J].安徽医科大学学报,2014,49(4):505-508.
[4]王宓,王梅,李四君,等.慢性肾脏病5期非透析糖尿病与非糖尿病患者血管钙化情况的比较 [J].中国血液净化,2009,8(3):130-133.
[5]Sarnak MJ,Levey AS,Schoolwerth AC,et al.Kidney disease as a risk factor for development of cardiovascular disease: a statement from the american heart association councils on kidney in cardiovascular disease,high blood pressure research,clinical cardiology,and epidemiology and prevention[J].Hypertension,2003,42(17):2154-2169.
[6]Go AS,Chertow GM,Fan D,et al.Chronic kidney disease and the risks of death,cardiovascular events,and hospitalization.[J].N Engl J Med,2004,351(13):1296-1305.
[7]Taketani Y,Shuto E,Arai H,et al.Advantage of a low glycemic index and low phosphate diet on diabetic nephropathy and aging-related diseases [J].J Med Invest,2007,54(3/4):359-365.
[8]Nasrallah MM,El-Shehaby AR,Salem MM,et al.Fibroblast growth factor-23 (FGF-23) is independently correlated to aortic calcification in haemodialysis patients[J].Nephrol Dial Transplant,2010,25(8):2679-2685.
[9]Jüppner H,Wolf M,Salusky IB.FGF-23: More than a regulator of renal phosphate handling?[J].J Bone Miner Res,2010,25(10):2091-2097.
[10] Gábor S,Bertalan CF,Taha EHO,et al.Serum osteoprotegerin level,carotid-femoral pulse wave velocity and cardiovascular survival in haemodialysis patients[J].Nephrol Dial Transplant,2008,23(10):3256-3262.
[11] Moe SM,Martina R,Markus K,et al.Role of calcification inhibitors in the pathogenesis of vascular calcification in chronic kidney disease (CKD)[J].Kidney International,2005,67(6):2295-2304.
[12] Peng J,Li Y,Wang J,et al.Retracted: the effect of alendronate on the expression of osteopontin and osteoprotegerin in calcified aortic tissue of the rat[J].Eur J Pharmacol,2012,682(1/3):126-130.
[13] 徐美林,魏璇,张晓艳.骨保护素与冠状动脉疾病的研究进展[J].中华心血管病杂志,2011,39(9):876-878.
[14] Rhee EJ,Lee WY,Kim SY,et al.Relationship of serum osteoprotegerin levels with coronary artery disease severity,left ventricular hypertrophy and C-reactive protein.[J].Clinical Science,2005,108(3):237-243.
[15] Sean M,Yin T,Zina Z,et al.Osteoprotegerin inhibits vascular calcification without affecting atherosclerosis in ldlr (-/-) mice[J].Circulation,2008,117(3): 411-420.
[16] Moldovan D,Kacso IM,Rusu C,et al.Role of osteoprotegerin in vascular disorders of the end-stage renal disease patients[J].Biomarkers,2015,20(2):116-122.
(收稿日期2015-11-17)
Correlation between FGF-23 and OPG,calcification of radial artery in patients with diabetic nephropathy with uremic
LiuJingjing,RenWei,WangKe,LanLei,WangDongmei
(DepartmentofNephrology,theAffiliatedProvincialHospitalofAnhuiMedicalUniversity,Hefei230001,China)Correspondingauthor:RenWei,Email:renweisn@163.com
[Abstract]ObjectiveTo explore the correlation between serum fibroblast growth factor-23 (FGF-23) and osteoprotegerin (OPG),calcification of radial artery in patients with diabetic nephropathy patients with uremia.MethodsThirty-six diabetic nephropathy with uremia (experimental group) who did not made dialytic were recruited in nephrology department of our hospital,and 40 healthy subjects (control group) were slected as control.Radial arteries tissue were saved in experimental group in arteriovenous fistula operation,and von kossa-staining was used to detect the degree of calcification.The level of serum FGF-23 and OPG was measured by enzyme-linked immunlsorbent assay.Serum concentrations of Hb,ALB,Ca,P,iPTH,HbA1c and CRP was measured.ResultsThe experimental group′s FGF-23 and OPG were significantly higher than those of the control group.FGF-23,OPG and their expression in radial artery were increased with vascular calcification .FGF-23 and OPG were associated with advanced vascular calcification in diabetic nephropathy with uremia.ConclusionRadial artery vascular calcification is almost universal in diabetic nephropathy with uremia,there is a positive relationship between serum FGF-23,OPG and vascular calcification.
[Key words]Diabetic nephropathies;Uremia;Osteoprotegerin;Vascular calcification
基金项目:安徽省年度重点科研项目(12070403059);安徽省卫生厅立项课题(2010C040)
作者简介:刘静静,硕士,Email:924675631@qq.com通讯作者:任伟,主任医师,教授,硕士生导师,Email:renweisn@163.com
中图分类号:R587.2
文献标识码:A
DOI:10.3969/J.issn.1672-6790.2016.02.021
