973例无精子者睾丸体积、生殖激素与精液细胞学分析
2016-05-10袁长巍曹兴午李翠英
袁长巍,曹兴午,2,李翠英
(1.北京北科医院,北京 100081;2.卫生部中日友好医院男科,北京 100029)
·论 著·
973例无精子者睾丸体积、生殖激素与精液细胞学分析
袁长巍1,曹兴午1,2,李翠英1
(1.北京北科医院,北京 100081;2.卫生部中日友好医院男科,北京 100029)
目的 探讨无精子症患者睾丸体积、生殖激素水平与精液生精细胞检出结果的相关性。方法 将973例无精子症患者按WHO男性不育病因诊断分类标准分为梗阻性无精子症(OA)和非梗阻性无精子症(NOA),NOA按精液生精细胞检出结果分为生精细胞存在型和生精细胞缺乏型两组,并分别对各组患者的睾丸体积、生殖激素水平进行统计比较。结果 973例无精子症患者,明确为OA者235例 (24.15%),NOA者738例(75.85%)。NOA精液生精细胞存在型410例(55.56%),生精细胞缺乏型328例(44.44%)。NOA生精细胞存在型与缺乏型两组睾丸体积明显缩小、T、T/LH值较低,LH、FSH水平明显升高,与OA组比较差异均具有统计学意义(P<0.001);与PRL比较差异无统计学意义(P>0.05)。NOA精液生精细胞存在型与缺乏型组比较,生精细胞缺乏型睾丸体积明显缩小(P<0.001),LH、FSH水平均高于生精细胞存在型(P<0.01,P<0.05),T、T/LH及PRL水平比较差异无统计学意义(P>0.05)。结论 睾丸体积、生殖激素水平与精液细胞检出的多寡密切相关,T/LH测定对了解睾丸间质细胞功能与基膜变化有关联。
非梗阻性无精子症; 梗阻性无精子症; 生殖激素; 睾丸体积; 生精细胞
无精子症是指精液经离心镜检,连续3次均未发现精子,无精子症分为精子通路梗阻或缺如导致的梗阻性无精子症(OA)和精子发生障碍导致的非梗阻性无精子症(NOA)。由于无精子症病因较为复杂,不同病因治疗方法迥异。如何寻求切实可行的治疗途径和提高治疗效果,仍然是目前研究的热点和难点。因此,明确无精子症病因诊断及生精功能状况,将有助于指导无精子症患者选择适当的治疗方法来解决其不育的难题。精液细胞学的临床应用,丰富了男性不育的诊疗方法。田龙[1]在显微外科治疗不育症一文中,就梗阻性无精子症的定性诊断中指出:采用精液细胞学检查方法鉴定无精子症的类型,如果精液中发现精原细胞或者精母细胞,提示多为精子生成障碍,而非梗阻性因素造成的无精子症。应进行瑞姬染色并进行白细胞等其他圆形细胞相鉴别[1]。本文对973例无精子症患者进行精液细胞学检测,并结合睾丸体积及生殖激素水平进行分析比较,现报道如下。
1 资料与方法
1.1 一般资料 本研究收集2011~2014年,就诊无精子患者共973例,平均年龄(28.90±5.17)岁,欲生育年限(2.99±3.10)年。973例不育患者依据病史、查体、辅助检查、鉴别诊断及精液细胞学检查,明确为梗阻性无精子症(OA) 者235例(24.15%);非梗阻性无精子症(NOA) 者738例(75.85%)。
1.2 检测方法
1.2.1 睾丸体积测量 在室温下,患者取站立位,采用Prader椭圆型睾丸测量模型标准和测量方法进行双侧睾丸体积测量,并取双侧睾丸体积的平均值。
1.2.2 精液细胞学检测 无精子症患者精液检查按照《WHO人类精液及精子宫颈黏液相互作用实验室检验手册》的定义和方法[2],至少2次精液分析,并将精液离心沉淀后显微镜检,排除隐匿性精子症,诊断为无精子症。不育患者禁欲3~7 d后手淫取精液于取精杯内,置37 ℃水浴箱内液化,待液化后进行离心,弃上清液取沉淀物涂片,干燥后行瑞姬染色,油镜观察100个或50个细胞,分别计算各级生精细胞及支持细胞的检出率。NOA根据精液生精细胞检出有、无,分为生精细胞存在型和生精细胞缺乏型两组[3]。
1.2.3 外周血生殖激素测定 晨8:00~10:00采集空腹静脉血3 mL,离心分离血清,待检。采用化学发光仪免疫法测定血清生殖激素:睾酮(T)、泌乳素(PRL)、促黄体生成素(LH)、促卵泡刺激素(FSH)水平,化学发光仪为德国西门子公司生产的IMMULTIE CP,试剂定标液均为此设备配套试剂盒定标品,均在有效期内使用,批内和批间误差均小于10%。本院激素参考值范围:睾酮(T)8.36~28.69 nmol/L;泌乳素(PRL)44.52~375.24 mIU/L;促黄体生成素(LH),0.8~7.6 IU/L;促卵泡刺激素(FSH)0.7~11.1 IU/L。
2 结 果
NOA患者生精细胞存在型与生精细胞缺乏型两组的睾丸体积明显缩小,T、T/LH值较低,而LH、FSH均值升高,与OA组比较,差异有统计学意义(P<0.001),PRL比较均无统计学差异(P>0.05)。NOA精液生精细胞缺乏型睾丸体积明显小于生精细胞存在型,差异有统计学意义(P<0.001),与LH、FSH均值比较,差异有统计学意义(P<0.01,P<0.05),而T、T/LH及PRL均值比较差异均无统计学意义(P>0.05),见表1。
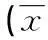
表1 973例NOA生精细胞存在型和缺乏型与OA睾丸
*:P<0.001,与OA比较;△:P<0.001,#:P<0.01,□:P<0.05,与NOA生精细胞存在型比较。
3 讨 论
3.1 生殖激素测定应使用或换算为法定单位 由于使用方法不同和试剂盒来源不同,生殖激素正常参考值和使用单位差异,临床上法定单位(国际单位)与非法定单位均在使用,应根据生殖内分泌的法定单位与非法定单位互换系数换算,临床根据这些指标结果,结合特殊检查和患者的症状和体征,综合分析,作出判断,常用换算表[4]。
3.2 睾丸体积与生殖激素关系 睾丸是精子产生和雄激素合成及分泌的重要场所,其主要由生精细胞、支持细胞、间质细胞等组成。各类细胞在下丘脑-垂体-睾丸轴的严格调节和控制下发挥相应作用,如果睾丸内的细胞成分发生改变,将会影响到睾丸的体积和生殖激素水平,并反馈引起下丘脑、垂体的调控失衡[5]。睾丸体积和生殖激素水平发生改变,将有可能影响睾丸内各类细胞的生理性改变向病理性发展,是造成睾丸生精功能障碍并最终表现为NOA的重要因素。本结果研究表明,NOA生精细胞存在型和缺乏型的睾丸体积明显小于OA;NOA生精细胞缺乏型睾丸体积又明显小于生精细胞存在型,说明睾丸体积的大小与睾丸内精子的正常发生密切相关,与睾丸内支持细胞高度、功能和生精细胞的多寡密切相关[6-7]。本结果显示在NOA患者中,睾丸体积愈小,精液中生精细胞的检出率可能为“0”。
3.3 生殖激素测定在睾丸损伤诊断中的作用
3.3.1 泌乳素PRL 是垂体远侧细胞分泌的肽类激素,在男性主要是增强间质细胞上LH的受体作用,刺激促性腺释放激素合成,对生精过程刺激作用。若血液中浓度过高,使下丘脑分泌的GnRH减少,造成下丘脑-垂体-睾丸轴的功能降低,可导致血浆FSH、LH和睾酮水平下降。出现性欲减退、阳痿、少精子或无精子。若过低亦可以造成少、弱精子,精囊功能减退与睾丸水平下降[8]。本次结果显示,OA与NOA组之间及NOA生精细胞存在型与缺乏型之间比较,差异均无统计学意义(P>0.05)。
3.3.2 睾酮T 睾酮由间质细胞合成分泌,是生精过程中的主要调节激素,约占人体雄激素的95%。睾酮是睾丸产生的主要抑制FSH和LH分泌的激素。血清抑制素B水平与血清FSH的水平、睾丸大小和精子数量呈显著负相关[9]。睾丸支持细胞分泌的抑制素对垂体FSH的分泌起抑制与平衡作用,FSH升高意味两者功能失衡。在睾丸内睾酮为旁分泌作用,在生精小管内高浓度的雄激素也是通过局部调节机制来实现的。支持细胞产生多种物质可对间质细胞或生精小管内的精子发生产生效应。间质细胞产生的雄激素可调节生精小管功能和支持细胞功能。肌样细胞分泌旁分泌因子,调节支持细胞功能[10]。本实验结果为NOA生精细胞存在型与缺乏型T 均明显低于OA,两者比较差异均有统计学意义(P<0.001);NOA生精细胞存在型与缺乏型比较差异无统计学意义。
3.3.3 黄体生成素LH 本实验结果OA与NOA两组之间,生精细胞存在型与缺乏型之间差异均有统计学意义(P<0.001);由于T与LH在睾丸中,处于相互作用、相互制约、相互调控、相互平衡关系状态,为此考量其线性平衡关系,不如考量其逻辑的比例关系,会更有临床意义与应用价值。本结果NOA生精细胞存在型与缺乏型T/LH比值均小于OA组,两者比差异有统计学意义(P<0.001),NOA生精细胞存在型与缺乏型之间T/LH比值比较,差异无统计学意义。
3.3.4 促卵泡刺激素FSH 本结果OA与NOA生精细胞存在型及缺乏型比较差异均有统计学意义(P<0.001);生精细胞存在型与缺乏型差异有统计学意义(P<0.05)。血清FSH水平升高提示生精上皮受损,生精功能障碍,同时血清FSH升高程度与支持细胞-生精小管嵌合体(血-睾屏障的组成部位)受损程度成正比[11]。当无精子、睾丸小而软,FSH高于2倍以上,已能够说明睾丸的生精功能严重损伤,不必行睾丸活检证实诊断。睾丸内是否存在生精细胞,进行精液细胞学检查对睾丸功能评估有意义。如果睾丸体积正常,血清FSH在正常范围的无精子患者,可初步确定梗阻性无精子症的诊断,进一步确定病因、部位和范围需进一步探查。本结果OA组睾丸体积和生殖激素测定均在正常范围之内。
3.3.5 T/LH的比值与FSH结果进行讨论商榷 生殖激素测定的意义在于,可对不同类型的不育者,如VC、附性腺感染不育、免疫不育、获得性睾丸损害不育等,判断睾丸损伤程度,可依据FSH、LH升高和T下降与睾丸损伤程度成正比的关系,来制定治疗方案和判断预后的依据。睾丸体积缩小而FSH明显升高,即可判断睾丸生精功能有明显损害,若同时伴有T/LH值的明显降低或单独T值明显降低,又可以判断睾丸生精小管和间质细胞的同时损害。LH及T的测定主要观察睾丸间质细胞功能,而与睾丸体积大小不成正比关系。T/LH比值是间质细胞功能障碍更敏感的指标,正常情况下,T/LH应大于2.12,当T/LH比值下降,说明间质细胞功能已有损害[12]。从T/LH比值与睾丸容积看,刘睿智[13]报道147例非嵌合型克氏综合征与T/LH值:年龄范围25~31岁;睾丸大小左3.4~7.33 mL;精液量1.84~2.91 mL;T:6.77~8.68 nmol/L;LH:19.47~25.68 IU/L;T/LH比值0.35~0.34;FSH 21.47~35.28 IU/L。结果显示睾丸体积小、无精子、无生精细胞的睾丸体积越小;生殖激素处于高促状态,支持细胞功能减退;T/LH比值都小于1,睾丸损伤基膜区,间质细胞分泌睾酮水平降低。杨慎敏等[14]报道,355例不同类型AZF微缺失的临床特点比较,年龄21~45岁(平均28.5岁),分析:睾丸总体积为20~33 mL;T为11.16~13.83 nmol/L;LH为4.81~6.26 IU/L;T/LH比值为2.06~2.56;FSH为11.08~13.41 IU/L。从上面前后两组数据比较看,充分说明睾丸容积太小与T/LH比值密切相关性,睾丸容积小于10 mL者T/LH比值小于1;睾丸容积大于20 mL者T/LH比值大于2。本结果在OA中睾丸容积平均为大于14 mL,(14.59±2.63),T/LH比值为2.94±2.0;而NOA生精细胞有无,睾丸均小于10 mL(10.4±3.91;8.15±4.03),T/LH比值小于1.6(1.57±1.11;1.45±1.23)。总体参考指标小于2.2。
冯俭等[15]报道对男性不育400例生殖激素水平测定分析结果,血清T值在不同的精子密度层次的男性不育症患者,均呈正态分布,当FSH、LH上升,T/LH的比值下降提示睾丸功能损害伴睾丸容积减少,并且T/LH的比值更能反映睾丸间质细胞的功能。若T/LH值的明显降低或单独T值明显降低,可判断睾丸生精小管和间质细胞的同时损害[16]。
生精细胞学检测,可作为梗阻与非梗阻无精子患者的鉴别诊断的方法之一,对鉴别诊断起关键作用;采取T/LH比值计算,抑制素B的检测对判断睾丸功能损伤具有预见性,值得提倡与应用;生殖激素测定一定采用法定单位,一是遵法,二是与国际数值接轨;精液生精细胞的有无和多寡常决定诊疗的成败,应积极开展。
[1]田龙.显微外科治疗男性不育症.李宏军,黄宇烽.实用男科学[M].2版.北京:科学出版社,2015:485-488.
[2] WHO.谷翊群,陈振文,于和鸣等译.人类精液及精子宫颈黏液相互作用实验室检验手册[M].4版.北京:人民卫生出版社,2001:48-49.
[3]曹兴午,杨文质,赵广明.精液分析与不育症[M].北京:人口出版社,2006:145-147.
[4]李宏军,黄宇烽.实用男科学[M].2版.北京:科学出版社,2015:101.
[5] 钟影,吴东,艾玲,等.272例无精子男性睾丸与生殖激素测量结果分析[J].四川医学,2013,23(10):1000-1002.
[6]曹兴午,齐来增,施长春,等.精索静脉曲张、AZFc缺失和腮腺炎史一例病例报告[J].生殖医学杂志,2013,22(12):958-962.
[7]曹兴午,施长春,齐来增,等.严重少精子症治疗成功1例报告——文献复习与回顾性分析[J].生殖医学杂志,2014,23(5):408-410.
[8]杨振华.现代男性不育诊疗学[M].上海:上海科学技术文献出版社,2007:48.
[9]李宏军,李汉忠.男科学[M].3版.北京:北京大学医学出版社,2013:25.
[10]吴明章,林其德.生殖疾病诊断学[M].上海:上海科学技术出版社,2006:20-22.
[11] 陈荣安,房秉仁,欧阳贵,等.不同病因无精子症的生殖激素水平[J].生殖与避孕,2002,22(2):111-113.
[12]郭应禄,胡礼泉.男科学[M].北京:人民卫生出版社,2004:985.
[13]刘睿智.男性生殖医学新进展[J].中国性科学杂志,2012,28(12):1230-1232.
[14]杨慎敏,李海波,温端改,等.无精子症患者中无精子因子微缺失分布[J].生殖医学杂志,2013,22(3):159-163.
[15]冯俭,张水林,吴志君,等.男性不育400例生殖激素水平测定分析[J].南通医学院学报,2001,21(1):53-54.
[16] Rodrigaucs-Rigau LJ.Harmomal control of spermatogenesis inman.Comparison.With the rat.In:steinberger A,Steinberger E,Testiculardevelopment,structure and function[J].New York:Rovenpress,1980,26(2):139.
The analysis study based on 973 azoospermia patients′ testicular volume,reproductive hormones and sperm cytological
YuanChangwei1,CaoXingwu1,2,LiCuiying1
(1.BeijingBeikeHospital,Beijing100081,China; 2.DepartmentofAndrology,China-JapanFriendshipHospital,Beijing100029,China)
Objective To investigate the correlation between the testicular volume and reproductive hormones level with sperm cytological detection results in azoospermic patients.Methods Based on the WHO male infertility etiology diagnosis classification criteria,973 azoospermic patients were divided into the obstructive azoospermia(OA) and non-obstructive azoospermia(NOA).Then NOA was divided into the existing spermatogenic cells type group and non-existing spermatogenic cells type group according to the sperm spermatogenic cell detection results.The testicular volume and reproductive hormones levels were statistically analyzed and compared among various groups.Results In 973 azoospermia patients,235 cases were OA (24.15%) and 738 cases were NOA (75.85%).There were 410 cases (55.56%) of existing spermatogenic cells type and 328 cases(44.44%) of non-existing spermatogenic cells type.The testicular volume in the existing spermatogenic cells type group and non-existing spermatogenic cells of NOA was clearly reduced,the T and T/LH were lower,while the LH and FSH levels were significantly increased,the difference between the OA group and the NOA group had statistical difference (P<0.001),but PRL had no statistical difference between them (P<0.05).The testicular volume of existing spermatogenic cells type was smaller than non-existing spermatogenic cells type (P<0.001).The LH and FSH levels were higher than those of existing spermatogenic cells type (P<0.01,P<0.05); T,T/LH and PRL levels had no statistical difference (P>0.05).Conclusion The testicular volume and reproductive hormones level are closely related with the detection quantity of sperm cells and the detection of T/LH is helpful for understanding the relation between the function of leydig cells and basement membrane change.
non-obstructive azoospermia; obstructive azoospermia; reproductive hormones; testicular volume; spermatogenic cell
袁长巍,男,主管检验师,主要从事男科实验室诊断及精液细胞学研究。△通讯作者,E-mail:jyxcxw@163.com。
10.3969/j.issn.1673-4130.2016.07.022
A 文章编号:1673-4130(2016)07-0925-03
2015-11-28)
